NF-κB在细胞凋亡中的调节作用和应用前景
2011-03-14张勇崔岩
张 勇 崔 岩
(沈阳农业大学畜牧兽医学院,沈阳 110866)
近些年来,随着生活水平的日益提高,消费者对畜产品的品质要求也越来越高,肉品质的提高毫无疑问成为当下讨论的热点之一,而嫩度则是衡量肉品质的一项重要指标。宰后肌肉嫩化是改善肌肉嫩度的重要途径之一,肌肉嫩化的发生普遍认为是肌细胞的细胞骨架降解造成的[1]。而目前对于细胞骨架降解的机理研究大部分集中在钙激活酶系统、组织蛋白酶系统和蛋白酶体上,有关于细胞凋亡在肌肉嫩化中的作用国内外还鲜见报道。据证实,核转录因子 -κB(nuclear factor-kappa B,NF-κB)与细胞凋亡存在密切关系,并参与多种凋亡相关基因的转录调控[2]。
1 NF-κB概述
1.1 NF-κB的组成
NF-κB最早是于 1986年由 Sen和 Baltimore发现,他们应用凝胶电泳迁移率方法在 B淋巴细胞核提取物中检测到一种能与免疫球蛋白 κ轻链基因的增强子 κB序列(GGG ACT TTCC)特异结合的核蛋白因子,并命名为 NF-κB。 NF-κB是细胞核内重要的转录调节因子,是细胞存活、细胞周期、细胞黏附和迁移的重要调节者[3]。
NF-κB是由 NF-κB/Rel蛋白家族成员 NF-κB1(p50,前体为 p105)、NF-κB2(p52,前体为 p100)、RelA(p65)、RelB和 C-Rel以同源或异源二聚体形式组成的。所有 NF-κB/Rel蛋白的 N端均有 1段由大约 300个氨基酸组成的 Rel同源结构域(Rel homology dom ain,RHD),该结构域包括二聚体化结构域,IκB结合位点,核定位信号和 DNA结合部位(NLS)。p65、RelB和 c-Rel的 C端含有转录激活域(transactivation domain),其中富含丝氨酸、酸性氨基酸和疏水性氨基酸,能直接作用于转录元件而激活转录过程,而 p50和 p52则无此结构[4]。p50/p65发现最早,分布和作用最广泛,是我们通常所说的 NF-κB,存在于细胞浆中[5-6]。目前已知存在于细胞质中的 Rel/NF-κB蛋白复合物有 2种类型,即 Rel/NF-κB二聚体与 IκB家族结合所形成的三聚体以及 Rel蛋白与未裂解前体(如 p100)结合所形成的二聚体[7]。
1.2 NF-κB的激活
NF-κB的内源性抑制因子主要是 IκB抑制蛋白家族 ,主要包括 IκBα、IκBβ、IκBε、IκBγ、Bcl3、p105和 p100。在细胞静息状态下,NF-κB与其抑制蛋白 IκB结合,组成异源多聚体(p50-p65-IκBα或 p50-p65-IκBβ),阻止 NF-κB进入细胞核 ,以非活性复合物的形式存在于细胞质中。不同的 IκB抑制 NF-κB的能力不同,它们与 NF-κB二聚体上的 RHD发生作用,掩盖 NF-κB的 NLS,使之停留在胞质而抑制 NF-κB核易位[8]。但是处于静息状态的成熟 B淋巴细胞等极少数细胞例外,它们的胞浆中存在活化的 NF-κB。NF-κB是一类具有和某些基因上启动子区固定核苷酸序列结合而启动基因转录的功能性蛋白质,所以诸多因素可以使NF-κB促进基因转录活性增强[9]。
NF-κB的激活机制是一个较为复杂的过程,目前公认的主要有 2条途径:经典途径和旁路途径[10-11]。当细胞受到蛋白激酶 C、细胞因子、钙离子载体等细胞外信号刺激时,IκB激酶(IκB kinase,IKK)的亚单位 IKKβ由于磷酸化而激活,进而作用于 NF-κB二聚体(p50/p65)与 IκB结合的复合物,引起 IκBα被磷酸化,IκBα磷酸化进一步被泛素结合酶快速泛素化,然后在蛋白水解酶复合体作用下发生降解,从而将 NF-κB二聚体从三聚体(p50-p65-IκB)中释放出来进行核易位,与基因上的 κB位点发生特异性结合,进而转入细胞核内发挥作用[12],这个过程即为经典途径。与经典途径不同的是,旁路途径主要指 NF-κB中所含有的 p100或者 p105的二聚体被激活。在特定的细胞类型中,当细胞受到外界信号刺激后,在 NF-κB诱导激酶(NIK)的作用下使 IKKα和前体 p100磷酸化,经蛋白激酶作用诱导 NF-κB/p100产生 p52-RelB异源二聚体,并使其进入细胞核与靶基因结合参与一系列的核转录活动[13]。
除此之外,近年的研究发现,紫外线激活 NF-κB的机制与以上途径均不相同。紫外线通过激活酪蛋白激酶 2(CK 2)引起 IκBα的 C端磷酸化,从而引起 IκBα泛素化后降解。CK 2的激活不依赖 IKK而是通过 p38丝裂原活化蛋白激酶,因此 p38-CK 2-IκBα也是激 活 NF-κB的 途径之一[14]。
2 NF-κB与细胞凋亡
细胞凋亡(apoptosis)是指机体在一定生理、病理条件下为维持内环境稳定,一个细胞接受其内在指令而自动结束生命的过程。这个现象最早由Carl Vogt发现的,并将其命名为细胞凋亡[15]。其形态学改变包括细胞皱缩、染色质浓缩、核裂解成碎片等。研究表明,活化后的 NF-κB与细胞凋亡有密切关系,其参与多种凋亡相关基因的转录调控,具有抑制细胞凋亡和促进细胞凋亡的双向作用[2]。
2.1 NF-κB对细胞凋亡的抑制作用
NF-κB具有抑制细胞凋亡的作用最早是在1995年被证实的,试验中发现被剔除 RelA基因的胎鼠发育到 15~16 d时死亡,并伴随着肝细胞的大量凋亡,其机制是通过肿瘤坏死因子受体 1(tumor necrosis factor receptor1,TNFR1)介导发挥作用[16]。NF-κB对细胞凋亡的抑制过程是一个涉及多个信号通路的复杂过程,其主要是通过对下游抗凋亡基因的转录激活作用来实现的,这些基因包括 IEX-IL、Bcl-2家族、c-FLIP以及 IAP(inhibitor of apoptosis)家族的 XIAP、c-IAP-1、c-IAP-2等,其调节位点上均有 NF-κB的结合位点[17],它们的产物通过作用于细胞凋亡酶 -3(caspase-3)和线粒体的上游而发挥作用。例如,在纤维肉瘤细胞中 ,NF-κB诱导 c-IAP-1、c-IAP-2、TNFR1和TNFR2共同表达,抑制细胞凋亡酶 -8(caspase-8)活性,阻断细胞色素 C释放,从而抑制细胞凋亡。众所周知,细胞色素 C是 caspase-3激活的促发因素,是调控的关键环节。又如 B淋巴细胞中,CD40诱导的抗凋亡也需要 NF-κB参与,通过上调 Bcl-2、Bcl-X表达而发挥作用,如果阻断 NF-κB的激活就会消除上调作用而无法起到抗凋亡作用。
随着研究的深入,人们发现 NF-κB的抗细胞凋亡作用与越来越多的信号途径有关。A 20是一种锌指蛋白,研究表明,NF-κB可以通过调控 A 20蛋白的表达影响由 TNF诱导的细胞凋亡过程[18]。Gadd45β是一种核蛋白,研究发现,NF-κB是其上游的调节因子,可以通过调节其表达来影响激酶(JNK),进而抑制细胞凋亡的过程[19]。
2.2 NF-κB对细胞凋亡的促进作用
在对 NF-κB的抗细胞凋亡作用的研究同时,一些证据则显示在不同的刺激因素和特定的细胞类型中,NF-κB对细胞凋亡具有促进作用。Baichwal等[20]报道,人的胚胎肾细胞系 293在血清撤除时随着 NF-κB的活化而发生细胞凋亡,NF-κB的负显性突变基因已具有同样的结果。Dumont等[21]报道,抑制 NF-κB的活性可以使 T细胞免于由过氧化氢诱导的细胞凋亡。Ivanov等[22]发现,在紫外线诱导黑色素瘤细胞凋亡的过程中 NF-κB的表达下调,细胞凋亡也随之减少。Campbell等[23]则发现,NF-κB是通过抑制抗凋亡基因而促进细胞发生凋亡。Chen等[24]在肿瘤坏死因子相关凋亡途径的研究中发现,当 RelA过量表达时,呈现对细胞凋亡的抑制作用,当 c-Rel表达增加时,则呈现对细胞凋亡的促进作用。由此可见,NF-κB在细胞凋亡中的双向作用不仅取决于不同的刺激因素和细胞类型,也与激活的 NF-κB成员的种类和数量有关。
3 细胞凋亡与宰后肌肉嫩化
动物被屠宰放血后,肌细胞便失去营养基质的供给,血液循环的终止导致肌细胞没有氧气运输的途径。缺血使细胞酸中毒,缺氧使线粒体内三羧酸循环受抑制,心肌转向糖酵解以寻求能量的补充,糖酵解产生大量乳酸堆积在心肌中引起细胞内 H+浓度增高,从而使 Na+/H+交换增强,H+流出胞外而 Na+流入胞内,造成细胞内 H+浓度下降,pH升高,Na+超载,继而引起 Na+/Ca2+交换增加,并引起 Ca2+超载。在这种非常有害的生理条件下,细胞内产生了凋亡信号,很有可能诱发肌细胞强制性死亡。正如 Ouali等[25]推断,动物宰后应该有一个细胞凋亡的过程,如图 1所示。
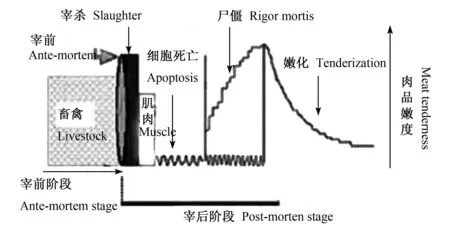
图 1 宰后肌肉转化为肉的过程Fig.1 The process ofmuscle transformed tomeat after slaughter
宰后肌肉的成熟嫩化对嫩度的改善主要归因于对肌肉结构蛋白的有限降解。而大量试验已经证明,在细胞凋亡过程中,一些细胞凋亡酶参与细胞骨架和结构蛋白的降解。如 Communal等[26]研究证实了 caspase-3在体外条件下参与心肌多种骨架蛋白的降解过程。黄明等[27]在试验中发现caspase-3的专一抑制剂可以使鸡肉样品的多种骨架蛋白降解受抑制。从微观角度看,肌肉的成熟嫩化是肌细胞发生凋亡进而继发性坏死的过程,因此,细胞凋亡与肌肉的成熟嫩化有着密切的关系。
4 NF-κB在肌肉嫩化机制研究中的前景
肌肉嫩化机理学说有很多种,如肌肉自身成熟机制的“酶假说”,认为钙蛋白酶(calpain)系统经肌质网释放 Ca2+激活后,calpain对细胞骨架进行降解,导致细胞支撑体系瓦解,从而改善肌肉的嫩度。对此已有报道研究了不同饲喂方式、不同的饲粮蛋白质水平对猪背最长肌钙蛋白酶抑制蛋白表达量及嫩度的影响[28-29]。又如外界刺激导致肌肉成熟机制的理论,认为通过一定外界刺激加强肌肉收缩,肌动蛋白细丝过度插入引起 Z线断裂,肌原纤维结构松弛,进而改善肌肉的嫩度[30]。而目前,国内外研究人员均没有对动物屠宰后骨骼肌细胞的凋亡在肌肉嫩化中的作用机制进行深入研究。
NF-κB广泛存在于多种组织细胞中,激活后参与多种因子的转录调控,与细胞的凋亡存在密切关系。研究表明,NF-κB可以促进细胞凋亡,激发细胞凋亡酶家族,降解细胞骨架蛋白[4]。NF-κB很可能参与了肉的嫩化过程,然而对于 NF-κB的研究大部分停留在人类和动物的疾病防预及治疗方面,在动物肉品质上的研究甚少。因此,深入研究二者之间的联系,便可以通过对 NF-κB的调节来诱导细胞凋亡,控制凋亡速率,进而可以缩短肌肉的成熟嫩化时间,调控和改善肉品质。
5 小 结
NF-κB是一种多功能转录因子,以往多限于在免疫细胞及各种疾病中的研究,在骨骼肌中,其研究刚刚起步。NF-κB在细胞凋亡中的作用已经逐渐明朗,细胞凋亡与肌肉嫩度的关联性也得到证实,因此,在动物营养领域的研究中,对 NF-κB作用的研究将极具前景。
[1] 李胜杰,胡忠良,郭向莹,等.细胞凋亡对肌肉宰后嫩化的贡献[J].食品工业科技,2010,4(31):395-398.
[2] DUTTA J,FAN Y,GUPTA N,et al.Current insights into the regulation of p rogramm ed cell death by NF-kappa B[J].Oncogene,2006,25:6800-6816.
[3] KARIN M.Nuclear factor-kappa B in cancer development and progression[J].Nature,2006,441(7092):431-436.
[4] 苏剑东,吴灵飞.NF-κB与细胞凋亡[J].世界华人消化杂志,2007,15(12):1411-1416.
[5] GHOSH S,MAY M J,KOPP E B.NF-kappa B and Rel proteins:evolutionarily conserved mediators of immune responses[J].Annual Review Immunology,1998,16:225-260.
[6] HUXFORD T,MALRK S,GHOSH G.Structure and mechanism in NF-kappa B/I kappa B signaling[J].Cold Spring Harbor Symposia on Quantitative Biology,1999,64:533-540.
[7] PEREIRA S G,OAKLEV F.Nuclear factor-kappa B1:regu lation and function[J].The International Journal of Biochem istry and Cell Bio logy,2008,40(8):1425-1430.
[8] MALEK S,HUANG D B,HUXFORD T,et al.X-ray crystal structure ofan Ikappa Beta×NF-kappa B p65 homodimer comp lex[J].The Journal o f Bio logical Chem istry,2003,278:23094-23100.
[9] UEDA M,KOKURA S,IMAMOTO E,et al.Blocking o f NF-κB activation enhances the tumor necrosis factorα-induced apoptosis of a human gastric cancer cell line[J].Cancer Letters,2003,193(2):177-182.
[10] BON IZZIG,KARIN M.The two NF-kappa B activation pathw ay and their role in innate and adaptive immunity[J].Trends in Immunology,2004,25(6):280-288.
[11] LUO JL,KAMATA H,KARIN M.IKK/NF-kappa B signaling:balancing life and death-a new app roach to cancer therapy[J].The Journal of Clinical Investigation,2005,115:2625-2632.
[12] KARIN M,BEN-NEFINH Y.Phosphorylation meets ubiquitination:the control o f NF-κB activity[J].Annual Review of Immunology,2000,18:62l-663.
[13] SENFTLEBEN U,CAO Y,X IAO G,et al.A ctivation by IKK alpha of a second,evo lutionary conserved,NF-kappa B signaling pathway[J].Science,2001,293(5534):1495-1499.
[14] ESCARCEGA R O,FUENTES-ALECANDRO S,GATICA A,et al.The transcription factor nuclear factor-kappa B and cancer[J].Clinical Onco logy,2007,19(2):154-161.
[15] KERR J F,W YLLIE A H,CURRIE A R.Apoptosis:a basic biological phenomenon w ith w ide-ranging im plications in tissue kinetics[J].British of Journal of Cancer,1972,26:239-257.
[16] DOI T S,MATINO M W,TAKAHASHIT,et al.Absence of tum or necrosis factor rescues RelA-deficientm ice from embryonic lethality[J].Proceeding of the National Academy Sciences of the United States of America,1999,96(6):2994-2999.
[17] VERMEULEN L,VANDEN B W,HAEGEMAN G.Regulation o f NF-kappaB transcriptional activity[J].Cancer Treatment and Research,2006,130:89-102.
[18] MALEWICZ M,ZELLER N,YILMAZ Z B,et al.NF-κB controls the balance betw een Fas and tumor necrosis factor cell death pathways during T cell receptor-induced apop tosis via the exp ression of its target gene A 20[J].The Journalof Biological Chem istry,2003,278:32825-32833.
[19] ZAZZERONI F,PAPA S,ALVAREZ K,et al.Gadd45βmediates the protective effects of CD 40 costimulation against Fas-induced apop tosis[J].Blood,2003,102(9):3270-3279.
[20] BA ICHW AL R,BAEUERLE A.Apoptosis:activate NF-κB or die?[J].Current Biology,1997,7(2):94-96.
[21] DUMONT A,HEHNER S P,HOFMANN T G,et al.Hydrogen peroxide-induced apoptosis is CD 95-independent,requires the release o f m itochondria-derived reactive oxygen species and the activation of NF-kappa B[J].Oncogene,1999,18(3):47-757.
[22] IVANOV V,RONA IZ.P38 p rotects human melanoma cells from UV-induced apoptosis through dow nregu lation of NF-kappa B activity and Fas exp ression[J].Oncogene,2000,19:3003-3012.
[23] CAMPBELL K J,ROCHA S,PERK INS N D.Active repression of antiapoptotic gene expression by RelA(65)NF-kappa B[J].Mo lecular Cell,2004,13(6):853-865.
[24] CHEN X,KANDASAMY K,STIVASTAVA R K.Differential roles of RelA(65)and c-Rel subunits o f nuclear factor kappa B in tumor necrosis factor-related apoptosis-inducing ligand signaling[J].Cancer Research,2003,63:1059-1066.
[25] OUALIA,HERRERA-MENDEZC H,COULIS G,et al.Revisiting the conversion of m uscle into meat and the underlying mechanisms[J].Meat Science,2006,74(1):44-58.
[26] COMMUNAL C,SUMANDEA M,TOMBE P,et al.Functional consequences of caspase activation in cardiac m yocy tes[J].Proceedings o f the National A-cadem y of Sciences of the United States o f America,2002,99(9):6252-6256.
[27] 黄明,赵莲,徐幸莲,等.鸡肉在成熟过程中肌原纤维蛋白的降解机制研究[J].农业工程学报,2007(11):42-46.
[28] 张勇,李方方,朱宇旌,等.日粮不同蛋白质水平对猪骨骼肌钙蛋白酶抑制蛋白和钙蛋白酶基因表达及嫩度的影响[J].动物营养学报,2008,20(3):360-365.
[29] 张勇,高彦,朱宇旌,等.不同饲喂方式对猪背最长肌钙蛋白酶抑制蛋白和钙蛋白酶基因表达及剪切力的影响[J].动物营养学报,2010,22(3):640-646.
[30] KEMPC,PARR T.Comparison of the relative expression of caspase isoforms in differentporcine skeletalmuscles[J].Meat Science,2006,73:426-431.
