秸秆降解菌株的诱变选育及发酵条件的研究
2011-03-12黄晓梅陈秀玲范金霞
黄晓梅,杨 谦,陈秀玲,范金霞,徐 杰
(1.哈尔滨工业大学生命科学系,150001哈尔滨,yangq@hit.edu.cn;2.东北农业大学园艺学院,150030哈尔滨)
采用微生物降解将纤维素转化成乙醇、单细胞蛋白、有机酸等已成为纤维素资源再生利用研究的热点.自然界当中能分解纤维素的生物主要是真菌类及部分细菌,以木霉、曲霉、青霉的能力最突出[1-3],绿色木霉具有较强的分解天然纤维素的能力,目前被认为是最有应用前景的纤维素酶生产菌之一[4],但霉菌纤维素酶活力较低,一直是阻碍其大规模生产应用的瓶颈问题[5].目前的解决方法一是通过菌种的筛选、选育、基因工程[6]和细胞工程等手段提高纤维素酶的产量和活力,二是改变天然纤维素的结构,从而提高其对酶的敏感性.其中菌种选育是获得高效纤维素分解菌株的关键,也是纤维素酶生产的基础.紫外线诱变和化学诱变是最简单、方便又有效的诱变选育高产菌的方法,国内外科研工作者一直都在进行这方面研究,但目前还缺乏高效降解秸秆生产纤维素酶的菌株.因此,通过紫外线和硫酸二乙酯的复合诱变方法,筛选纤维素酶活高的绿色木霉变异株,并对其利用秸秆发酵条件进行研究,为利用秸秆工业化生产纤维素酶和应用提供依据.
1 试验
1.1 菌种
绿色木霉(T.viride)CICC 13038购自中国工业微生物菌种保藏中心.
1.2 培养基
斜面和平板培养基:马铃薯培养基(PDA).
筛选培养基:羧甲基纤维素钠7.5~10 g/L,(NH4)2SO41.4 g/L,脲 0.3 g/L,KH2PO42.0 g/ L,CaCl20.3 g/L,MgSO4·7H2O 0.3 g/L,蛋白胨0.5~1.0 g/L,吐温80 1.0~2.0 g/L,FeSO4· 7H2O 5.0mg/L,ZnSO4·7H2O 1.4mg/L,MnSO4· H2O 1.6 mg/L,CoCl22.0 mg/L,pH 5~6[7],刚果红0.2 g/L,琼脂20 g/L.
种子液培养基:马铃薯液体培养基(PD).
发酵产酶培养基:蛋白胨3 g/L,硫氨2 g/L,酵母膏0.5 g/L,KH2PO44 g/L,CaCl2·2H2O 0.3 g/L,MgSO4·7H2O 0.3 g/L,吐温 80 0.2 g/L,碳源23.5 g/L[8],根据研究需要,变动培养基的成分.
1.3 诱变和筛选
1.3.1 孢子悬浮液制备
取活化培养4 d的绿色木霉平板,用无菌水冲洗下孢子,通过3层无菌擦镜纸过滤至盛有玻璃珠的无菌三角瓶中,振荡15 min,使孢子分散,稀释成为1×106个/mL的孢子悬浮液.
1.3.2 复合诱变
硫酸二乙酯处理:在制备好的孢悬液中分别加入体积分数为1%~2%的硫酸二乙酯混匀,于30℃条件下黑暗振荡处理10~30 min,取50 μL孢悬液均匀涂布于PDA平板上.
紫外线照射:在暗室的无菌工作台上用30 W的紫外灯,距离30 cm照射涂布孢子的平板1~3 min,置于30℃培养箱黑暗培养5 d.并且实验设有硫酸二乙酯和紫外线单独处理的单因素诱变处理.
1.4 初筛和复筛
挑取单菌落于刚果红筛选培养基上初筛.选取纤维素透明圈与菌落直径比值大的菌落,进行3次初筛,菌株传代10代,以备进一步复筛.
初筛后的菌株按培养基体积分数的5%接入1×106个/mL的孢悬液于液体筛选培养基,进行复筛.整个培养期测定羧甲基纤维素酶活(CMCase)、滤纸酶活(FPase)、β-葡萄糖苷酶活(βGase).
1.5 发酵产酶培养
种子液制备:以PD为培养基,按培养基体积分数1%接种1×106个/mL的孢悬液,在30℃、160 r/min条件下振荡培养48 h.
发酵产酶培养:按产酶培养基体积分数的10%接种种子液,在30℃、160 r/min条件下振荡培养,定时取样测定发酵液中纤维素酶活,每个处理均重复3次.
1.6 纤维素酶活力测定
纤维素粗酶液制备:发酵液经5 000 r/min离心10 min,上清液即为粗酶液.
纤维素酶活的测定:CMCase、FPase、βGase测定方法参照文献[9],0.5 mL粗酶液加入底物1.5 mL,反应后加入2 mL DNS,煮沸10 min,测定540 nm的吸光值.测定时间为5 d.
酶活单位:用国际单位(U),即在实验条件下,每小时产生1 mg葡萄糖为1个酶活单位[10].
1.7 发酵条件优化
1)碳源对产酶的影响.选择10种碳源,组成24种组合(见表2),两种碳源以1∶1比例混合,按质量分数2.35%加入发酵产酶培养基中,每个处理均重复3次,下同.
2)碳源比例对产酶的影响.选择最优组合,两种碳源按7∶0,6∶1,5∶2,4∶3,3∶4,2∶5,1∶6和0∶7比例混合,加入液体产酶培养基中.
3)氮源对产酶的影响.根据得到的最佳碳源比例,选择11种氮源(见表3),按质量分数0.2%对氮源种类进行优化,得到最佳无机氮源和有机氮源.
4)氮源比例对产酶的影响.按质量分数0.2%将无机和有机氮源按6∶0,5∶1,4∶2,3∶3,2∶4,1∶5和0∶6比例加入培养基中,研究产酶的变化,确定最佳氮源比例.
5)碳氮比例对产酶的试验.在碳质量分数2.35%情况下,碳氮比例为9∶1、8∶1、7∶1、6∶1、5∶1、4∶1、3∶1、2∶1,进行最佳产酶碳氮比优化.
6)碳氮质量分数对产酶的影响.在碳氮比例确定的情况下,比较碳氮质量分数为1.33%、2%、2.67%、3.33%、4%、4.67%、5.33%、6%、6.67%、7.33%时产酶的变化,得到最佳产酶的碳氮质量分数.
7)起始pH对产酶的影响.用柠檬酸-柠檬酸钠缓冲液和磷酸氢二钠-磷酸二氢钠缓冲液配置不同pH值(3.6、4.0、4.4、4.8、5.2、5.6、5.8、6.2、6.4、6.8、7.2、7.6)的培养液,作为起始培养pH值,确定产酶最佳的酸碱条件.
8)温度对产酶的影响.将接种的液体培养基置于20、24、26、28、30、32、34和38℃环境中培养,比较温度对产酶的影响.
9)发酵时间对产酶的试验.从发酵的第2天开始,每隔24 h测定一次酶活,直至第9天结束.比较不同发酵时间产酶的变化.
2 结果与分析
2.1 突变株的筛选
刚果红纤维素平板透明圈筛选法可用于初步判定纤维素酶活性高低,产酶越多,透明圈越大,产酶越快,透明圈出现越早[8].从诱变后培养5 d的平板上挑取430个单菌落,经过3次刚果红纤维素平板透明圈法初筛选出25个菌株.
透明圈大小直接反映了酶活性高低,但不能完全代表菌株产酶能力,因此,必须进行液体发酵复筛.通过摇瓶产酶培养,结果表明:整个培养周期内不同菌株酶的活性有较大差异,酶活的高峰也不尽相同.经过差异显著性分析(F=93.24,df=6,P<0.01)(见表1),有6个菌株的纤维素酶活显著高于原始出发菌株的酶活,其中,h157菌株产酶最佳,CMCase比出发菌株提高72.53%、FPase提 高 42.18%、βGase提 高85.15%.通过诱变育出6株稳定、高产纤维素酶的绿色木霉突变菌株,均为复合诱变选育得到的.达到了菌种改良的目的.
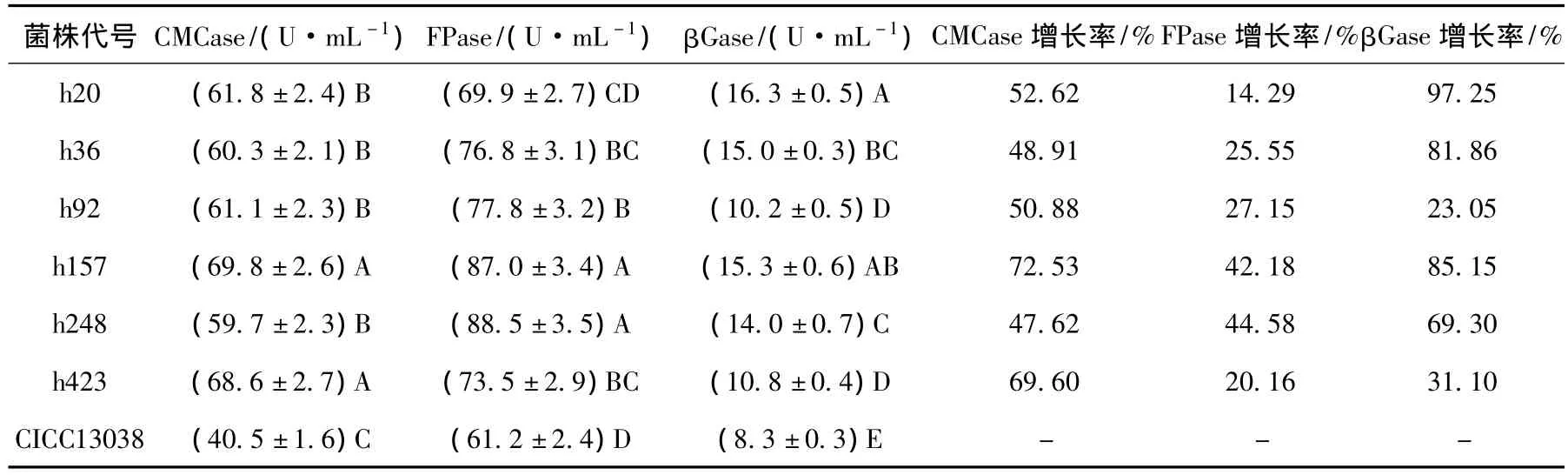
表1 复筛菌株与出发菌株纤维素酶活力比较
2.2 发酵条件优化
2.2.1 碳源对产酶的影响
纤维素酶是诱导酶,不同的底物产纤维素酶活性不同.天然纤维中含有大量的纤维素,对纤维素酶的产生有一定诱导作用.以麸皮、稻草、玉米杆为主要底物,在24种碳源组合中(表2),纤维素酶活差异较大,稻草、玉米秆、麸皮纤维性碳源的组合,生产纤维素酶效果明显优于含单糖、二糖等可溶性碳源组合.其中稻草/玉米秆的CMCase、FPase和βGase最高,其次是麸皮/玉米秆、麸皮/稻草,其他组合酶活较低.原因可能一是纤维性碳源组合在测定酶活时正是产酶高峰期,二是麸皮、稻草、玉米杆组成成分复杂,含有适合菌体生长的营养成分及有较丰富的适合菌株产酶的生长因子.只有碳源既满足菌体生长需要也能满足其产酶需要时才能产生较多的纤维素酶.通过碳源对产酶的影响研究,确定稻草/玉米秆组合是绿色木霉h157最适合产酶的碳源.
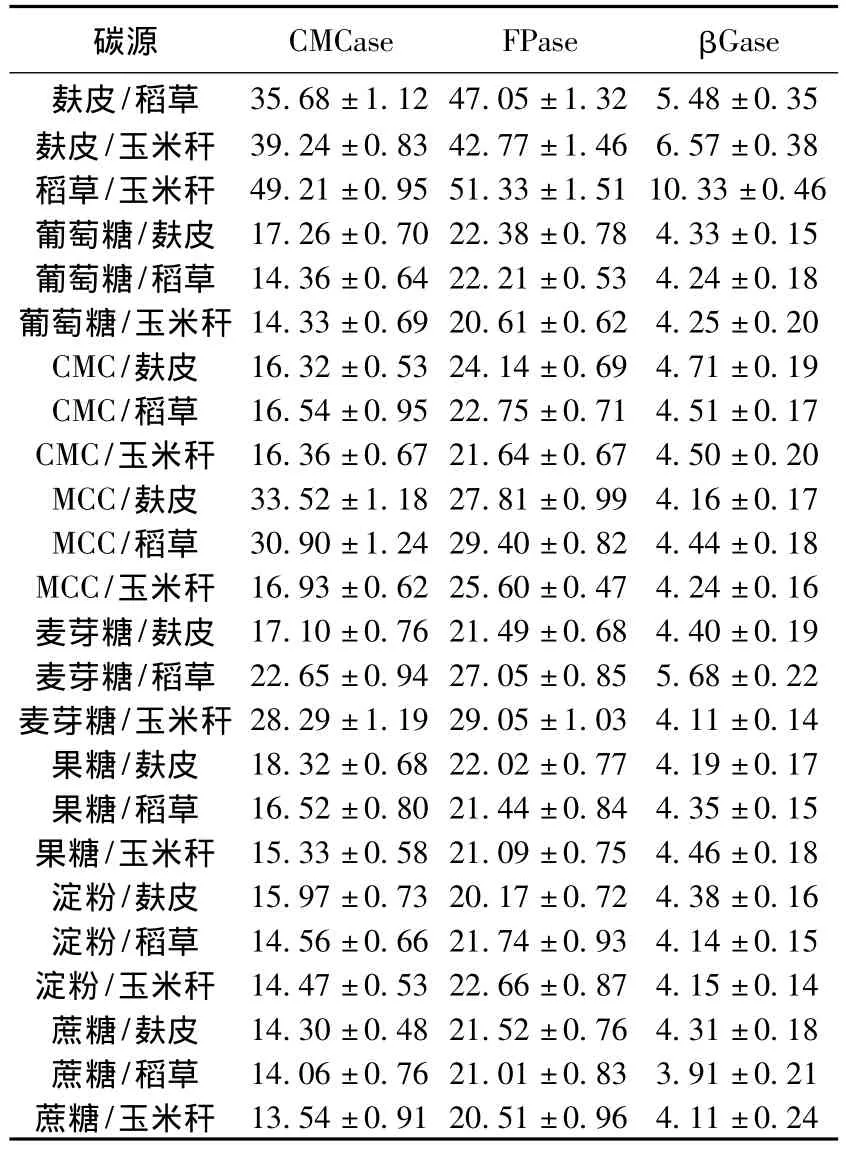
表2 碳源对绿色木霉h157产纤维素酶的影响U·mL-1
2.2.2 碳源比例对产酶的影响
碳源除供菌体生长外,还是微生物发酵过程中的诱导物和分解底物.麸皮、稻草、玉米秆组成成分复杂,促进菌体生长和诱导菌体产酶的能力不同,因此,碳源的比例是产酶的关键因素.由图1可以看出,不同碳源比例CMCase、FPase变化较大,βGase变化较小.稻草和玉米秆比例为6∶1时CMCase最高,FPase在6∶1至4∶3时变化不大,以后呈下降趋势.βGase高峰期出现在5∶2时,但在6∶1至5∶2时变化不大,以后缓慢下降,综合考虑,对于h157菌株最佳产酶的稻草和玉米秆比例为6∶1.
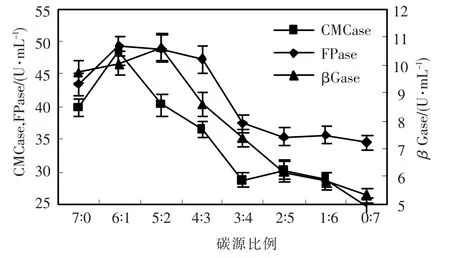
图1 碳源比例对绿色木霉h157菌株产纤维素酶的影响
2.2.3 氮源种类对产酶的影响
氮源的种类和性质也是影响酶活力和产率的重要因素,氮源通过影响酶蛋白前体的形成,来调控酶的合成[11].本实验采用的11种无机和有机氮对h157产酶的影响结果如表3所示,不同的氮源对酶活影响较大,氨态氮比硝态氮有利于绿色木霉产生纤维素酶,可能与其代谢类型有关.其中,NH4Cl比(NH4)2SO4的CMCase略高,但FPase和βGase则(NH4)2SO4比NH4Cl高,在研究的有机氮中蛋白胨和豆饼粉的 CMCase、FPase和βGase较高,但豆饼粉比蛋白胨价格低廉,综合考虑,无机氮源和有机氮源分别选择(NH4)2SO4和豆饼粉.
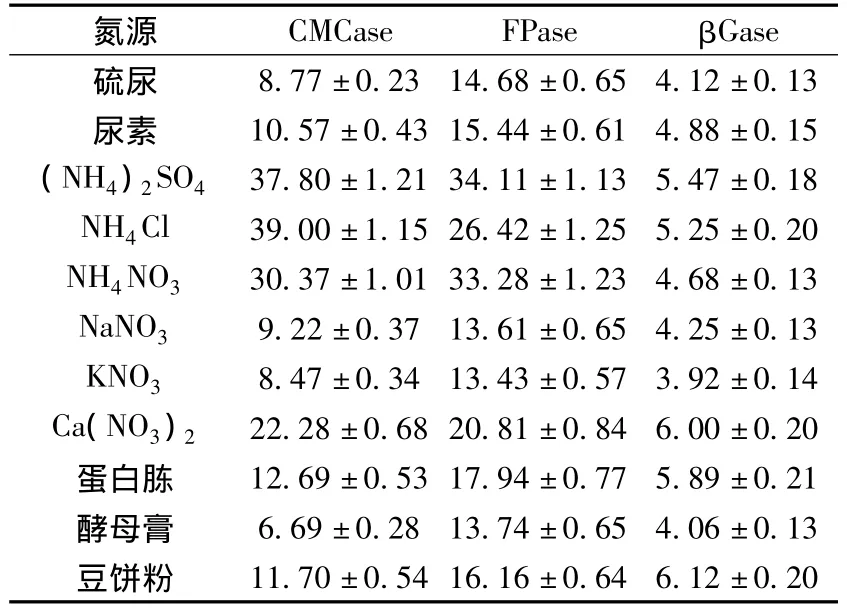
表3 氮源对绿色木霉h157菌株产纤维素酶的影响U·mL-1
2.2.4 无机氮和有机氮比例对产酶的影响
无机氮和有机氮比例是影响菌体生长和产酶的关键因素之一,两种氮源的比例对产酶的影响作用见图2,以无机氮源(NH4)2SO4为单独氮源比以有机氮源豆饼粉为单独氮源时酶活高,随着(NH4)2SO4与豆饼粉比例的增加纤维素酶活力先上升后下降,当(NH4)2SO4与蛋白胨比例为4∶2时,βGase达到高峰,(NH4)2SO4与豆饼粉比例为3∶3时,CMCase和FPase达到最高峰,综合考虑,(NH4)2SO4与豆饼粉比例为3∶3有利于CMCase、FPase和βGase的提高.
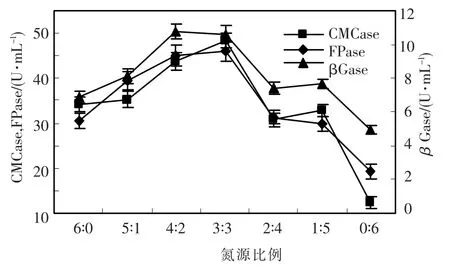
图2 氮源比例对绿色木霉h157菌株产纤维素酶的影响
2.2.5 碳氮比例对产酶的影响
碳氮比例是影响菌体的生长和酶合成的重要因素之一,碳氮比例对绿色木霉产酶的影响作用见图3,随着碳氮比的增加纤维素酶活力先上升后下降,碳氮比例在8∶1和7∶1时,CMCase、FPase和βGase的变化幅度不大,碳氮比为8∶1时FPase最高,比例为7∶1时CMCase和βGase最高,综合考虑碳氮比例为7∶1有利于提高h157的酶活力.
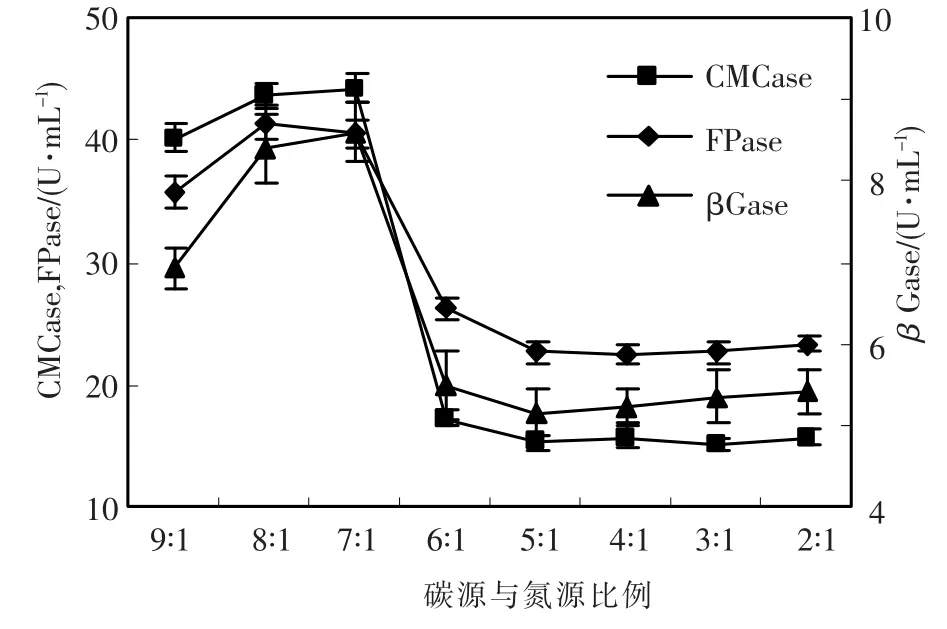
图3 碳氮比例对绿色木霉h157菌株产纤维素酶的影响
2.2.6 碳氮质量分数对产酶的影响
碳氮质量分数不但影响菌体生长和产酶,更影响培养液中含氧量.碳氮质量分数对产酶的影响作用见图4,随着碳氮质量分数增加纤维素酶活力先上升后下降,碳氮质量分数在3.3%时,CMCase和βGase最高,FPase较高,当质量分数达到4.0%时,FPase最高,但CMCase和βGase下降幅度较大,因此,发酵时选择碳氮质量分数为3.3%有利于产酶.
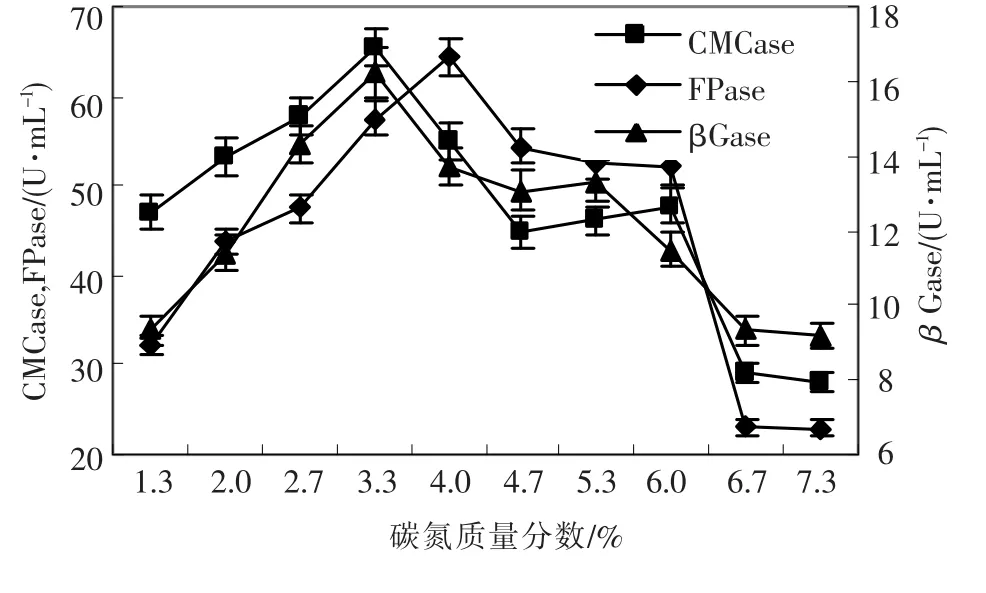
图4 碳氮质量分数对绿色木霉h157菌株产纤维素酶的影响
2.2.7 pH值对产酶的影响
微生物在最适pH值条件下,生长迅速,代谢旺盛,发育良好.pH值过高或过低,微生物均不能很好地生长发育,严重时导致死亡[12].同时,pH值还影响酶的稳定性和活性.pH值对h157菌株产纤维素酶的影响作用见图5,pH值在4.8~5.8 CMCase变化不大,pH值在4.8~5.2 FPase最高,pH值在4.8~5.6 βGase变化不大.综合考虑,pH为5.2时有利于产纤维素酶.
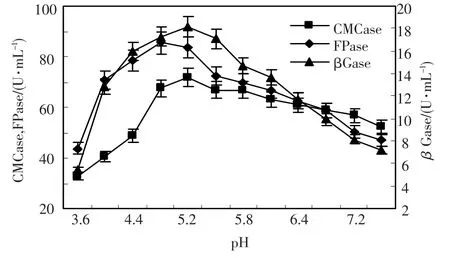
图5 pH值对绿色木霉h157菌株产纤维素酶的影响
2.2.8 培养温度对产酶的影响
温度是影响微生物机体最重要的因素之一.不但影响菌体的生长,还影响产酶的量.从图6中可以看出,CMCase、βGase和 FPase在28℃时达到最高,30℃时CMCase和FPase缓慢下降,而βGase快速下降.所以,28℃是最适合绿色木霉h157产酶的培养温度.
2.2.9 培养时间对产酶的影响
在培养过程中酶活变化如图7所示,随着时间的推移,纤维素酶活由低到高,然后又下降,CMCase、βGase在4 d时达到最高值,FPase在5 d时达到最高值,4~5 d是产酶的高峰期,为缩短生产周期,最佳收获酶的时间为4 d.
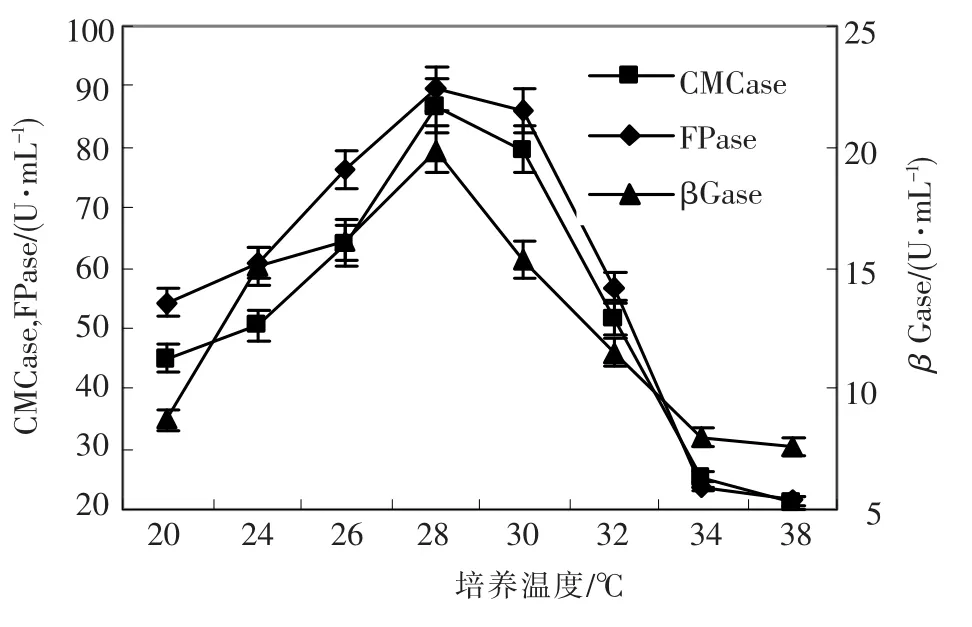
图6 培养温度对绿色木霉h157菌株产纤维素酶的影响
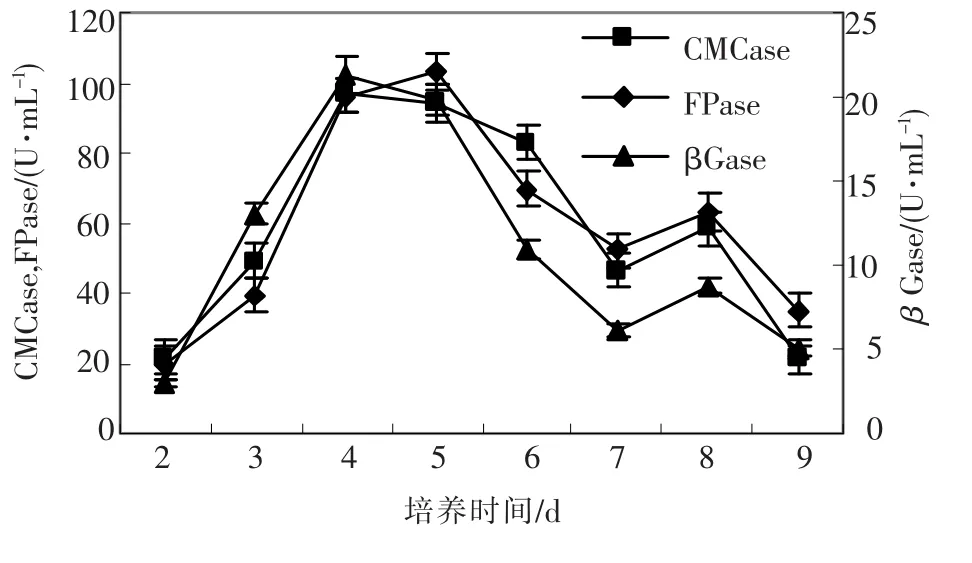
图7 培养时间对绿色木霉h157菌株产纤维素酶的影响
3 讨论
随着分子生物学方法的不断进步,近年来出现了一些新的菌种选育方法[13-14],但诱变育种作为一种简便易行而且快速的选育方法,至今仍被广泛应用.目前工业中的优良高产菌株绝大部分都是以这种方法获得.特别是对遗传背景不很清楚的微生物,诱变育种更是必不可少.单一诱变剂只诱变菌株的DNA某一个或是几个位点进行突变,诱变出来的高产菌株很容易恢复突变,长期使用诱变剂还会产生诱变剂“疲劳效应”、菌种生长周期延长、孢子量减少、代谢减慢等现象.而复合诱变具有协同效应,正突变菌株的遗传比较稳定,诱变效果明显.本研究采用紫外线和硫酸二乙酯对绿色木霉进行诱变,获得的6株高产菌种均为复合诱变菌株,与Mahesh等[15]的研究结果相似.由于纤维素酶为一种分泌型诱导酶,碳源影响其纤维素酶的分泌.
4 结论
1)采用复合诱变方法处理绿色木霉(T. viride)菌株,得到6株稳定高产纤维素酶的绿色木霉(T.viride)突变株.并对其液体发酵条件进行了研究,为利用秸秆工业化液体发酵生产纤维素酶提供了菌株和工艺参数.
2)绿色木霉h157产纤维素酶的最适宜碳源是稻草和玉米秆,最佳比例为6∶1,最佳氮源为(NH4)2SO4和豆饼粉,最佳比例为1∶1,最适碳氮比为7∶1,碳氮质量分数为3.3%,产酶适宜pH为5.2,最佳产酶温度为28℃,最佳产酶时间为4 d.
[1] SHAFIQUE S,BAJWA R,SHAFIQUE S.Cellulase biosynthesis by selected Trichodema species[J].Pak J Bo,2009,41(2):907-916.
[2] SRIDEVI A,NARASIMHA G,REDDY B R.Production of Cellulase by Aspergillus niger on natural and pretreated lignocellulosic wastes[J].The Internet Journal of Microbiology,2009,7:1-8.
[3] SINGH R,VARMA A J,LAXMAN A S,et al.Hydrolysis of cellulose derived from steam exploded bagasse by Penicillium cellulases:comparison with commercial cellulase[J].Bioresource Technology,2009,100(24):6679-6681.
[4] EVELEIGH D E,MANDELS M,ANDREOTTI R,et al.Measurement of saccharifying cellulase[J].Biotechnol Biofuels,2009,2:21-28.
[5] ZHANG Y H P,HIMMERL M E,MIELENZ J R. Outlook for cellulase improvement:screening and selection strategies[J]. Biotechnology Advances,2006,24:452-481.
[6] JORGENSEN H,KRISTENSEN J B,FELBY C.Enzymatic conversion of lignocellulose into fermentable sugars:challenges and opportunities[J].Biofuels Bioprod Bioref,2007,1:119-134.
[7] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[8] 屈二军,王晓涛,李文建,等.一株高产纤维素酶的米曲霉菌种的选育[J].中国酿造,2008,14: 47-49.
[9] 白洪志,杨谦,宋金柱,等.纤维素降解菌绿色木霉C208产酶条件研究[J].哈尔滨工业大学学报,2008,40(7):1111-1115.
[10] CRIQUET S.Measurement and characterization of cellulase activity in sclerophyllous forest litter[J]. Journal of Microbiological Methods,2002,50(2): 165-173.
[11] ACHARYA P B,ACHARYA D K,MODI H A.Optimization for cellulase production by Aspergillus niger using saw dust as substrate[J].Afr J Biotechnol,2008,7(22):4147-4152.
[12] PRASETYO J,SUMITA S,OKUDA N,et al.Response of cellulase activity in pH-controlled cultures of the filamentous fungus Acremonium cellulolyticus[J].Appl Biochem Biotechnol,2010,162(1):52-61.
[13] LIU Z Q,ZHANG J F,ZHENG Y G,et al.Improvement of astaxanthin production by a newly isolated Phaffia rhodozyma mutant with low-energy ion beam implantation[J].J Appl Microbiol,2007,104(3):861-872.
[14] HAN J R,WANG Q.Laser mutagenesis of protoplasts of Penicillium sp.PT95 for the enhancement of carotenoid yield[J].J Appl Microbiol,2008,105(5):1552-1557.
[15] CHANDRA M,KALRA A,SANGWAN N S,et al. Development of a mutant of Trichoderma citrinoviride for enhanced production of cellulases[J].Bioresource Technology,2009,100(4):1659 -1662.
