贮藏条件对DHA微胶囊化学稳定性的影响研究
2011-03-10刘向宇
何 伟 ,郭 华 ,刘向宇 ,邓 敏
(1.湖南省望城县质量监督检验及计量检定所,湖南 长沙 410200;
2.湖南农业大学食品科技学院,湖南 长沙 410128)
DHA(二十二碳六烯酸)俗称脑黄金,属于ω-3系多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3PUFAs),主要存在于鳕鱼肝油、鲱鱼油和海洋微藻油中。DHA作为一种必需脂肪酸,有增强记忆与思维、提高智力等显著的作用,对维持各种组织的功能也必不可少,还有预防近视和改善视力的作用[1],缺乏时可引发一系列症状。在1972年,英国脑营养化学研究所所长Michae1 A K教授就发表了“DHA等必需脂肪酸摄入不足将造成脑功能障碍”的论断。之后,又被日本、加拿大、美国等国家的学者所证实。由于DHA对大脑及视力有重要的保健价值,国外已把DHA作为营养保健食品添加剂,我国也开发了不少DHA保健食品[2-3]。
目前,世界许多国家,包括中国,均已把DHA批准作为营养强化剂,并制定了相应的添加标准。但由于DHA的不饱和度高,生产应用中易氧化,稳定性受到影响,直接添加到食品中易氧化损失并产生异腥味,因此DHA主要以胶囊的形式出售或贮存,本文针对由海藻油制备的DHA微胶囊进行研究。
微胶囊是一种能包埋和保护某些物质的具有聚合物壁壳的半透明或密封的微型容器或包合物。通过一系列特殊的方法,利用天然的或合成的高分子材料包覆所需要的固体、液体甚至气体物质,然后制成有囊壁的微胶囊,保留或截留其他物质的微粒,从而达到保护、控制释放的效果。然而,DHA微胶囊并不是万无一失的,由其自身的结构特性所决定,在外界环境因素的影响下,DHA胶囊在加工、贮存和运输过程中,也容易氧化变质,产生不良的气味,导致品质下降、货架期缩短,甚至可能会危害消费者的身体健康,所以贮藏条件对DHA微胶囊化学稳定性的影响也是不容忽视的[4-5]。因此,研究贮存条件对DHA微胶囊稳定性的影响,将为开发新产品、更有效的发挥DHA的生理功能提供一定的依据。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料 DHA微胶囊,湖南农业大学食品科技学院食品加工实验室自制;高峰氏淀粉酶(TaKa酶),上海正极生物科技有限公司。
1.1.2 试验设备 ALC-2100.2电子分析天平,Agilent Technologies 6890N气相色谱仪,CP-Si188熔融石英毛细管柱 (100 m×0.25 mm,Chrompack,Bridgewater NJ),低温冰箱(-72℃),DSY-Ⅲ氮吹仪,SGN-300纯氮发生器,722S分光光度计,SR-52旋转蒸发器,循环水式多用真空泵,真空包装机,LXJ-IIB低速大容量多管离心机,pHS-3C精密酸度计,SHZ-82A水浴恒温振荡器。
1.1.3 试 剂 GLC463混和脂肪酸标样,购自NuChek-Prep公司;正己烷、甲醇、乙醇、甲醇钠、石油醚、三氯甲烷、无水乙醚、乙酸甲酯、乙酸乙酯、草酸、无水硫酸钠均为色谱纯。氮气(高纯度),用作辅助气体或脱溶剂用;氢气(高纯度),用作载气和燃气。
1.2 试验方法
1.2.1 DHA微胶囊的过氧化值与DHA保留率的测定 (1)微胶囊中海藻油的提取:称取2.000 g DHA微胶囊样品于25mL具塞试管中,加入0.20 g淀粉酶,振荡摇匀后,再慢慢往里面加入45~50℃的去离子水20mL,混合均匀,用氮气除去瓶中氧气,盖紧瓶塞,置45℃烘箱内放置30 min,然后取出冷却至室温。
吸取10 mL上述样品溶液于洁净干燥的离心管中,加入2 mL氨水,盖上瓶塞,置65℃水浴中保温振荡20min后,取出静置,冷却至室温。然后往离心管中加入10 mL乙醇,混匀后,加入25 mL无水乙醚,加塞振摇1 min;再加入25 mL石油醚,塞上塞子,振摇1min。放入离心机中,4 000 r/min离心15min,取出离心管,将上层有机层转入干燥的锥瓶中。往此离心管中再加入6mL乙醇、15mL无水乙醚,混匀,加塞振摇1 min;然后加入20 mL石油醚,加塞振摇1 min。至离心机中4 000 r/min离心15min后,将有机层并入上述锥瓶中,转入旋转蒸发仪中蒸脱溶剂,得到海藻油。
(2)过氧化值的测定:A标准曲线绘制:先配制10.0μg/mL铁标准溶液,然后依次吸取铁标准溶液0、0.2、0.5、1.0、1.5、2.0、3.0 mL 于干燥的 10 mL 具塞试管中,用三氯甲烷—甲醇定容至刻度,振荡均匀。然后各加30%硫氰酸钾溶液0.05mL,混匀静置5min,以空白调零,于波长500 nm处测定吸光度,计算出回归方程。
B样品测定:精密称取0.200 g提取出的海藻油于干燥的10mL具塞试管中,加0.05mL氯化亚铁溶液(3.5 g/L),然后,用三氯甲烷—甲醇混合溶液(7+3)定容,震荡均匀。加30%硫氰酸钾溶液0.05mL,混匀,静置5min,移入1 cm比色皿,用三氯甲烷—甲醇混合试剂(7+3)作为空白,在波长500 nm条件下,测定吸光度。
(3)DHA保留率的测定:A,脂肪酸甲酯化[6-7]。称取提取的海藻油样品2.0 mg,加入1.5 mL正己烷,使其溶于正己烷,再加入乙酸甲酯40μL,振荡,接着加入100μL甲醇钠溶液,室温下反应20 min,-24℃冷冻10min后,加60μL草酸溶液,取出,将样液通过无水硫酸钠微柱脱水,用小瓶收集滤液约1.2mL上机测定。
B,气相色谱分析[6-7]。火焰离子化检测器温度为250℃,进样口温度为250℃。载气为氢气,流速1.8 mL/min;燃气为氢气,流速30mL/min。空气流速300mL/min;辅助气体为氮气,流速30mL/min。程序升温过程:45℃保持4 min,然后13℃/min升至175℃,保持27min,再4℃/min升至215℃,保持35 min,载气为高纯氢气。
根据脂肪酸甲酯标准谱图,采用“面积归一化法”定量计算DHA的相对百分含量。再根据下式计算DHA保留率。

1.2.2 光照对DHA微胶囊稳定性的影响 将DHA微胶囊用透明袋封存,然后用黑布包裹,置于暗处下维持8周;对照组只用透明袋封存,置于25 w的白炽灯照射下维持8周,温度均设定为室温,并定期分别取样,测定DHA微胶囊的过氧化值和DHA的保留率。考察光照对其稳定性的影响。
1.2.3 氧气对DHA微胶囊稳定性的影响 将等量DHA微胶囊分别置于真空包装、充氮包装和敞口塑料袋中,储藏在阴凉通风处,室温下放置8周,定期取样测定过氧化值和DHA的保留率。观察氧气对DHA微胶囊稳定性的影响。
1.2.4 温度对DHA微胶囊稳定性的影响 将微胶囊用锡箔袋真空包装,分别置于冷冻条件(-18℃),冷藏条件(4℃),常温条件(25℃)与高温条件(45℃)避光保存8周;对照组样品置于60℃下避光保存8周,其他条件相同,定期分别取样,测定过氧化值和DHA的保留率,判断温度对DHA微胶囊的稳定性影响。
1.2.5 数据处理方法 文中所有测定数据均以双样平均值表示。
2 结果与讨论
2.1 DHA微胶囊的过氧化值与DHA的含量测定
测得制备好的DHA微胶囊的过氧化值为1.7 meq/kg。根据脂肪酸标准气相色谱图数据计算(图1,图2),得出制备好的DHA微胶囊中海藻油的脂肪酸组成,其中4c,7c,10c,13c,16c,19c-二十二碳六烯酸的含量为39.17%。以此值作为计算DHA的保留率的基础。
图1 脂肪酸标准色谱图
2.2 光照对DHA微胶囊稳定性的影响

图2 海藻油的脂肪酸组成色谱图
由图3可知:DHA微胶囊在光照条件下贮存的8周期间,过氧化值由开始的1.7meq/kg增大到4.6meq/kg,DHA保留率由100%降到92%。而避光组的过氧化值由开始的1.7 meq/kg增大到3.8 meq/kg。DHA保留率从100%降到94%。说明光照能够促进DHA微胶囊的氧化。数据还表明,在开始一周内,避光保存与不避光保存两组的过氧化值和DHA保留率差别不是很明显,但在随后的一个月内,这两项指标就相差得比较大,然后又逐渐趋于稳定。原因可能是在前一周内,光氧化并不是主导氧化类型,微胶囊表面的保护层对光照起了一定的遮挡作用,因此两组数值差距不大。但随着光照时间的延长,光氧化的主导地位上升,DHA氧化加剧,因而未避光组的过氧化值上升迅速、DHA保留率值下降。两组数值差距加大。经过4周的氧化动荡期后,可能是氧分子活力不足、或光促氧化能力达到饱和、或其他氧化类型占主导地位,促使两者的差距逐渐平缓下来。因此可知,微胶囊化工艺对填充芯材的稳定性有一定帮助,但由于壁材对光照的缓冲作用十分有限,因而在贮存期间还是应尽量避光保存。
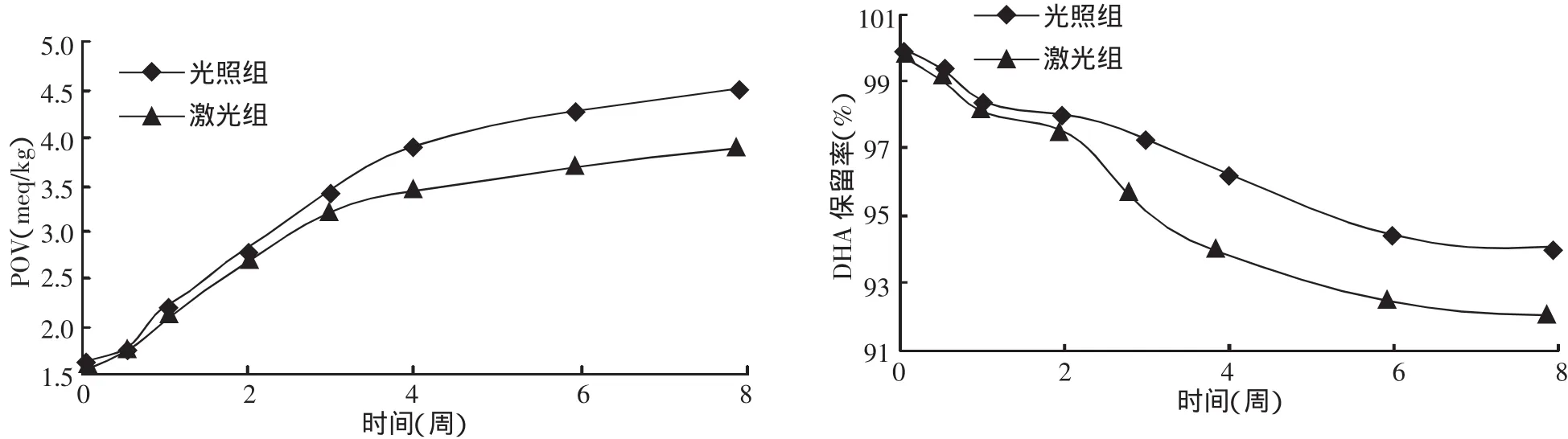
图3 光照对DHA微胶囊过氧化值与DHA保留率的影响
2.3 氧气对DHA微胶囊稳定性的影响
由图4可知:氧气对DHA微胶囊的稳定性有很大影响:敞口组POV值由初开始的1.7 meg/kg增至5.0meg/kg;DHA保留率下降至88%。真空包装组和充氮包装组POV值由初开始的1.7 meg/kg增至3.2meg/kg左右,DHA保留率降至94%~95%,无氧环境显然具有优越性,明显的抑制了DHA的氧化作用,其中,充氮包装的效果稍微优于真空包装组。因此,为了延长产品的寿命,成品在贮存期间应尽量隔绝氧气,使用充氮或真空包装。
2.4 温度对DHA微胶囊稳定性的影响
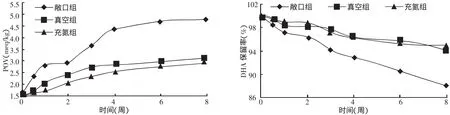
图4 氧气对DHA微胶囊过氧化值和DHA保留率的影响
由图5可看出:冷冻组、冷藏组与常温组的DHA氧化程度较轻,DHA保留值较高;随着温度的升高,DHA的氧化程度逐渐加剧,到高温组时,DHA破坏程度显著加剧。过氧化值由原来的1.7 meg/kg增至9.0 meg/kg,而DHA保留率下降至65.8%。这表明,贮藏温度越高,DHA微胶囊氧化的速度越快。
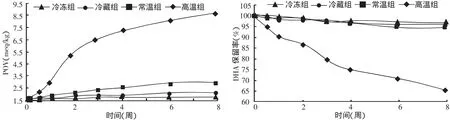
图5 温度对DHA微胶囊POV值和DHA保留值的影响
温度与油脂的稳态化特性之间有着紧密的联系,温度增高加快油脂的氧化反应,温度愈高,过氧化值变化愈大。这与微生物在较高的温度环境下的繁殖和酶的活动有关,油温在20~60℃范围内,温度每提高10℃,油脂氧化速度翻一番。虽然在一定温度范围内,微胶囊的壁材给内部的DHA带来保护作用。但随着时间延长,保护作用开始失效。因此,DHA微胶囊产品应在低温贮存,最好不超过25℃。
3 小 结
(1)光照稳定性试验表明避光对DHA胶囊保存有利。即使是微胶囊化工艺可在一定程度上提高芯材的稳定性,但由于壁材对光照的缓冲作用有限,贮存期间应尽量避光保存。
(2)氧化稳定性试验表明,隔氧的真空包装和充氮包装对延缓DHA微胶囊变质有明显的作用,其中充氮包装的效果稍优于真空包装组。所以为了延长DHA胶囊产品货架期,贮存期间应尽量隔绝氧气,采用充氮或真空包装。
(3)温度稳定性试验表明,储藏温度越低,DHA微胶囊的POV值越低而DHA保留值越高,随着温度的升高,DHA的氧化程度逐渐加剧,到高温组时,DHA破坏程度显著加剧。所以应在低温储存DHA微胶囊,最高温度不应超过25℃。
[1] 邓泽元,余迎利,John K G Kramer.GC和HPLC对共轭亚油酸的测定[J].中国油脂,2005,30(3):36-39.
[2] 周 敏,陶宁萍,王锡昌.黄鳍金枪鱼眼窝油中DHA含量测定方法的优化[J].湖南农业科学,2010,(6):93-95.
[3] 李 静,邓泽元,范亚苇,等.几种乳制品中脂肪酸的特点[J].食品工业科技,2007,28(11):221-223.
[4] 曹 栋,宋文明.鱼油乳液的稳定性[J].无锡轻工大学学报:食品与生物技术,2000,19(1):65-68.
[5]Forsyth JS,Carlson SE.Long-chain Polyunsaturated Fatty Acids in Infant Nutrition:Efects on Infant Development[J].Current Opinion in Clinical Nntrition and Metabolic Care,2001,4(2):123-126.
[6] 翁新楚,董新伟,任国谱.EPA和DHA的生理功能及其氧化稳定性[J].生物工程进展,1994,14(6):56-60,6.
[7]周远扬,雷百战,潘 艺.鱼油EPA与DHA提取方法研究进展[J].广东农业科学,2009,(12):155-157.
