猪瘟病毒荧光定量RT-PCR检测方法的建立*
2011-03-07任夫波张丽丽杨若松张燕霞李晓成
任夫波,张 志,张丽丽,杨若松,3,韩 艳,张燕霞,李晓成*,单 虎
(1.青岛农业大学,山东青岛266109;2.中国动物卫生与流行病学中心,山东青岛266032;3.西北农林科技大学,陕西杨凌712100)
猪瘟病毒(Classical swine fever virus,CSFV)是黄病毒(Flaviviridae)瘟病毒属(Pestivirus)的成员,其基因组为单股正链RNA,长约12.5 kb,含一个大的开放阅读框(ORF),两侧为高度保守的5′和3′非编码区,临床症状可表现为急性、亚急性、慢性和非典型性,被世界动物卫生组织(OIE)列为必须报告的动物传染病,我国亦将其列为一类动物传染病[1]。近年来随着免疫接种的不断加强,我国猪瘟的流行和发病特点发生了很大的变化,自然病例中常见的非典型、温和型和亚急性已成为我国养猪业发展的一大隐患。因此,建立一种特异、敏感、快速的检测猪瘟野毒的诊断方法是必要的。
目前国内对CSFV的传统诊断方法包括免疫荧光试验、病毒分离培养、动物接种试验、酶联免疫吸附试验(ELISA)、血清学试验等为CSFV的鉴定和诊断提供了有效的手段[2-6]。但这些方法在特异性、敏感性以及时效性等方面都有各自的不足,不适用于CSFV感染的早期快速诊断。
近年来发展起来的实时荧光定量PCR(realtime fluorescent quantitative PCR)技术能快速检测极微量的病毒核酸,而且能准确确定样品中病毒的拷贝数,操作方便,耗时短,结果直观,因而迅速在医学、农业等领域得到了广泛应用。在国外荧光定量PCR技术已用于CSFV的定量检测[7-8]。本研究利用一对特异性引物及TaqMan荧光探针建立了一种能快速、特异、灵敏检测CSFV的实时荧光定量PCR方法,以期为CSFV的早期快速诊断提供帮助,可直接用于临床病料的检测。
1 材料与方法
1.1 材料
1.1.1 仪器设备 荧光定量PCR仪器,7300型,ABI公司生产;台式高速冷冻离心机:Sigma 1-15型,Sigma公司生产;PCR仪,2720 Thermal Cycler型,ABI公司生产;凝胶成像系统,英国SYNGENE公司产品;YX智能型全自动立式电热蒸汽压力消毒器,上海三申医疗器械有限公司生产;超低温冰箱,日本三洋产品;微量移液器,Finnpipette公司产品;Tip枪头、EP管、PCR反应管,Axygen公司产品。
1.1.2 主要试剂 Trizol LS Reagent为美国Invitrogen公司产品;AMV(5 U/μ L)、HPRI RNA(40 U/μ L)、DEPC处理水、Ex Taq(5 U/μ L)、dNTP(2.5 mmol/L)、EcoRⅠ(15 U/μ L)限制性内切酶均为宝生物工程(大连)有限公司产品;pGEMTeasy载体为Promega公司产品;UNIQ-10柱式DNA胶回收试剂盒购自上海生工生物工程技术服务有限公司;琼脂糖为西班牙进口分装产品;其他所用试剂为进口或国产分析纯。DH5a大肠埃希菌由中国动物卫生与流行病学中心保存。
1.1.3 病毒 猪瘟病毒(Shimen株),猪瘟兔化弱毒疫苗(HCLV),牛病毒性腹泻病毒(BVDV),猪繁殖与呼吸综合征病毒(PRRSV),伪狂犬病毒(PRV),猪圆环病毒1型(PCV-1),猪圆环病2型(PCV-2),猪细小病毒(PPV)。猪瘟病毒YN33,BJ9,SX6(2.1、2.2和2.3基因亚群)均由中国动物卫生与流行病学中心保存并提供。
1.2 方法
1.2.1 引物和探针的设计 以高度保守的5′端非编码区为参考,用Premier 5.0软件,设计并选出一对引物和一条TaqMan探针,其序列如下:CSFV-5UTR-F:5′-CTAAGT CCT GAGTAC AGG ACA-3′;CSFV-5UT R-R:5′-CTA AGG TGT GAC T TG GGC ATA-3′;TaqMan probe:FAM-5′-TAG T TC GAC GTG AGC AGA-3′-TAMARA,引物由上海生工生物工程技术服务有限公司合成。
1.2.2 阳性标准品的制备 中国动物卫生与流行病学中心检测室曾经构建的含有猪瘟强毒基因组5′端非编码区的重组质粒,作为荧光定量PCR的标准品,在紫外分光光度计OD260测定光吸收值,定量后稀释至1.0×108拷贝/μ L,置—20℃保存,用前10倍倍比稀释。
1.2.3 荧光定量PCR法的建立
1.2.3.1 荧光定量PCR反应体系及优化 反应体系为25 μ L:10×PCR buffer 2.5 μ L,dNTPs(10 mmol/L),上下游引物(10 pmol/L)0.5 μ L,AMV(5 U/μ L)0.5 μ L,HPRI(40 U/μ L)0.5 μ L,Ex Taq(5 U/μ L)0.5 μ L,CSFV-Probe(20 pmol/L)0.4 μ L,模板RNA 3 μ L,用超纯水补足。反应条件:50℃30 min;95℃2 min,95℃15 s,52℃30 s,45个循环。退火延伸时检测荧光信号。检测结束根据噪音情况设定和调整基线及阈值,根据荧光曲线和Ct值初步判断结果。采用矩阵法对引物浓度、探针浓度进行最佳配比筛选,以获得最低的Ct值和较高的荧光强度增加值(vRn)。
1.2.3.2 标准曲线的建立 用中国动物卫生与流行病学中心检测室构建的含有猪瘟病毒基因组5′端非编码区的重组质粒,作为标准品,10倍倍比稀释成为模板,1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101拷贝/μ L,进行荧光定量PCR,以起始模板数的对数为X轴,Ct值为Y轴作回归曲线,建立CSFV检测的标准曲线。
1.2.3.3 灵敏性试验 标准品以10倍倍比稀释,取浓度范围在1.0×1.00~1.0×107拷贝/μ L标准品,用建立的荧光定量PCR方法进行检测,以检测为阳性的最低浓度确定为该方法的检测灵敏度。
1.2.3.4 特异性试验 为了评价荧光定量PCR方法在检测CSFV的特异性,用建立的荧光定量PCR检测猪瘟病毒Shimen株、HCLV、BVDV、PRRSV、PRV、PCV-1、PCV-2、PPV以及中国动物卫生与流行病学中心检测室分离的猪瘟病毒YN33,BJ9和SX6(2.1、2.2和2.3基因亚群),以确定反应特异性。
1.2.3.5 重复性试验 分别取等量的3份不同滴度(103、104、105拷贝/μ L)的标准品进行荧光定量PCR检测,每份样品作5个重复。
1.2.3.6 应用性检测 随机抽取来自湖南、福建、广西、辽宁等地发病厂的组织样品150份,用建立的荧光定量PCR法检测,同时用套式PCR法进行检测,并比较二者的阳性检出率。
2 结果
2.1 测序鉴定
将PCR产物送往上海生工生物工程技术服务有限公司进行测序,经序列分析为猪瘟病毒5′端非编码区序列。
2.2 优化的荧光定量PCR反应条件
反应体系为25 μ L,10×PCR buffer 2.5 μ L,dNTPs 2.0 μ L(10 mmol/L),上下游引物(10 pmol/L)0.5 μ L,禽源反转录酶(AMV 5 U/μ L)0.2 μ L,RNA酶抑制剂(HPRI 5 U/μ L)0.3 μ L,Ex Taq聚合酶(40 U/μ L)0.3 μ L,CSFV-Probe(10 pmol/L)0.2 μ L,模板RNA 3 μ L,用超纯水补足。反应条件:50℃30 min;95℃2 min,95℃15 s,52℃30 s,40个循环。
2.3 荧光定量RT-PCR标准曲线的建立
通过对荧光定量PCR各条件进行优化后,得出检测CSFV的扩增曲线(图1)和标准曲线(图2)。标准曲线方程:Ct=—2.896 logCO+32.350,样品拷贝数的对数值(logCO)与Ct值之间有良好的线性关系。
2.4 敏感性
以10倍倍比稀释的标准质粒(1.0×107拷贝/μ L~1.0×101拷贝/μ L)为模板进行扩增的荧光曲线见图1.0×101拷贝/μ L仍有荧光曲线,表明该方法检测灵敏度为1.0×101拷贝/μ L。
2.5 特异性
采用优化好的体系检测猪瘟标准强毒(Shimen株),HCLV和本实验室分离的YN33、BJ9和SX6,同时常规提取BVDV、PRRSV、PRV、PCV-1、PCV-2、PRV和PK-15细胞核酸进行检测,并设空白对照。结果CSFV各基因亚群均有荧光响应,除此之外均无荧光响应,表明本方法具有良好的检测特异性。
2.6 重复性
统计结果显示,3份猪瘟病毒阳性样品5次检测的Ct值变异系数均少于5%(表1),表明本检测方法的重复性较好。

图1 荧光定量PCR的动力学曲线Fig.1 Kinetics curve of FQ-PCR

图2 荧光定量PCR的标准曲线Fig.2 Standard curve of FQ-PCR
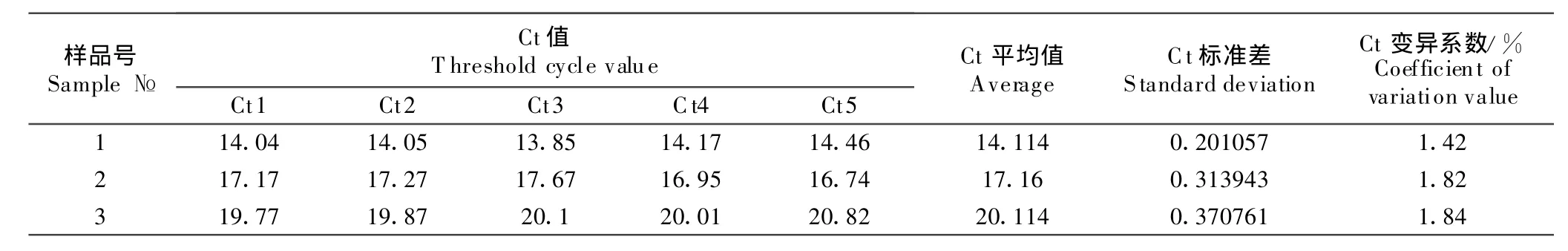
表1 猪瘟病毒阳性样品的重复性试验Table 1 The reproducibility test of FQ-PCR for CSFV
2.7 临床样品的检测
从随机抽取的150份组织样品进行荧光定量PCR检测,结果显示,荧光定量PCR检测出阴性样品29份,套式PCR检测出27份。对比结果表明,荧光定量PCR检测方法的敏感性与套式PCR相近。
3 讨论
荧光定量PCR是在普通PCR的基础上,利用荧光染料在激发光的作用下所释放的荧光信号的变化,来动态反映PCR扩增产物量的变化,以系统中发射荧光的强度代表PCR扩增产生的产物数量。它不仅实现了对核酸模板的定量,而且具有灵敏度高、特异性强、定量PCR可靠性更强、能实现多重反应、自动化程度高、无污染性、具实时性和准确性等特点[9-10]。在国内荧光定量PCR技术已用于病毒的定量检测[11-13]。
本研究应用Taq Man实时荧光定量PCR技术建立了快速检测CSFV的方法,本方法在40个循环内即可检测到10拷贝/μ L的病毒RNA,与套式PCR的敏感性处于同一数量级,检测的线性范围为107~101拷贝/μ L。通过对其他猪源病毒进行检测,在40个循环内无非特异性扩增信号,验证了其特异性。
试验证明该方法有很高的特异性、灵敏性和重复性,能在较广的范围内准确定量。与传统PCR相比,由于实时荧光定量PCR采取全封闭式反应,因而能有效解决PCR产物气溶胶的污染问题,又能解决常规PCR易产生假阳性、不能定量、操作复杂等问题,且自动化程度高,无需电泳。从核酸抽提到荧光定量PCR反应完毕需要时间短,可以在短时间内同时对大量样品进行定量检测。
综上所述,本研究成功建立了CSFV实时荧光定量PCR检测方法,实现了快速、敏感、特异的定量检测病料中的CSFV,为猪瘟感染的临床诊断提供了一个良好的方法。
[1] 蔡宝祥.家畜传染病学[M].4版.北京:中国农业出版社,2001:201-206.
[2] 沈绍新,戴爱玲,李晓华,等.IHA与EL ISA检测猪瘟病毒抗体的比较[J].动物医学进展,2009,30(9):20-23.
[3] 张淑霞,杨增岐,张卫军,等.猪瘟荧光抗体的制备及其在自然感染病例中的应用[J].中国兽医学报,2006,26(3):251-253.
[4] 杨利峰,建 民,周向梅,等.猪瘟RT-PCR ELISA诊断方法的建立[J].中国兽医学报,2007,27(3):292-295.
[5] Choi C,Chae C.Detection of classical swine fever virus in the ovaries of experimentally infected sows[J].J Comp Pathol,2003,128(1):60-66.
[6] 毕保良,李进涛,刘旭川,等.分子生物学技术在猪瘟诊断中的应用[J].动物医学进展,2009,30(2):106-108.
[7] Risatti G,Callahan J D,Nelson M W,et al.Rapid detection of classical swine fever virus by a portable real-time reverset ranscriptase PCR assay[J].J Clin Microbiol,2003,41(1):500-505.
[8] Risatti G,Holinka L,Lu Z,et al.Diagnostic evaluation of a realtime reverset ranscriptase PCR assay for detection of classical swine fever virus[J].J Clin Microbiol,2005,43(1):468-471.
[9] Niesters H G.Quantitation of viral load using real-time amplification techniques[J].Methods,2001,25:419-429.
[10] 张立国,张 琚.实时定量PCR技术的介绍[J].生物技术,2003,13(2):9.
[11] 郭 杨,陈世界,郭万柱.T aqMan荧光定量RT-PCR检测高致病性猪繁殖与呼吸综合征病毒[J].中国兽医杂志,2009,45(4):6.
[12] 王云龙,陈小科,韩 洁,等.H3亚型猪流感病毒荧光定量PCR检测方法的建立[J].动物医学进展,2009,30(6):30-35.
[13] 郭宇飞,程安春,汪铭书,等.鸭病毒性肠炎病毒荧光实时定量PCR检测方法的建立和应用[J].中国兽医科学,2006,36(6):444-448.
