黄粉甲抗冻蛋白AFP84a原核表达条件的优化和纯化*
2011-03-07闫清华
闫清华,康 静,杨 理,邵 强
(1.新乡医学院生命科学技术系,河南新乡453003;2.河南科技学院实验中心,河南新乡453003;3.河南师范大学生命科学学院,河南新乡453007)
抗冻蛋白(antifreeze protein,AFP)通过非共价吸附抑制机制吸附到冰核表面,限制冰晶生长和抑制冰晶重结晶,从而保护有机体免受结冰引起的伤害[1]。Gabriel A等[2]首次报道了在老鼠的心脏移植中,用抗冻蛋白低温保藏心脏从而成功地保护了心肌结构。2004年[3],以色列示巴女王医学中心的研究人员利用抗冻蛋白对哺乳动物的心脏进行低温保存,不但延长保存时间,也使器官移植的成活率大大提高。AFP在低温长期保存各种细胞、组织和器官,特别在器官移植中有很好的应用前景[4-5]。另外,抗冻蛋白在食品,工业,农业等领域也有广泛的应用。
黄粉甲抗冻蛋白的天然表达水平很低,而且纯化比较困难,需要经过离子交换层析HPLC等步骤,而每一步又必须测定热滞值来跟踪检测。因此,限制抗冻蛋白应用的主要问题就是抗冻蛋白还无法形成规模化生产,不能满足各行各业的应用。本研究主要利用大肠埃希菌表达黄粉甲抗冻蛋白,通过对诱导温度、初始菌浓度、IPTG浓度及诱导时间等条件进行优化组合,摸索出最佳的培养条件,并进一步纯化该蛋白,为扩大生产规模及满足各行业对抗冻蛋白的需求奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌表达菌株TBI(含融合质粒pMAL-p2X-afp84a)为实验室保存。
1.1.2 酶及主要试剂 IPTG为Sangon公司产品;蛋白质Marker,Amylose亲和柱,Factor Xa因子等为NEB公司产品;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 黄粉甲抗冻蛋白AFP84a表达条件的优化 首先对诱导温度进行优化,在3个关键温度点(37、25、13℃)在对数生长期(OD600=0.6)分别进行诱导培养4、8、12 h;其次对初始菌浓度进行优化,初始菌浓度OD600分别为0.2、0.4、0.6、0.8、1.0等5个梯度时,在25℃下分别进行诱导8 h;最后对具有互作影响的IPTG的浓度和诱导时间进行正交实验,采用IPTG的浓度为0.1、0.5、0.9 mmol/L 3个梯度,诱导时间为4、8、12 h 3个梯度进行正交试验,在温度为25℃,初始菌浓度为OD600=0.6条件下进行诱导。经SDS-PAGE和Bandscan4.3软件分析后,确定最优的表达条件。
1.2.2 融合蛋白的收获 按1∶100的比例接种1.0 mL重组菌菌液(TBI/pMAL-p2X-afp84a)于100 mL的高营养培养基中。37℃条件下震荡培养至菌液OD600=0.6,加入IPTG至终浓度为0.5 mmol/L,25℃下再震荡培养8 h,然后4 000 r/min离心25 min,取沉淀细胞。用30 mmol/L的Tris-HCl,200g/L的蔗糖和pH8.0 1 mmol/L的EDTA溶液重悬细胞,室温震荡8 min。在4℃以8 000 r/min离心25 min,用13 mL预冷的5 mmol/L MgSO4溶解沉淀,在冰浴中震荡8 min。在4℃以8 000 r/min离心15 min,取适量上清液进行电泳检测。
1.2.3 融合蛋白的纯化 按Amylose亲和柱说明书将收集到的上清液加入到柱床内,进行亲和层析,收集样品洗脱液3管~5管(1 mL/管)。通过紫外光吸收法测定并计算出各管洗脱蛋白的浓度;最后用SDS-PAGE检测。
1.2.4 Factor Xa酶切割融合蛋白 反应体系按Factor Xa酶切说明书进行。
1.2.5 目的蛋白的纯化 按1.2.3的方法将切割完全融合蛋白的反应液加入到Amylose亲和柱内,层析纯化并用SDS-PAGE和银染法检测洗脱样品。
2 结果
2.1 黄粉甲抗冻蛋白表达条件的优化
2.1.1 诱导温度对目的蛋白产量的影响 图1显示,25℃下诱导菌所产生的目的蛋白含量明显比37℃和13℃时较多,因此较优的诱导温度是25℃。通过Bandscan4.3软件分析,目的蛋白的百分含量依次为28.19%、27.95%、39.46%、39.68%,从中也可得到同样的结果。由于一些细菌不稳定蛋白在低温时表达量更大,故25℃下诱导的菌所产生的目的蛋白含量较高,因25℃下细菌生长周期较长,所以需诱导的时间相对较长。

图1 不同温度诱导重组菌表达产物SDS-PAGE分析Fig.1 SDS-PAGE analysis of expression products of recombinant E.coli TBI induced with different temperature
2.1.2 初始诱导菌密度(A600)对目的蛋白表达量的影响 Bandscan4.3软件对图2进行分析,目的蛋白百分含量依次为20.56%、22.14%、25.87%、24.50%、22.01%、11.89%(未加诱导剂的对照)。结果显示,随着起始菌体密度(A600)的增大,其诱导表达的蛋白量也逐渐增大,当A600增至0.6时,诱导表达的蛋白量为最大,达到25.87%,当A600继续增大时,诱导表达的蛋白量却逐渐减少。

图2 不同初始A600诱导重组菌表达产物SDS-PAGE分析Fig.2 SDS-PAGE analysis of expression products of recombinant E.coli TBI induced with different initial bacterial concentrant
2.1.3 IPTG浓度与诱导时间的优化 根据对诱导条件的优化设计,对IPTG浓度与诱导时间进行正交试验(两因素三水平)。图3显示IPTG浓度为0.5 mmol/L诱导8 h的菌所产生的目的蛋白含量最高,IPTG浓度为0.1 mmol/L诱导2 h的菌所产生的目的蛋白含量最低。通过Bandscan4.3软件对电泳图进行分析可知诱导时间为8 h时,诱导表达的蛋白量随着IPTG的浓度增加先增加后减少;IPTG的浓度为0.5 mmol/L时,诱导表达的蛋白量最高(40.5%);当IPTG的浓度达0.9 mmol/L时,诱导表达的蛋白量却有减少的趋势,这与高浓度IPTG对细菌的生长有一定的抑制作用有关[6]。IPTG浓度为0.1 mmol/L和0.9 mmol/L时,诱导菌10 h的蛋白表达量最大,但0.5 mmol/L IPTG诱导菌却在8 h时目的蛋白表达量最大,10 h次之。

图3 IPTG浓度与诱导时间正交诱导重组菌表达产物SDS-PAGE分析Fig.3 SDS-PAGE analysis of expression products of recombinant E.coli T BIinduced with the IP TG concentration and the orthogonal induction time
2.2 融合蛋白的纯化
由图4可知上清中含的目的融合蛋白的量较高,对上清进行层析纯化,通过SDS-PAGE和紫外吸收光检测(波长280 nm和260 nm)及公式C(mg/mL)=1.45OD280—0.74OD260,计算各管中蛋白的浓度,第3管洗脱液的蛋白浓度最大(0.58 mg/mL),第四管次之(0.49 mg/mL)。
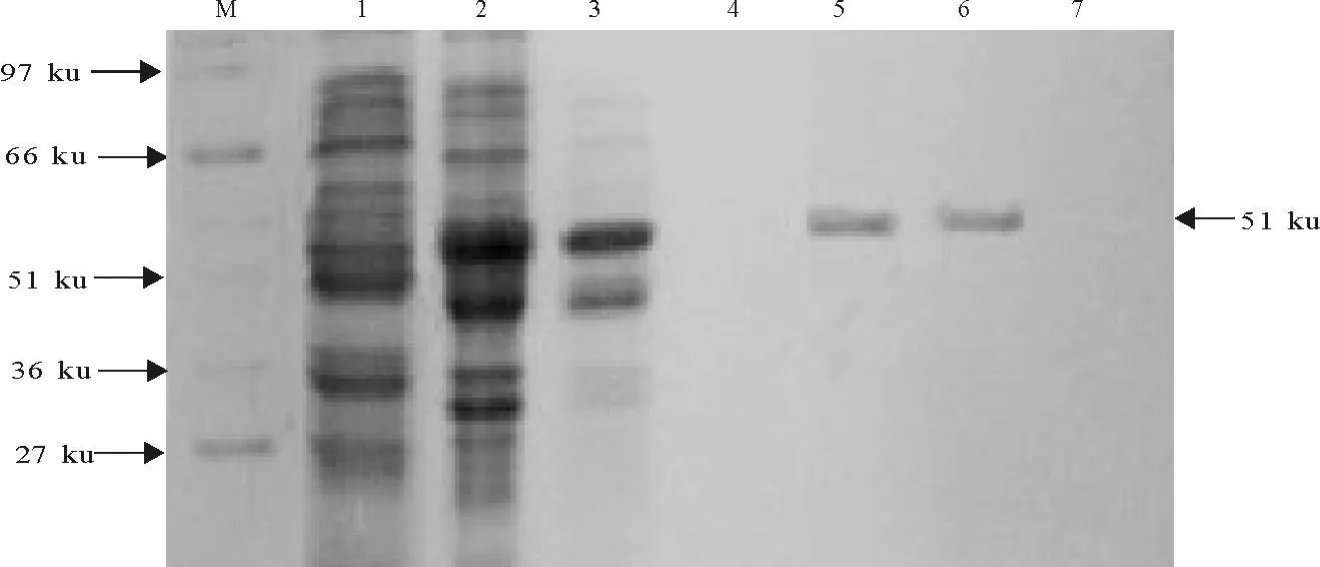
图4 融合蛋白的纯化电泳图Fig.4 SDS-PAGE pattern of purified fusion protein
2.3 目的蛋白的纯化
目的融合蛋白切割后,进行再次层析纯化。用SDS-PAGE(海波银染法)检测,由图5可知纯化的目的蛋白为单一条带,说明表达的目的蛋白达到很高的纯度,为以后对其应用研究打下了基础。
3 讨论
由于不同的诱导条件在一定程度上决定了目的蛋白的最终得率,这与诱导温度、初始菌浓度、诱导时间和IPTG浓度相关,因而找到该目的蛋白优化的诱导表达条件就非常必要。预实验证明,温度和初始菌浓度对诱导菌的表达具有较大的单因素影响作用,而另外两个因素IPTG浓度和诱导时间具有互作性,以这两个因素为变量进行正交实验分析,从而确定温度为25℃,初始菌浓度为OD600值为0.6左右,诱导时间为8 h,IPTG浓度为0.5 mmol/L为最优的表达条件,最终使目的蛋白得到了高效表达(40.5%)。

图5 目的蛋白纯度电泳检测图Fig.5 SDS-PAGE of purity of the target protein
在大肠埃希菌中表达外源蛋白时,最常用的方法是采用融合表达的方式。本研究利用pMAL-p2X载体采用分泌型融合表达的方式,融合蛋白由载体蛋白与目的蛋白组成,该载体含有一段编码麦芽糖结合蛋白(MBP)的序列和蛋白酶识别位点的序列,可以利用MBP对麦芽糖的亲和性达到用Amylose柱对融合蛋白的亲和纯化,融合蛋白纯化后,通过Factor Xa(X)可将目的蛋白与MBP切割分离,有利于得到纯度较高的目的蛋白,既快捷又方便。另外,分子质量比较小的蛋白在SDS-PAGE后用考马斯亮蓝染色时,不能被酸或醇固定,还会从凝胶中洗脱下来。黄粉甲抗冻蛋白分子质量比较小,结构比较特殊,可能还有不同程度的糖基化,利用SDSPAGE检测目的蛋白时,用考马斯亮蓝染色很难得到黄粉甲抗冻蛋白的条带(资料未显示)。Liou Y C等[7]在大肠埃希菌中表达一种84个氨基酸的黄粉甲抗冻蛋白时,是通过检测目的蛋白的热滞活性来跟踪目的蛋白的。经过反复研究,最终用银染方法得到了单一的重组抗冻蛋白电泳条带,纯化出了目的蛋白,为以后进一步扩大抗冻蛋白的产量和应用奠定了一定基础。
[1] Gilbert J A,Hill P G,Dodd C E R,et al.Demonstration of antifreeze protein activity in Antarctic lake bacteria[J].Microbiology,2004,150:171-180.
[2] Gabriel A,Boris R,Yigal K,et al.Preservation of myocyte structure and mitochondrial integrity in subzero cry opreservation of mammalian hearts for transplant at ion using antifreeze proteins:an electron microscopy study[J].Eur J Cardiothorac Surg,2003,24:292-297.
[3] Gabriel A,Boris R,Liana H,et al.Prolonged 24-hour subzero preservation of heterotopically transplanted rat hearts using antifreeze proteins derived from arctic fish[J].Annala of Tho racic Surgery,2004,77(5):1 648-1 655.
[4] 徐振波,李彦媚,弓松伟,等.新型抗冻保护剂在细胞低温冻存中的选择[J].制冷,2004,23(4):19-24.
[5] 谢秀杰,贾宗超,魏 群.抗冻蛋白结构与抗冻机制[J].细胞生物学杂志,2005,27(1):5-8.
[6] Patnaik P R.Investigaton of induction effect on the steady state performance of a continuous fermentation for recombinant βgalactosidase[J].Process Biochemistry,2001,11(36):1069-1074.
[7] Liou Y C,Daley M E,Graham L A,et al.Folding and structural characterization of highly disulfide-bonded beetle antifreeze protein produced in bacteria[J].Protein Expr Purif,2000,19(1):148-157.
