牛γ干扰素基因的表达及其多克隆抗体的制备*
2011-03-07宋佰芬曹宏伟马金柱崔玉东朱战波黄玉兰
宋佰芬,刘 哲,曹宏伟,马金柱,徐 闯,崔玉东,朱战波,黄玉兰
(黑龙江八一农垦大学生命科学技术学院,黑龙江大庆163319)
干扰素(interferon,IFN)是在特定的诱生剂作用下,由细胞分泌的具有一定的抗病毒、抗肿瘤和调节免疫功能等活性的糖蛋白[1]。根据IFN蛋白的氨基酸结构、抗原性和细胞来源以及它们所结合受体的不同,可将IFN分为两类,即Ⅰ型IFN和Ⅱ型IFN。Ⅰ型IFN常分为2个亚型,分别由白细胞和成纤维细胞产生,可抑制病毒DNA和蛋白质合成,活化NK细胞,促进MHCI类分子递呈抗原。Ⅱ型干扰素又称为γ干扰素,主要由CD4+Th1型、CD8+T细胞以及NK细胞产生,它除了具有抗病毒、抗肿瘤活性外,更重要的是它还具有促进MHCⅡ类抗原表达、增强APC与T细胞的相互作用、增强T细胞辅助抗体产生和细胞毒性T细胞产生的能力等诸多免疫调节活性[2]。
养牛业在我国国民经济中占据着相当重要的地位,但是牛的一些烈性传染病,尤其是病毒病严重威胁着养牛业的健康发展。研究表明,BoIFN-γ是一种高活性、多功能的生物活性糖蛋白,具有强烈的免疫调节作用,对寄生在细胞内的各种病原体均具有有效的抑制作用[3]。无论作为疫苗佐剂或其他类型的生物制剂,BoIFN-γ均可明显提高机体抗感染能力,并且具有安全、高效、无毒副作用等特点[4]。但在通常情况下,机体内IFN-γ表达量甚微,不能直接提取纯化[5]。因此,应用IFN-γ作为疫苗佐剂或抗病毒性药物,必须通过基因工程技术在体外生产重组IFN-γ。随着基因工程、蛋白质工程和发酵与细胞工程的深入发展,大规模、高效率地生产具有生物学活性的干扰素已成为可能,这将使人们把干扰素广泛地应用于科学研究和临床,并为最终战胜疾病提供充足的理论和实践基础[6]。
因此,为了解决这一问题我们实验室构建了原核表达重组菌,对其进行表达和纯化,并免疫小鼠制备了多克隆抗体,为进一步研究该蛋白的生物学功能奠定了理论基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 青年健康黑白花奶牛;8周龄Balb/c小鼠。
1.1.2 宿主菌、载体 大肠埃希菌BL21、x-LI Blue由黑龙江八一农垦大学生命科学技术学院细胞生物学实验室保存,载体pMD18-T、pQE-30为哈尔滨无限峰生物技术有限公司产品。
1.1.3 工具酶和试剂 T rizol抽提试剂盒为Invitrogen产品;DNA胶回收纯化试剂盒、质粒抽提试剂盒、EcoRⅠ、TaqDNA聚合酶、DL 2 000、DL 15 000、蛋白质分子量标准为宝生物工程(大连)有限公司产品;弗氏佐剂、辣根过氧化物酶标记的羊抗鼠IgG、刀豆蛋白(ConA)等为Sigma公司产品。
1.2 方法
1.2.1 引物设计与合成 参照GenBank中已发表的BoIFN-γ核苷酸序列,应用DNA Star软件设计了一对特异性引物,引物上游加入BamHⅠ酶切位点和3个保护性碱基,下游引物加入了EcoRⅠ酶切位点和3个保护性碱基,引物序列为:上游:BamHⅠ:GAGGGATCCATGAAATATACAAGCTAT;下游:EcoRⅠ:GACGAAT TCT TACGTTGATGCTCTCC。预计扩增片段长度为510 bp左右,包括BoIFN-γ信号肽的整个ORF,引物由上海生工生物工程技术服务有限公司合成。
1.2.2 牛脾脏淋巴细胞的分离与诱导培养 无菌采集牛脾脏,快速将脾脏剪切、研磨,分离出单个细胞。离心后用每管5 mL Hank′s悬浮细胞,用胶头滴管缓缓加入到5 mL淋巴细胞分离液中,具体方法参照淋巴细胞分离液说明书进行。最后用含ConA浓度为7.5 μ g/mL的1640全培养液重新悬浮细胞,调整细胞浓度到107个/mL,加入到24孔细胞培养板,置37℃、体积分数为5%的二氧化碳的培养箱中,培养18 h。
1.2.3 牛脾脏淋巴细胞总RNA的提取 经Con A诱导培养18 h后,离心收集淋巴细胞,之后,按T rizol Reagent说明书上的操作方法进行。
1.2.4 BoIFN-γ基因cDNA的合成 以提取的牛脾脏淋巴细胞总RNA为模板,参照宝生物工程(大连)有限公司的反转录酶使用说明书合成cDNA。
1.2.5 BoIFN-γ基因的克隆及纯化 PCR反应体系为50 μ L。在PCR反应管中分别加入cDNA模板10 μ L,5×PCR缓冲液10 μ L,特异上游引物0.5 μ L,EXTaq酶0.25 μ L,加灭菌超纯水至50 μ L,置PCR仪中进行PCR扩增。首先94℃预变性2 min;然后94℃30 s,54.6℃30 s,72℃30 s,共30个循环;最后72℃延伸10 min,4℃结束反应,用琼脂糖凝胶电泳检测产物。
根据DNA回收试剂盒说明书对RT-PCR产物进行纯化。将DNA置—20℃保存备用。
1.2.6 重组质粒的构建及鉴定 将纯化后的目的片段与pMD18-T载体16℃连接30 min,然后转化大肠埃希菌BL21感受态细胞,具体步骤参照分子克隆实验指南[7]。小量制备重组质粒DNA,按照碱裂解法进行[7]。取少量重组质粒DNA进行PCR鉴定,并用EcoRⅠ和BamHⅠ进行双酶切鉴定。
1.2.7 序列测定 将鉴定为阳性的重组质粒送上海生物工程技术服务有限公司进行序列测定。用分析软件DNA Star将测定结果与已知序列进行比较分析,阳性质粒命名为pMD-BoIFN-γ。
1.2.8 重组表达载体的构建 用BamHⅠ、EcoRⅠ双酶切重组质粒pMD18-IFN-γ,将目的基因切下,亚克隆到相同内切酶处理过的表达载体pQE-30上,转化x-LI Blue感受态细胞,涂布于LB固体培养基(含30 μ g/mL Kan),37℃培养过夜。常规方法提取重组质粒,之后进行酶切鉴定和PCR鉴定,阳性重组质粒命名为pQE30-IFN-γ。
1.2.9 重组蛋白表达 实验中阳性菌于37℃振荡培养至OD600达0.6~0.8时,用1.0 mmol/L IPTG于37℃进行诱导表达,而后取样进行SDS-PAGE电泳分析。
1.2.10 Western blot 经SDS-PAGE电泳后,将凝胶上的蛋白转印至PVDF膜上,50 g/L脱脂奶粉4℃封闭过夜,抗His-Tag单克隆抗体室温孵育1 h,PBST洗涤。1∶2 000倍稀释的辣根过氧化物酶标记的二抗IgG室温孵育1 h,PBST洗涤,DAB显色,进行Western blot分析。
1.2.11 蛋白的回收、纯化 参照文献[8]进行。
1.2.12 鼠免疫血清的制备 用纯化的γ干扰素蛋白与弗氏佐剂混和,免疫8周龄Balb/c小鼠。具体免疫程序参照文献[9]进行。将血液于37℃静置1 h,再于4℃冰箱放置3 h~4 h。待血液凝固后,吸取血清,3 000 r/min离心14 min,取上清,分装后置20℃保存。
1.2.13 ELISA检测血清抗体效价 将纯化的20 μ g/mL的γ干扰素蛋白包被ELISA板,每孔0.1 mL,4℃过夜,每孔再加封闭液0.1 mL,37℃静置2 h,洗板5次,每孔加入倍比稀释免疫血清(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000)0.1 mL,37℃反应45 min,洗板5次,每孔再加入1∶1 000稀释的辣根过氧化物酶标记的羊抗鼠IgG二抗,37℃反应45 min,洗板,每孔加0.1 mL底物,室温放置20 min。2 mol/L硫酸50 μ L终止反应,于96孔酶标仪上测定450 nm吸光值。
2 结果
2.1 PCR结果
PCR扩增包含信号肽序列的BoIFN-γ基因片段,取5 μ L PCR产物12 g/L琼脂糖凝胶电泳,电压5 V/cm电泳,在紫外透射仪下可见到与预期条带大小相符的BoIFN-γ为510 bp(图1)。

图1 RT-PCR产物电泳分析Fig.1 Agarose gel electrophoresis of RT-PCR products
2.2 表达载体质粒鉴定结果
为了验证重组质粒是否为阳性,挑取蓝白筛选后的白色菌落进行PCR扩增(图1)和BamHⅠ/EcoRⅠ双酶切鉴定(图2)。结果扩增出与预期的片段大小一致,而且为单一条带,可以初步证明重组质粒为阳性。双酶切鉴定,得到的片段与预期的片段大小一致,这表明鉴定的重组质粒为阳性。
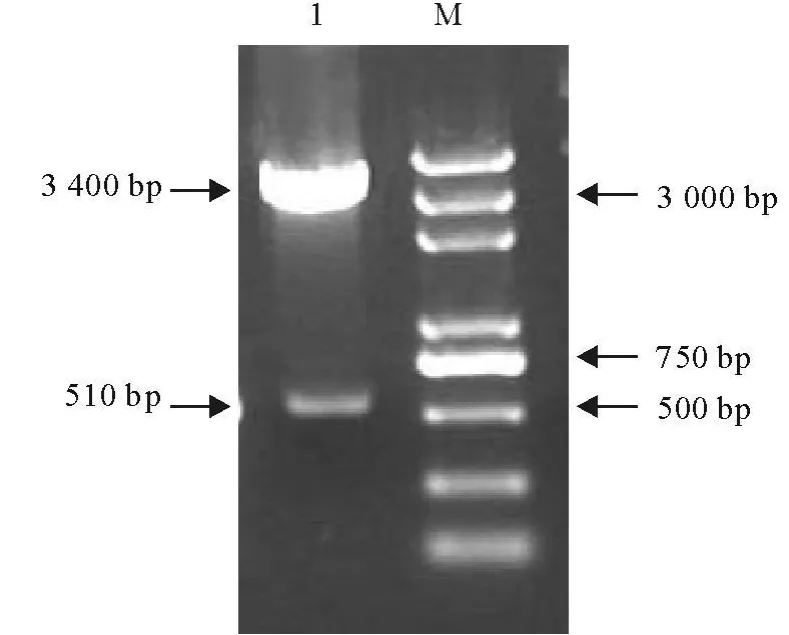
图2 重组质粒的酶切鉴定Fig.2 Enzyme digestion of recombinant plasmid
2.3 重组蛋白的SDS-PAGE电泳
重组质粒转化到x-LI Blue大肠埃希菌后,经1 mmol/L IPTG诱导3 h,当OD600值为0.6~0.8之间时,收集菌液,离心,弃上清洗涤2次~3次,加入上样缓冲液,煮沸后上样,每孔上样10 μ L,然后开始100 g/L SDS-PAGE电泳。结果与对照样品相比,重组x-LI Blue大肠埃希菌表达出大小为22 ku的蛋白条带(图3)。

图3 表达产物SDS-PAGE电泳结果Fig.3 SDS-PAGE results of expressed products
2.4 Western blot检测结果
将SDS-PAGE电泳凝胶转移到硝酸纤维素膜上,经Anti-His-Tag一抗、HRP标记的羊抗鼠IgG的二抗反应,最后经DAB显色,结果在22 ku处检测到表达的蛋白质条带(图4)。
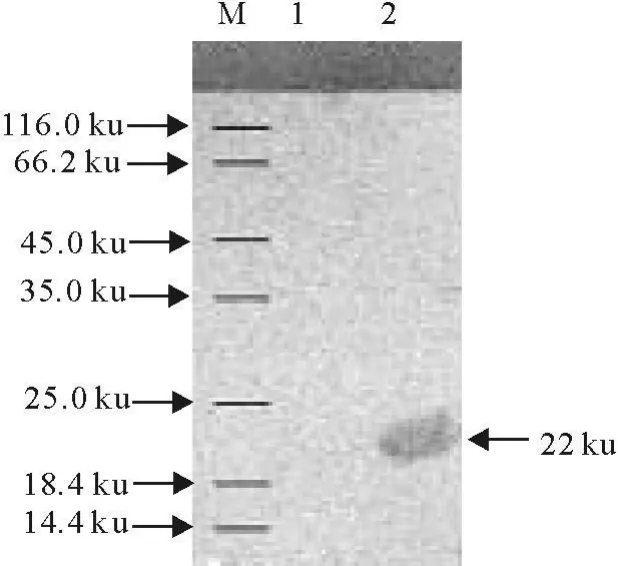
图4 表达产物Western blot检测结果Fig.4 Analysis of expressed products by Western blot
2.5 鼠血清抗体效价的测定结果
血清按1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000比例稀释,阴性对照为未注射该蛋白的小鼠血清。ELISA结果表明,小鼠的抗体效价均在1∶32 000以上,免疫效果较好(表1)。

表1 IFN-γ免疫血清的测定结果T able 1 Detection results of immunized IFN-γserum antibody in mice
3 讨论
IFN-γ是一种具有抗病毒、抗肿瘤和免疫调节作用的细胞因子,主要由活化的T细胞和NK细胞产生。IFN-γ对机体免疫系统具有强大的调节作用,是机体发挥免疫功能、清除体内病原体不可缺少的成分[10-11]。因此,IFN-γ在疾病的诊断、治疗和疫苗免疫效果检测等方面具有重大作用,是现代分子生物学、免疫学和临床医学研究的热点之一。
INF-γ是在特定的诱生剂作用下,由机体自身产生的一种维持机体自我稳定的防御性物质。常见的诱生剂包括两种:一种是促细胞分裂剂,如植物血凝素(PHA)、刀豆素(ConA)、商陆(Poke-weed)、细菌脂多糖(LPS)、葡萄球菌肠毒素(SEA);另一种是特异性抗原,如结核菌素、破伤风毒素、肿瘤细胞等。本研究中用Con A体外诱导牛外周血淋巴细胞后再抽提细胞总RNA,用RT-PCR技术扩增了BoIFN-γ基因。刀豆素蛋白A(ConA)是一种能使高比例的淋巴细胞活化的多克隆激活剂[7]。刺激淋巴细胞活化后,IFN-γ可在0.5 h~20 h开始表达[12]。但本试验在用Con A刺激4 h左右的时候开始提取细胞总RNA并进行RT-PCR扩增,未获得成功,这可能和我们培养外周血淋巴细胞活性及刺激浓度有关,也可能是IFN-γ表达量不够所造成的。后来我们用Con A刺激18 h时提取细胞总RNA并进行RTPCR扩增而获得成功的。将扩增出的BoIFN-γ基因的cDNA片段连接到pMD18-T载体上测序,测序结果表明,与GenBank中已发表的序列同源性为99.8%。然后将其连接到原核表达载体pQE-30中,通过将克隆的牛γ干扰素基因定向插入原核表达载体pQE-30的相应位点,转化x-LI Blue表达菌株,进行诱导,结果成功获得了表达。取样重组菌体,煮沸裂解后,将上清和菌体裂解产物分别上样电泳,证明牛γ干扰素蛋白为可溶性表达。并且蛋白的表达量较大。为后续的纯化带来了方便,为免疫接种提供了良好的条件。将该蛋白免疫小鼠后获得的多克隆抗体,经ELISA检测结果表明,该抗体效价在1∶32 000以上,说明该蛋白具有很好的免疫原性,为进一步研究该蛋白的功能奠定了基础。
[1] 刘 颖,刘冬光,廖娟红,等.梅花鹿γ干扰素克隆表达及抗病毒活性测定[J].动物医学进展,2009,30(11):1-5.
[2] 王晓丽,王永明,朱万光,等.干扰素研究进展[J].动物医学进展,2008,29(12):60-63.
[3] 刘高生,卢升云.干扰素的免疫作用机制[J].中国兽医科技,2004,34(10):72-74.
[4] Sordillo L M,Babiuk L A.Controlling acute Escherichia coli mastitis during the periparturient period with recombinant bovine interferon gamma[J].Vet Microbiol,1991,28(2):189-198.
[5] 金伯泉.细胞与分子免疫学[M].陕西西安:世界图书出版社,1998:133-137.
[6] 孙圣兰,江青艳,傅伟龙.干扰素的研究进展[J].动物医学进展,2002,23(6):39-41.
[7] 黄培堂译.分子克隆试验指南[M].3版.北京:科学出版社,2002.
[8] 张敏敏.人Hdeghego信号通路配体sHH的N末端蛋白的原核表达及多克隆抗体的制备[D].上海:第二军医大学,2006.
[9] 李 超,林祥梅,余多慰,等.牛干扰素单克隆抗体的制备于初步鉴定[J].动物医学进展,2010,31(4):53-56.
[10] Bonjardim C A,Ferreira P C,Kroon E G,et al.Interferons:signaling,antiviral and viral evasion[J].Immunol Lett,2009,122(1):1-11.
[11] Sadler A J,Williams B R.Interferon-inducible antiviral effectors[J].Nat Rev Immunol,2008,8(7):559-68.
[12] 黎荣松.干扰素作用机理和2-SA系统[J].生物化学与生物物理进展,1990,17(3):188-193.
