外源茉莉酸甲酯(MeJA)对大豆异黄酮合成途径的影响
2011-03-07马君兰
马君兰,赵 越
(东北农业大学生命科学学院,哈尔滨 150030)
异黄酮是一种酚类次级代谢物,由苯丙烷类代谢途径的一个分支合成。它主要是在豆科植物中合成,能够诱导根瘤的形成。一些异黄酮化合物有抗真菌的活性,和/或者作为主要的植物抗毒素的前体,有的异黄酮本身就是植物抗毒素。近年来,异黄酮还成为了重要的保健品:能够缓解更年期症状[1];预防乳腺癌、前列腺癌等与激素有关的癌症的发生[2];预防心血管疾病[3];对其他的一些生理学过程起到积极的影响,如神经生物学活动[4]。但是目前国内的研究大多关注于异黄酮的提取、纯化和测定以及异黄酮的保健机理,无法从根本上解决异黄酮在自然界匮乏的问题。
植物进行光合作用形成碳水化合物后,通过磷酸戊糖途径(PPP)途径或EMP途径都可以形成莽草酸。分支酸是芳香族氨基酸合成的分支点。分支酸为苯丙氨酸、酪氨酸和色氨酸提供了碳架结构。苯丙氨酸在苯丙氨酸解氨酶(PAL)的作用下形成肉桂酸,进入了次级代谢途径。一些诱导物能够调节植物的次级代谢,如:茉莉酸甲酯、水杨酸等。
茉莉酸类物质在植物中广泛存在,并具有广谱的生理效应、调控许多基因的表达。Creelman,Mullet指出,在植物抗病方面,主要是依靠茉莉酸甲酯对次级代谢产物的调节作用,尤其体现在对查尔酮合成酶(CHS)和苯丙氨酸解氨酶(PAL)基因的调节上[5]。茉莉酸甲酯(MeJA)处理可使两者mRNA少量增加。乞永艳等报道了MeJA浸泡大豆的子叶能够促进大豆异黄酮的增加[6],但是随着浸泡时间的延长,黄豆苷元、染料木黄酮的含量下降。本试验利用茉莉酸甲酯对大田框栽的大豆进行叶面喷施,上调了大豆异黄酮的合成途径,增加了大豆异黄酮的含量,初步分析了大豆种子成熟过程中,大豆异黄酮合成途径的动态变化规律,为大豆异黄酮合成机理的研究搭建了平台。茉莉酸甲酯有广谱的生理功能并且无公害,利用它为诱导剂有一定的生产意义。
1 材料与方法
1.1 材料、取样方法以及样品制备
本试验所用的材料是东北地区广泛种植的品种东农47。从喷施后的第六天开始取样,每隔5 d取一次样,直至大豆籽粒成熟。上午8∶00~10∶00取样。从大豆植株的上、中、下部以及每个平行处理中随机取样,混合后,测定各项指标,3次重复。浓度分别为75、150、300、450、600μmol·L-15个处理,在结荚期初期(8月4日)对大豆进行叶面喷施,早晚各一次,喷施3 d。
1.2 测定方法
1.2.1 PAL酶活性测定
粗酶提取:参照文献[7]的方法并有所改进。取剪碎并混合后的样品,按照1∶4的比例加入0.1 mol·L-1、pH 8.3、Tris-HCl缓冲液(内含 5 mmol·L-1巯基乙醇和0.5 g PVP)冰浴研磨;4℃10000 r·min-1离心15 min;弃沉淀,上清液为粗酶液。使用紫外分光光度计(北京瑞利分析仪器公司UV-1600)进行酶活性测定:反应体系包括:0.5mL酶液、2mL缓冲液、1mL 0.02 mol·L-1的L-丙氨酸溶液、30℃水浴保温30 min、290nm下测定吸光度。酶活力以△OD290nm=0.001为一个酶活力单位(U)。
1.2.2 色氨酸含量的测定
应用荧光分光光度计(美国PE公司)方法测定。色氨酸有2个激发光谱峰(225和280nm)和1个发射光谱峰(350nm),选用灵敏度高而干扰少的280nm作激发波长。激发光谱狭缝宽度为10nm,发射光谱狭缝宽度为10nm。将样品杀青、烘干至恒重、粉碎、过筛、脱脂,脱叶绿素。碱法水解蛋白,将水解物转移至已加有1.4mL 6 mol·L-1HCl的25mL容量瓶中;用pH 10.5的KH2PO4-NaOH缓冲液调节pH并定容;将样品液过0.45 nm的膜,上机进行检测。
1.2.3 总异黄酮含量的测定
改进文献[8]的测定方法,应用紫外分光光度计(北京瑞利分析仪器公司UV-1600)。总异黄酮标样由东北农业大学生命科学学院郝再彬老师惠赠。将样品杀青、烘干至恒重、粉碎、过筛、脱脂,脱叶绿素;60℃烘干至恒重,按照物料比为1∶6的比例加入80%的乙醇,50℃超声波浸提1 h,冷却至室温;4000 r·min-1离心10 min,适当稀释,260nm下测定吸光度,大豆异黄酮得率(μg·g-1)=提取液中大豆异黄酮质量(μg)/所用脱脂豆粉质量(g)。
1.2.4 黄豆苷元、染料木黄酮含量的测定
应用高效液相色谱仪(Agilent 1100 series)测定染料木黄酮和黄豆苷元。染料木黄酮与黄豆苷元的标样由东北农业大学食品学院惠赠(Sigma公司,色谱纯)。取所提取的总异黄酮溶液390μL(提取过程见1.3.3)定容至1mL;过0.45μm的抗有机溶剂膜;根据苗虹的测定方法[7]并进行改进。用进样针吸入30μL(有20μL定量环)用高效液相色谱测定,高效液相色谱的条件:
流动相:甲醇∶磷酸(0.4%)6∶4;流速0.7mL·min-1;柱温30℃;检测器(紫外);波长260nm;进样量20μL。
黄豆苷元或染料木黄酮得率(μg·g-1)=提取液中黄豆苷元或染料木黄酮的质量(μg)/所用脱脂豆粉质量(g)。
2 结果与分析
2.1 MeJA对大豆籽粒PAL活力的影响
结果见图 1。在 0~450μmol·L-1浓度范围内,籽粒PAL活力随着MeJA喷施浓度的增加而增加,但600μmol·L-1的处理PAL 活力与 450μmol·L-1的处理相比,时高时低。说明外源茉莉酸甲酯诱导PAL的酶活性,进而对次级代谢途径产生影响。在整个结荚期籽粒PAL活呈现低-高-低的抛物线趋势。PAL的活力不仅表现对次级代谢途径的动态变化还是植物抗逆的重要指标。茉莉酸甲酯对PAL的诱导作用也表明它能够提高植物的抗逆性。
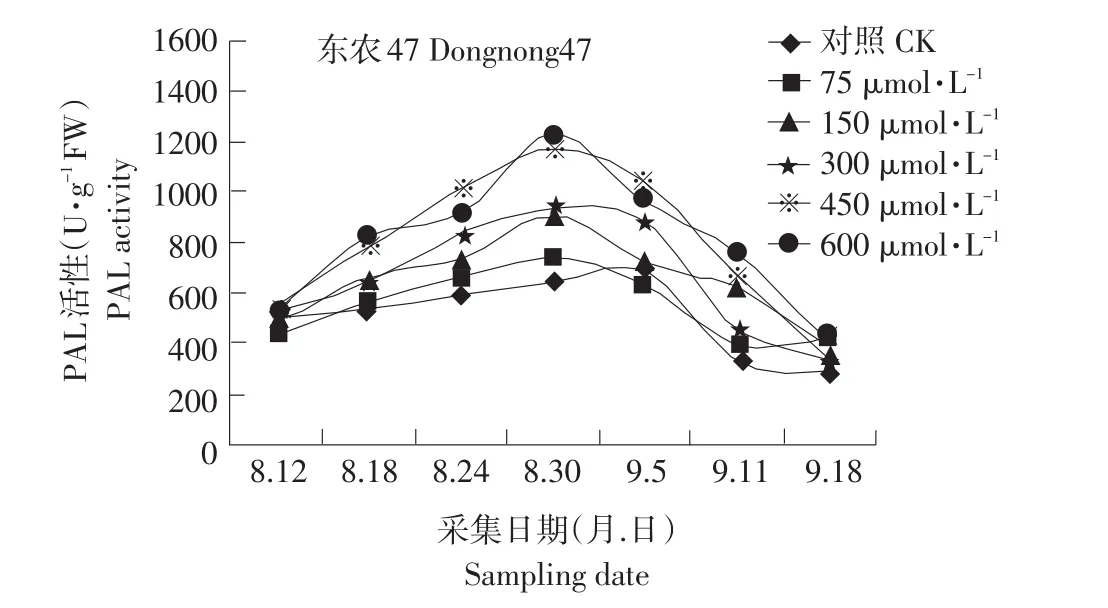
图1 MeJA对大豆籽粒PAL活力的影响Fig.1 Effect of exogenous MeJA on the activity of PAL in seed
2.2 MeJA对籽粒色氨酸合成的影响
结果见图2。
MeJA能够促进色氨酸的合成,450和600μmol·L-1处理后的色氨酸含量较高。450μmol·L-1处理后种子色氨酸含量为4160μg·g-1,比对照高了1120μg·g-1。MeJA在诱导植物防御的胞内信号转导的途径中起整合作用,能够增强植物的己糖-磷酸(HMP)途径,产生低分子质量的酚类前体,可能是由于MeJA所产生的这些低分子量的酚类前体物被色氨酸合成途径所利用,使色氨酸的含量增加。从种子开始发育到成熟,色氨酸含量的变化趋势是从低到高的,说明在植物生殖生长时期,主要是进行的色氨酸的合成反应,并能通过将其与其它氨基酸缩合形成蛋白的形式,将色氨酸积累在种子当中。

图2 MeJA对籽粒色氨酸含量的影响Fig.2 Effect of exogenous MeJA on the tryptophan level in seed
2.3 MeJA对大豆异黄酮合成的影响
结果见图3~5。
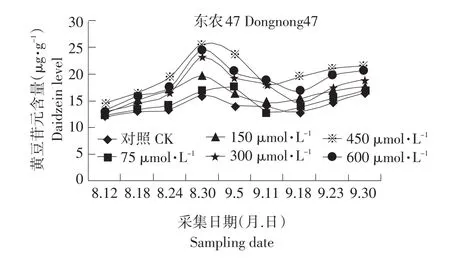
图3 MeJA对籽粒黄豆苷元合成的影响Fig.3 Effect of exogenous MeJA on the synthesis of daidzein in seed
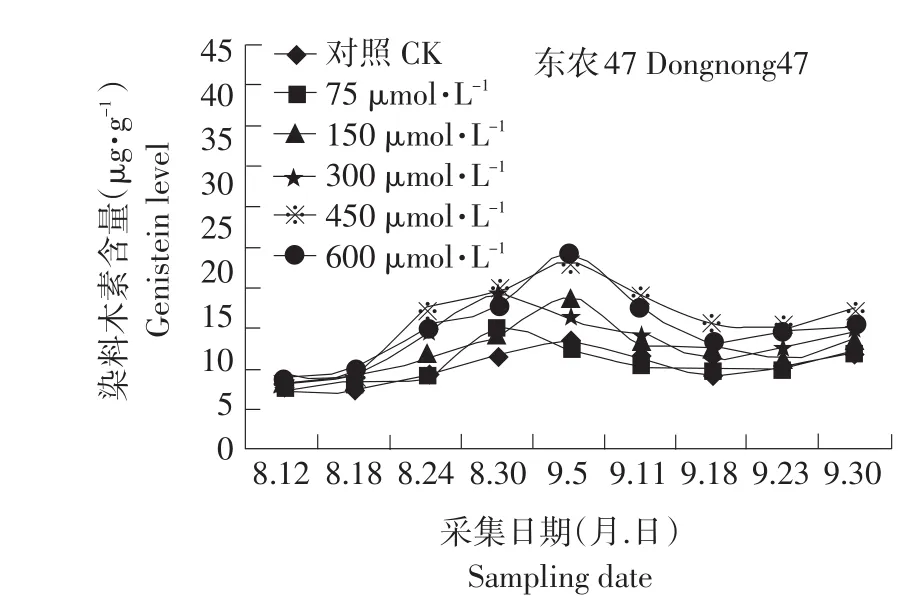
图4 MeJA对籽粒染料木黄酮含量的影响Fig.4 Effect of exogenous MeJA on the genistein level in seed
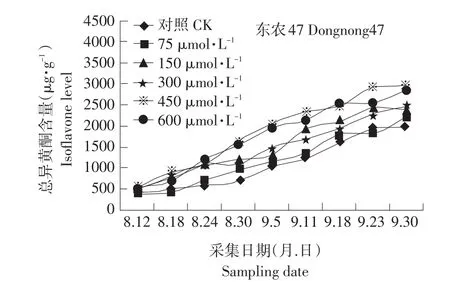
图5 MeJA对籽粒总异黄酮含量的影响Fig.5 Effect of exogenous MeJA on the isoflavone level in seed
异黄酮含量随着喷施浓度的增大而增大,但是600μmol·L-1的处理与450μmol·L-1的处理相比,异黄酮的含量并没有显著的提高。这是由于:首先MeJA能增强植物产生低分子质量的酚类前体以及在多聚作用时产生游离基;其次,MeJA能促进PAL活力,从而上调次级代谢途径。MeJA所产生的低分子质量酚类前体和上调次级代谢途径共同作用促进异黄酮合成的中间产物增加,并促进异黄酮的合成。450μmol·L-1的茉莉酸甲酯处理后所收获的大豆种子中黄豆苷元的含量比对照提高了5.1μg·g-1,染料木黄酮的含量比对照提高了5.1μg·g-1,总异黄酮的含量比对照提高了960μg·g-1。在大豆生殖生长的过程中,黄豆苷元,染料木黄酮含量的变化趋势与总异黄酮的含量的变化趋势不同:黄豆苷元与染料木黄酮呈由低-高-低-上升的趋势,总异黄酮呈低-高的变化趋势。这可能是由于黄豆苷元和染料木黄酮还要作为下游的异黄酮类化合物的前体物质,如:游离的黄豆苷元和染料木黄酮在糖基转移酶的作用下,逐渐转化成糖苷型;黄豆苷元是异戊烯黄酮(Glyceollins)的前体[6]。在种子成熟前的14 d,染料木黄酮和黄豆苷元的量又有逐渐升高,这可能是由于种子即将成熟,各种合成酶和糖基转移酶失活和水解,又将少量染料木苷水解为染料木黄酮。总异黄酮呈低-高的变化趋势,说明种子发育的阶段主要进行的是异黄酮的合成和积累反应。
相关性分析表明在种子发育的初期到中后期,籽粒的PAL活力与黄豆苷元和染料木黄酮的合成呈显著正相关,甚至在某些时期出现极显著水平。但是在种子成熟的前14 d,PAL活性检测不到的时候,黄豆苷元和染料木黄酮的含量又呈上升趋势,说明在种子发育的初期和中后期,籽粒中的PAL是黄豆苷元和染料木黄酮的限速酶。总异黄酮成分复杂,影响其含量的酶和因素较多。PAL活力上升时,总异黄酮含量也在上升,但是在种子PAL活力降低的时候,总异黄酮的含量还在增加。可能是异黄酮比起PAL来有一个积累的过程和相对的滞后期。PAL可能不是总异黄酮的限速酶,其原因有待进一步分析和研究。
色氨酸与大豆异黄酮的合成的关系还未见报道。相关性分析表明色氨酸和总异黄酮合成的趋势极显著的相关说明充足的前体物质为色氨酸和异黄酮得合成提供了充足的碳架结构。
3 讨 论
利用诱导子刺激植物细胞生产次生代谢产物己成为目前国内外研究的常用手段,但对于诱导子调节植物细胞的初生代谢物和次生代谢物的合成的研究较少。MeJA能够诱导植物防御的细胞内信号转导途径[9]从而诱导了植物次级代谢的途径,包括植物次级代谢途径的相关酶类,PAL,CHS等,以及黄酮类,异黄酮类及生物碱类物质的合成[10]。
色氨酸、黄豆苷元、染料木黄酮以及总异黄酮都属于酚类次级代谢产物。MeJA促进它们大量合成的机理可能在于MeJA能增强植物的HMP途径,诱导初生代谢使前体物增加,一方面促进植物叶片纤维素及木质素含量的升高;另一方面,又能产生低分子量的酚类前体以及在多聚作用时产生游离的基团。黄豆苷元、染料木黄酮的增加还由于PAL的活力增强的因素。造成本试验与报道不相同的结论的原因可能是所处理的大豆的条件不一样。本试验处理的是活体的大豆植株。
本试验研究表明:MeJA能够上调大豆异黄酮的合成途径—提高了种子当中的色氨酸、黄豆苷元、染料木黄酮以及总异黄酮的含量。本试验在大豆生殖生长阶段,对大豆异黄酮代谢途径各物质的代谢的动态变化进行研究,其中对色氨酸、黄豆苷元和染料木黄酮的动态变化的研究国内外还未见报道。了解整个种子生殖生长时期,对异黄酮代谢机理的研究有助于我们从分子水平和化学、物理多种因素对异黄酮的合成途径进行调控从而达到增加黄豆苷元和染料木黄酮的含量的目的并且也有利于我们有目的地选择采摘的时间和对大豆品质进行改良。杜邦公司将CRC转录因子导入大豆中,从而提高了PAL mRNA含量,从而上调了整个大豆异黄酮的代谢途径,成功的提高大豆异黄酮的含量,培育出拥有自己产权的新品种[11]。
4 结论
a.茉莉酸甲酯能够上调大豆异黄酮的代谢途径,450μmol·L-1的茉莉酸甲酯是喷施最适浓度。
b.在大豆的整个生殖生长时期,色氨酸呈现由低到高的的抛物线趋势,大豆总异黄酮的积累随着色氨酸的增加而增加,但黄豆苷元、染料木黄酮的合成与色氨酸的合成相关性不显著。
c.在大豆的整个生殖生长时期,黄豆苷元、染料木黄酮呈由低-高-低-上升的动态变化,总异黄酮含量呈由低到高的抛物线趋势。黄豆苷元、染料木黄酮与总异黄酮的合成的相关性不显著。
[1]Nestel P.Isoflavones:Their effects on cardiovascular risk and functions[J].Curr Opin Lipidology,2003,14(1):3-8.
[2]Watanabe S.Phytoestrogen and cancer prevention[J].Jpn J Cancer Res,2003,30:902-908.
[3]Goetzl M A,Van Veldhuizen P J,Thrasher J B.Effects of soy phytoestrogens onthe prostate[J],Prostate Cancer Prostatic Dis,2007(10):216-223.
[4]Patricia S W-H,Brent D F,mark J M,et al.Isoflavone supplements containing predominantly genistein reduce hot flash symptoms:A critical review of published studies[J].Menopause,2006,13:831-839.
[5]Creelman R A,Tiemey M L,Mullet J E.Jasmonic acid/methyl jasmonate accumulate in wounded soybean hypocotyls and modulate wound gene expression[J].Proc Natl Acad Sci USA,1992,89(11):4938-4941.
[6]乞永艳,Bovy A,唐益雄.外源茉莉酸对大豆异黄酮的影响[J].大豆科学,2006,25(1):87-90.
[7]谢灵玲,赵武玲,沈黎明.光照对大豆叶片苯丙氨酸裂解酶(PAL)基因表达及异黄酮合成的调节[J].植物学通报,2000,17(5):443-449.
[8]王哲,白志明,田娟娟,等.紫外分光光度法测定大豆异黄酮含量[J].中国油脂,2005,30(1):52-54.
[9]苗虹,赵云峰,周蕊,等.高效液相色谱法测定食品中大豆异黄酮含量[J].中国食品添加剂,2004(5):92-96.
[10]Petz L N,Ziegler Y S,Loveb M A,et al.Estrogen receptor β-selectire transcriptional actirity and recruitment of coregulators by phytoestrogens[J].Journal of Bbiological Chemistry,2001,276,21:17808-17814.
[11]Yu O,Shi J,Hession A O,et al.Metabolic engineering to increase isoflavone biosynthesis in soybean seed[J].Phytochemistry,2003,63:753-763.
