槲皮素保护少突胶质前体细胞缺氧低糖损伤的体外研究
2011-02-27王兴启杨丽华于红丽姚瑞芹
王兴启,刘 轩,杨丽华,于红丽,翟 玥,刘 静,姚瑞芹
(徐州医学院神经生物学教研室,江苏徐州 221002)
研究发现,缺血缺氧可以导致脑氧化损伤、兴奋毒性损伤、炎症反应等并可能诱发脑室周围白质软化病[1-2](periventricular leukomalacia,PVL)。OPCs受损和神经纤维脱髓鞘是PVL的最大特征。中枢神经系统能够通过诱导OPCs分化为成熟的少突胶质细胞进行髓鞘再生。因此,保护和减少OPCs损伤是减缓 PVL发展的关键。槲皮素(quercetin,QUE)是一种天然黄酮类物质,它们具有良好的促细胞增殖和细胞保护作用[3-4]。此外,槲皮素的多种神经保护作用也得到研究证实[5-6]。因此它可能在抗OPCs损伤中有良好的效果。但槲皮素对OPCs缺氧低糖损伤的保护效果如何并未见相关报道。本研究将在Na2S2O4诱导的OPCs损伤模型基础上探讨槲皮素不同孵育方法对OPCs缺氧低糖损伤的保护效果。
1 材料与方法
1.1 材料新生1~2 d SD大鼠(♀♂不拘),由徐州医学院实验动物中心提供,生产许可证号:SCXK(苏)2005-0005;使用许可证号:SYXK(苏)2005-0018;DMEM/F12(1∶1)、重组人碱性成纤维细胞生长因子和重组人血小板衍化生长因子均购于Gibco公司;槲皮素购于Sigma公司;胎牛血清(FBS)购于杭州四季青生物工程材料有限公司;兔多克隆抗体A2B5购于武汉USCN SCIENCES公司;连二亚硫酸钠购于南京博湃生物技术有限公司;CCK-8检测试剂盒购于南京凯基生物科技发展有限公司;乳酸脱氢酶(LDH)测定试剂盒及Annexin V-FITC/PI凋亡试剂盒购于南京建成生物工程研究所。
1.2 细胞培养高纯度OPCs分离、纯化和培养,参照 Chen 等[7]的方法。
1.3 建立缺氧低糖损伤模型纯化的OPCs培养3 d后弃去培养基,漂洗2次后加入含2 mmol·L-1Na2S2O4的低糖培养基继续培养,旋紧瓶口,正常对照组仍用原来方法培养。Annexin V-FITC/PI试剂盒检测对照组、0.5 h组、1 h组和1.5 h组的细胞凋亡情况。
1.4 CCK-8法检测细胞存活率检测1~100 μmol·L-1槲皮素分别处理OPCs 12 h对其活性的影响。将纯化的OPCs接种于96孔板中,分为6组,每组设5个复孔,每孔100 μl培养基,每天半量换液,3 d后分别在对照组及各槲皮素浓度组每孔中加入10 μl的CCK-8溶液继续孵育4 h。槲皮素共孵育和预孵育比较实验则分别设7组,即对照组、OGD组和1~81 μmol·L-1槲皮素组。酶联仪检测细胞D450值。细胞相对存活率=模型组D450值/正常对照组D450值。共孵育是指OPCs缺氧低糖损伤的同时各组加入相应浓度的槲皮素,而预孵育是指各组用相应浓度槲皮素预先孵育3 h后再行缺氧低糖损伤。损伤时间选择1.5 h。
1.5 LDH漏出率测定分组方法同上,处理方法按照LDH测定试剂盒操作说明书进行。
1.6 槲皮素对OPCs缺氧低糖损伤形态学的影响将纯化的OPCs接种于6孔板中,分为4组,即对照组、OGD 组、81 μmol·L-1槲皮素共孵育组和预孵育组。缺氧低糖损伤后分别在镜下观察各组在形态学上的改变。
1.7 统计学处理所有数据用SPSS 16.0软件分析,组间比较采用单因素方差分析(One-Way ANOVA),数据用±s表示。
2 结果
2.1 不同浓度槲皮素对细胞活性影响采用不同浓度(1、3、9、27、81、100 μmol·L-1)的槲皮素处理OPCs 12 h后,测定每组细胞相对存活率。结果表明:当其浓度达到 100 μmol·L-1时细胞活性受到明显影响(P < 0.01)。以上 1、3、9、27、81 μmol·L-1浓度被选用于后续实验。
2.2 流式细胞仪检测OPCs凋亡情况对照组正常存活细胞相对数量为98.6±0.9,缺氧低糖0.5 h组为64.2±4.3(P<0.01),1 h组为21.5±4.8(P<0.01),1.5 h组为10.5±5.5(P< 0.01);凋亡细胞相对数量与对照组相比,缺氧低糖0.5 h组为35.1±7.6(P<0.01),1 h组为 76.8±17.2(P<0.01),1.5 h组为88.7±5.7(P <0.01)。见 Fig 1。
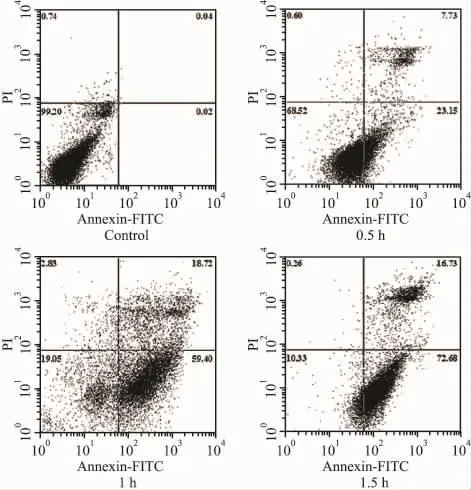
Fig 1 The proportion of apoptotic cells was determined by Annexin V-FITC/PI assay(n=3)
2.3 槲皮素对缺氧低糖损伤OPCs相对存活率和LDH漏出率的影响Fig 2表明:槲皮素能明显提高OPCs的相对存活率,抵抗缺氧低糖损伤,Fig 3表明:槲皮素能明显降低缺氧低糖损伤细胞LDH漏出率,间接反映槲皮素对OPCs细胞膜的保护作用。Fig 2,3都表明:同一浓度下共孵育的保护效果比预孵育更明显(P<0.05),其发挥保护作用的浓度范围分别是 3 ~81 μmol·L-1和 9 ~81 μmol·L-1,表现为剂量效应。
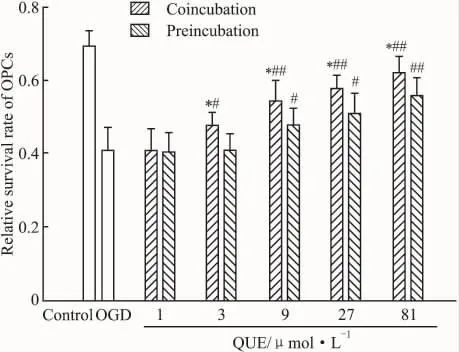
Fig 2 Effect of QUE on the viability of OPCs was measured by CCK-8(n=4)
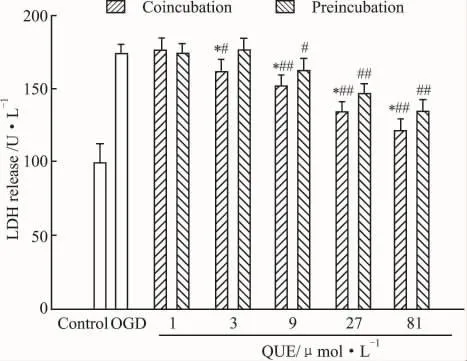
Fig 3 Effect of QUE on the LDH release of OPCs was measured by LDH assay(n=4)
2.4 槲皮素对OPCs缺氧低糖损伤形态学的影响81 μmol·L-1槲皮素处理 OPCs后,镜下观察细胞形态学变化。对照组细胞轮廓清晰,可见典型的双极突起,椭圆形胞体边缘有明显光晕;缺氧低糖1.5 h后,OGD组的细胞突起全部回缩且几乎都漂浮起来,槲皮素预孵育组细胞胞体全部回缩但漂浮率较OGD组偏低,而共孵育组仍可见部分细胞有突起存在且漂浮率明显偏低。见Fig 4。
3 讨论
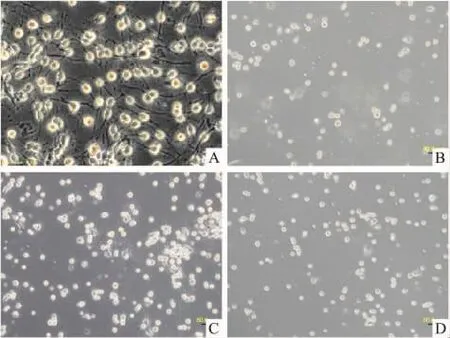
Fig 4 The morphology of OPCs was observed by inverted microscope
中枢神经系统发育过程OPCs在脑中迁移并最终分化为成熟的少突胶质细胞形成髓鞘,髓鞘包裹着轴突并维持它的生理功能[8]。当某些因素导致轴突脱髓鞘后会继发多种神经系统疾病,此时OPCs的修复作用对病情的好转尤为重要。但是,OPCs抵抗损伤的能力有限特别是在妊娠期23~32周时缺血缺氧对其损伤尤为严重[9]。早产儿中患脑瘫的比例比较大,这与OPCs损伤有很大关系。槲皮素具有良好的神经保护作用,已有研究发现槲皮素能够明显降低皮质细胞因缺氧缺糖导致的兴奋毒性损伤[10],此外,它还能保护大鼠因缺血而致的空间记忆减退和神经细胞死亡[11]。本研究发现槲皮素对OPCs缺氧低糖损伤具有保护作用,这些数据进一步证明了它的神经保护作用,也为OPCs损伤保护提供了良好的药物选择。
Na2S2O4可以迅速制造出无氧液相环境且自身不直接损伤细胞,其模型建立效果也已得到其他实验证实[12-13]。我们选择了1.5 h缺氧低糖损伤模型,探讨 1 ~81 μmol·L-1槲皮素对 OPCs的保护作用。共孵育和预孵育的实验结果都证明了槲皮素可以保护OPCs细胞膜的完整性并提高其相对存活率,形态学结果进一步反映了受保护细胞的存活状况,当细胞得到槲皮素的保护后其形态也得到一定程度的维护。同时,本实验发现槲皮素共孵育的神经保护作用较预孵育明显,这可能与OPCs受损后其细胞膜通透性增加,共孵育时槲皮素进入受损细胞的浓度相对增加有关。此外,槲皮素的神经保护作用表现出剂量效应,这可能与随浓度增加其进入细胞的相对浓度增加有关。
综上,本研究证实了槲皮素对OPCs缺氧低糖损伤有明显的神经保护作用。这些数据为OPCs缺氧低糖损伤保护提供了初步的药理学依据,也为深入研究槲皮素对OPCs神经保护机制提供了药物孵育方案。
[1] Back S A,Craig A,Kayton R J,et al.Hypoxia-ischemia preferentially triggers glutamate depletion from oligodendroglia and axons in perinatal cerebral white matter[J].J Cereb Blood Flow Metab,2007,27(2):334 -47.
[2] Jin Y,An X,Ye Z,et al.RGS5,a hypoxia-inducible apoptotic stimulator in endothelial cells[J].J Biol Chem,2009,284(35):23436-43.
[3] 沈丽霞,董晓华,李 炜,等.槲皮素、补骨脂素对乳腺癌细胞株MCF-7增殖的影响[J].中国药理学通报,2009,25(5):601-5.
[3] Shen L X,Dong X H,Li W,et al Effect of quercetin and psoralen on proliferation in MCF-7 cells[J].Chin Pharmacol Bull,2009,25(5):601-5.
[4] 王莉娟,龚 涛,王 丽,等.槲皮素对香烟烟雾提取物诱导的人支气管上皮细胞死亡的抑制效应[J].中国药理学通报,2009,25(7):960 -3.
[4] Wang L J,Gong T,Wang L,et al Inhibition effect of quercetin on cell death in human bronchial epithelial cells induced by cigarette smoke extract[J].Chin Pharmacol Bull,2009,25(7):960 - 3.
[5] Ansari M A,Abdul H M,Joshi G,et al.Protective effect of quercetin in primary neurons against Aβ(1-42):relevance to Alzheimer's disease[J].J Nutr Biochem,2009,20(4):269 - 75.
[6] Bureau G,Longpre F,Martinoli M G.Resveratrol and quercetin,two natural polyphenols,reduce apoptotic neuronal cell death induced by neuroinflammation[J].J Neurosci Res,2008,86(2):403-10.
[7] Chen Y,Balasubramaniyan V,Peng J,et al.Isolation and culture of rat and mouse oligodendrocyte precursor cells[J].Nat Protoc,2007,2(5):1044 -51.
[8] Menn B,Garcia-Verdugo J M,Yaschine C,et al.Origin of oligodendrocytes in the subventricular zone of the adult brain[J].J Neurosci,2006,26(30):7907 -18.
[9] Back S A,Han B H,Luo N L,et al.Selective vulnerability of late oligodendrocyte progenitors to hypoxia-ischemia[J].J Neurosci,2002,22(2):455 -63.
[10] Ha H J,Kwon Y S,Park S M,et al.Quercetin attenuates oxygenglucose deprivation and excitotoxin-induced neurotoxicity in primary cortical cell cultures[J].Biol Pharm Bull,2003,26(4):544 -6.
[11] Pu F,Mishima K,Irie K,et al Neuroprotective effects of quercetin and rutin on spatial memory impairment in an 8-arm radial maze task and neuronal death induced by repeated cerebral ischemia in rats[J].J Pharmacol Sci,2007,104(4):329 - 34.
[12] Liu J,Kam K W,Zhou J J,et al Effects of heat shock protein 70 activation by metabolic inhibition preconditioning or kappa-opioid receptor stimulation on Ca2+homeostasis in rat ventricular myo-cytes subjected to ischemic insults[J].J Pharmacol Exp Ther,2004,310(2):606 -13.
[13] Abudara V,Jiang R G,Eyzaguirre C.Behavior of junction channels between rat glomus cells during normoxia and hypoxia[J].J Neurophysiol,2002,88(2):639 -49.
