非洲绿猴肾上皮细胞损伤及诱导草酸钙晶体
2011-02-20刘爱洁欧阳健明
刘爱洁, 欧阳健明
(暨南大学生物矿化与结石病防治研究所, 广东 广州 510632)
0 引 言
泌尿系结石已经成为一种常见的疾病,世界上几乎5%~12%的人口受到其影响[1-3],结石的种类有多种,其中草酸钙是尿路结石中最常见的组分,在中国以草酸钙为主要成分的结石治愈后复发率高达60%~80%.目前医学认为尿液中草酸钙晶体的成核、生长、聚集是尿草酸结石形成的主要机制[4].细胞与晶体的相互作用是一水草酸钙(COM)肾结石形成的主要机制之一,且促进COM晶体粘附到肾小管上皮细胞表面的阴离子上[5-7].细胞损伤与晶体粘附的相互作用是:一方面,晶体的粘附导致细胞的内部损伤,引起细胞内的一系列反应,包括自由基和活性氧(ROS)的过度产生,即过氧自由基(O2-)、过氧化氢非自由基(H2O2)和羟基阴离子等,这些分子能够改变细胞膜脂类、DNA、线粒体和细胞的结构和成分;草酸钙晶体进一步粘附可以改变基因的表达,导致细胞表面蛋白表达量的变化和细胞的凋亡或坏死[8].另一方面,细胞受损伤后,细胞膜内的磷酯酰丝氨酸(PS)外翻,并在膜表面表达透明质酸等功能分子,为初始晶体的异质成核提供粘附位点,诱导或加剧了草酸钙晶体的成核、生长与聚集.目前细胞损伤不同程度时诱导草酸钙晶体形成的情况并未报道,因此本文研究了不同浓度、不同时间的H2O2诱导非洲绿猴肾上皮细胞(Vero)的损伤及其诱导草酸钙晶体的形成.
1 实验部分
1.1 试剂
非洲绿猴肾上皮细胞株(Vero) (暨南大学生物制药基地),培养液DMEM-F12(Hyclone, 海克隆生物化学制品(北京)有限公司),新生小牛血清(Hyclone,海克隆生物化学制品(北京)有限公司),超氧化物歧化酶试剂盒(南京建成生物工程研究所),细胞增生分析试剂盒(Cell Counting Kit 8,CCK-8)(日本同仁化学研究所),线粒体膜电位检测试剂盒(JC-1)(碧云天生物技术研究所),过氧化氢、氯化钙与草酸钾均为分析纯(广州化学试剂厂).
1.2 实验方法
1.2.1 细胞培养
非洲绿猴肾上皮细胞株(Vero)用含10%新生小牛血清的DMEM-F12培养液培养.培养条件为37 ℃、5% CO2、饱和湿度.Vero传代采用胰蛋白酶消化法.细胞达80%~90% 融合后用D-Hanks液洗涤2次,加入0.25%胰酶消化液,置37 ℃约3~5 min后,在显微镜下观察消化程度,消化适度后加入10%新生小牛血清的DMEM~F12培养液终止消化,吹打分散,使细胞脱离瓶壁并形成单细胞悬液.
1.2.2 细胞损伤前后活力的检测

1.2.3 流式细胞仪对线粒体膜电位的检测
按细胞浓度为2×105cells/mL、每孔2 mL接种于6孔培养板,用含10%新生小牛血清的DMEM-F12培养液孵育,使细胞汇合成单层,实验前换为无血清的DMEM-F12使Vero同步化12 h.将上述细胞分成A、B两组:A组为正常对照细胞,B组为细胞损伤组.A组为正常对照组,只加入无血清培养液.B组加c(H2O2) = 0.3 mmol/L的无血清培养液,与细胞分别作用0.5 h、1.0 h、2 h,或c(H2O2) = 0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、3.0 mmol/L的无血清培养液与细胞各作用1 h.到达作用时间以后,吸除上清液,用D-Hanks液洗涤2次,用0.25%胰酶消化后,加入含血清的培养液终止消化,吹打细胞,使细胞悬浮,然后离心(1 000 r/min) 5 min,吸除上清液,用PBS洗涤一次,重新离心,得到细胞沉积物,然后进行线粒体膜电位的测定:在得到的细胞沉积物中加入200 μL PBS溶液,吹打使之均匀重悬后移入EP管中,样品用JC-1染料染色后上机测试.
1.2.4 电子扫描电镜(SEM)观察细胞损伤前后诱导草酸钙晶体的形成
调整细胞浓度为1×105cell/mL,每孔1 mL细胞悬浮液接种于底部铺有盖玻片的12孔板中,加入10%新生牛血清的DMEM-F12培养液,置于37 ℃,5% CO2的培养箱中孵育24 h后细胞已基本铺满盖玻片.吸除培养液,改用无血清DMEM-F12培养液孵育12 h,使细胞同步化,然后吸除上清液,用D-Hanks洗涤细胞2次.将孔板上的细胞分为两大组:A组为正常对照组,B组为损伤组.A组加入无血清培养液,B组加入c(H2O2) = 0.3 mmol/L、0.5 mmol/L、1.0 mmol/L、1.5 mmol/L、2.0 mmol/L、3.0 mmol/L的无血清培养液,与细胞各作用1 h.此后吸除所有培养液,用D-Hanks液洗涤细胞2次.再向上述对照组和损伤细胞中分别加入含CaOxa过饱和溶液的无血清培养液,使CaOxa最终浓度为0.5 mmol/L.将12孔板置37 ℃,5% CO2的培养箱中孵育一定时间6 h后,取出盖玻片,用D-Hanks液洗涤细胞2、3次,然后用2.5%的戊二醛在4 ℃条件下固定24 h.固定后的细胞依次用50%、70%、90%、100%的乙醇脱水,再用乙酸异戊酯固定后于CO2临界干燥样品,喷金处理,SEM观测细胞形态和晶体生长情况.
2 结果与讨论
2.1 细胞损伤前后活力的变化
通过测定细胞的活力,表明H2O2对Vero细胞的损伤程度依赖于作用时间和H2O2的浓度,且浓度对细胞的影响大于时间的影响,这也为建立H2O2对Vero细胞的损伤模型奠定了基础.
结果如表1所示.当用c(H2O2) = 0.3 mmol/L的无血清培养液作用于细胞时,随着损伤时间(t)的延长,细胞的活力降低(以正常细胞的生长率作为对照100%).当c(H2O2)分别为0.3 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L,作用时间t=1 h时,随着c(H2O2)增加,细胞活力越来越低.Wiseman 等[9]报道,将肺动脉内皮细胞急性暴露于氧化应激引起锌离子稳态失衡,线粒体功能障碍,激活凋亡.由此可知,本实验结果与此一致,H2O2对细胞作用的时间和浓度都会对细胞造成不同程度的影响.
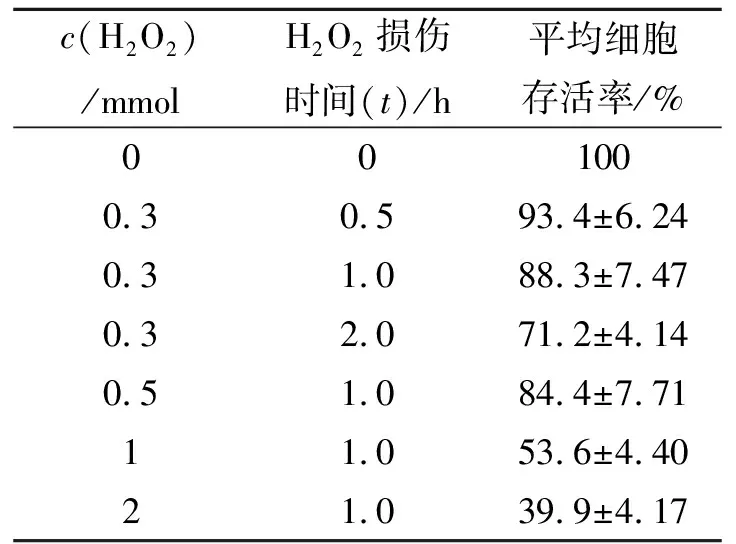
表1 H2O2不同浓度和时间对VERO细胞的存活率的影响
2.2 细胞损伤前后线粒体膜电位的变化
如图1a所示,用浓度为0.3 mmol/L的H2O2损伤细胞不同时间时,在前1 h时,膜电位急速降低;随着时间的延长,降低趋势趋于缓慢,总体是线粒体的膜电位逐渐降低.当用不同浓度的H2O2作用细胞1 h时(图1b),随着H2O2浓度的增加,线粒体膜电位急剧下降.有研究表明,过量H2O2的毒性效应是通过诱发脂质过氧化反应,线粒体膜流动性下降,细胞膜和线粒体膜通透性改变,Ca2+大量流入细胞和线粒体,导致钙超载,激活多种信号转导途径而触发凋亡[10].本实验H2O2损伤细胞后所引起的线粒体膜电位的变化与上述结果一致.
2.3 Vero细胞损伤前后诱导草酸钙晶体的形成的观察
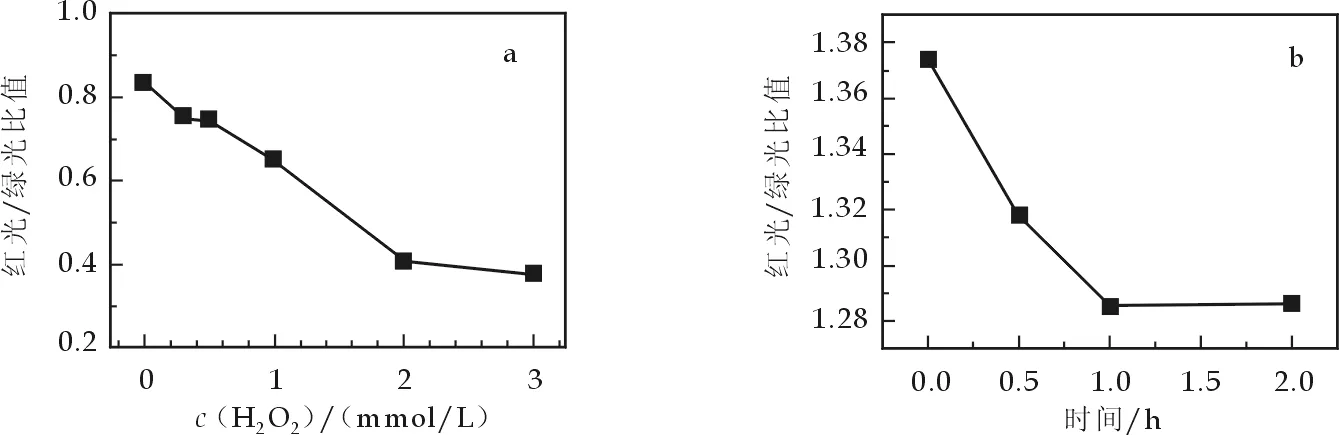
图1 H2O2浓度(a)和作用时间(b)对对Vero线粒体膜电位的影响
如图2所示为正常细胞和不同浓度H2O2损伤的细胞诱导Caoxa晶体的SEM图.正常Vero诱导的CaOxa晶体不仅尺寸小,而且量也很少 (图2a).经H2O2损伤后的细胞,由于损伤程度不同,导致Vero细胞诱导CaOxa晶体的能力也不同,当c(H2O2) = 0.3 mmol/L损伤细胞1 h时,细胞的损伤程度较小,但细胞的形态已经有一些变化,细胞开始变的干瘪,但是并不是太明显,细胞表面所诱导的晶体量相对正常细胞有所增加(图2b).随着c(H2O2)的增加,细胞的损伤程度逐渐加重,细胞逐渐失去了原来的形态,细胞表面粗糙,细胞表面的纤毛脱落,细胞收缩干瘪,细胞之间的紧密连接被破坏,增加了与晶体结合的表面积,且细胞表面结合的晶体量逐渐增多(图2c),当c(H2O2) = 0.5 mmol/L时,有一些细胞已经开始内吞晶体,而随着浓度的增加,有大量晶体已经被细胞完全包被(图2d).当c(H2O2) = 3 mmol/L时,细胞完全失去了形态,细胞表面被晶体所包围(图2e).

图2 不同损伤程度的Vero细胞诱导生成的CaOxa晶体的形貌(c(H2O2): (a) 0 mmol/L; (b) 0.3 mmol/L; (c) 0.5 mmol/L; (d) 1.0 mmol/L; (e) 1.5 mmol/L; (f) 2.0 mmol/L; (g) 3.0 mmol/L.c(CaOxa)=0.5 mmol/L; 结晶时间: 6 h)
对H2O2作用Vero细胞的损伤情况有了一个基本的了解后,我们开始研究其损伤细胞在过饱和的CaOxa溶液中诱导CaOxa晶体的形成情况.因为通过上面一系列的实验,我们发现H2O2的浓度变化对细胞的损伤程度影响较大,所以我们选择了不同浓度H2O2损伤Vero细胞后诱导CaOxa晶体的形成.正常细胞表面的一些分子,如柠檬酸盐、肾钙蛋白等可以抑制草酸钙晶体的粘附[5-13].而许多实验证明,当细胞受损伤后,细胞的微结构发生了变化,细胞会在细胞表面表达大量的带负电荷的物质,如磷酯酰丝氨酸(PS)、透明质酸、骨桥蛋白(OPN)、唾液酸、膜连蛋白II等[14,15],建立了一个负电荷的坏境,诱导CaOxa晶体的成核、生长、聚集或转换[14].
3 结 论
我们采用非洲绿猴肾上皮细胞(Vero)为研究对象, 以H2O2作为诱导损伤因素,研究了其不同时间、不同浓度对Vero细胞损伤机制的变化,建立了Vero细胞的氧化损伤模型,为后面的损伤细胞诱导CaOxa晶体的研究提供了依据.研究结果表明,损伤程度不同的Vero细胞在过饱和的CaOxa溶液中,诱导CaOxa晶体的情况存在差异,细胞损伤程度越严重,就会诱导和内吞越多的CaOxa晶体,这为肾结石的医学研究提供了理论依据.
参考文献
[1] Healy KA, Ogan K. Nonsurgical management of urolithiasis: an overview of expulsive therapy[J]. J Endourol, 2005, 19(7):59-67.
[2] Park S. Medical management of urinary stone disease[J]. Expert Opin Pharmacother, 2007, 8(8):17-25.
[3] Paul K, Pietrow MD, Michael E,etal.. Medical management of common urinary calculi[J]. Am Fam Physician, 2006, 74(1):86-94.
[4] Wahl C, Hes s B. Kidney calculi is nutrition a trigger or treatment[J]. Ther Umsch, 2000, 57(3): 138-145.
[5] Lieske JC, Deganello S. Nucleation, adhesion, and internalization of cacium-containing urinary crystals by renal cells[J]. J. Am. Soc. Nephrol, 1999, 10(14):S422-S429.
[6] Sheng XX, Ward MD, Wesson JA. Crystal surface adhesion explains the pathological activity of calcium oxalate hydrates in kidney stone formation[J]. J. Am.Soc. Nephrol, 2005, 16(7):1 900-1 903.
[7] Rabinovich YI, Esayanur M, Daosukho S,etal.. Adhesion force between calcium oxalate monohydrate crystal and kidney epithelial cells and possible relevance for kidney stone formation[J].J. Colloid Interface Sci,2006,300(1):131-140.
[8] Semangoen T, Sinchaikul S, Chen ST,etal.. Altered proteins in MDCK renal tubular cells in response to calcium oxalate dihydrate crystal adhesion: a proteomics approach[J]. J. Proteome Research,2008,7(7):2 889-2 896.
[9] Wiseman DA, Wells SM, Hubbard M,etal.. Alterations in zinc homeostasis underlie endothelial cell death induced by oxidative stress from acute exposure to hydrogen peroxide[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 292(1): L165-L177.
[10] Trump BF, Berezesky IK. Calcium-mediated cell injury and cell death[J]. FASEB J, 1995, 9(2): 219-228.
[11] Kumar V, Farell G, Lieske JC. Whole urinary proteins coat calcium oxalate monohydrate crystals to greatly decrease their adhesion to renal cells[J].J.Urol,2003,170(1):221-225.
[12] Grover PK, Thurgood LA, Ryall RL. Effect of urine fractionation on attachment of calcium oxalate crystals to renal epithelial cells: implications for studying renal calculogenesis[J].Am. J. Physiol. Renal Physiol,2007,292(5):F1 396-F1 403.
[13] Grover PK, Thurgood LA, Wang TT,etal.. The effects of intracrystalline and surface-bound proteins on the attachment of calcium oxalate monohydrate crystals to renal cells in undiluted human urine[J]. BJU Int,2010,105(5):708-715.
[14] Chutipongtanate S, Thongboonkerd V. Renal tubular cell membranes inhibit growth but promote aggregation of calcium oxalate monohydrate crystals[J]. Chemico-Biological Int,2010,188(3):421-426.
[15] Yasui T, Fujita K, Asai K,etal.. Osteopontin regulates adhesion of calcium oxalate crystals to renal epithelial cells[J]. Int. J. Urol,2002,9(2):100-108.
