人参皂甙对小鼠腹腔巨噬细胞活性的影响及其作用机制初步探讨
2011-02-06顾学文张天一扬州大学临床医学院扬州225001
曹 丽 顾学文 张天一 汪 骅 (扬州大学临床医学院,扬州 225001)
人参皂甙对小鼠腹腔巨噬细胞活性的影响及其作用机制初步探讨
曹 丽 顾学文①张天一②汪 骅 (扬州大学临床医学院,扬州 225001)
目的:观察人参皂甙(GS)对巨噬细胞的免疫激活作用,探讨GS活化巨噬细胞及免疫调节机制。方法:在体外培养的小鼠腹腔巨噬细胞中加入不同浓度的GS后,观察巨噬细胞一氧化氮(NO)合成及MTT比色法检测活化后的巨噬细胞对肿瘤细胞杀伤活性的影响;扫描电子显微镜(SEM)观察巨噬细胞的超微结构改变;激光扫描共聚焦显微镜(LSCM)观察巨噬细胞表面组织相容性复合体Ⅱ(MHCⅡ)的变化;以特异性荧光探针Fluo-3/AM负载细胞,应用LSCM检测巨噬细胞内Ca2+浓度。结果:小鼠腹腔巨噬细胞经GS作用后,细胞形态发生活化性改变,杀瘤活性增强,细胞表面MHCⅡ表达增加并增强对H 22细胞杀伤活性;GS作用细胞4小时后,25~200mg/LGS细胞内Ca2+浓度升高,并与药物浓度呈正相关。结论:GS在体外能激活小鼠巨噬细胞,促进其发挥免疫防御功能,其免疫调节机制可能与细胞内Ca2+浓度升高有关。
人参皂甙;巨噬细胞;一氧化氮;钙
人参皂甙(Ginsenoside,GS)是传统中药人参的主要有效成分之一,对神经、内分泌、免疫、心血管等系统有广泛的生物学活性作用[1]。研究表明,GS可提高机体免疫功能和抗肿瘤能力[2-4],但其作用机制尚待深入研究。本实验观察GS对小鼠腹腔巨噬细胞的活性及肿瘤细胞的影响,探讨GS激活巨噬细胞后发挥杀瘤作用时与细胞内游离Ca2+浓度变化的关系,从细胞分子水平研究GS的免疫调节机制,为GS的临床应用提供理论依据。
1 材料与方法
1.1 实验材料及仪器 一氧化氮检测(酶法)试剂盒(晶美生物工程北京有限公司);四甲基偶氮唑盐(MTT)(Sigma);Fluo-3 acetoxymethyl ester(Fluo-3/AM,Molecular probe);清洁级小鼠(南通大学动物实验中心);H22肝癌细胞株(中国科学院上海药物研究所);GS(南通大学航海医学研究所);激光共聚焦扫描显微镜(TCS-SP2 Leica.Germany);扫描电子显微镜(S-3400N HITACHI.Japan)。
1.2 细胞制备及培养 按文献[5]方法进行细胞制备,将所得细胞用含10%灭活小牛血清的RPM I-1640培养液配成密度为1×106ml-1的细胞悬液,加入培养板进行培养。可用免疫组织化学法,经CD68标记细胞来证实,台盼蓝染色证实活细胞数>95%。
1.3 MTT测定 将收集所得Mφ配成1×106m l-1的细胞悬液接种于96孔培养板,培养24小时后,分别添加GS至所需浓度(终浓度分别为 25、50、100、200mg/L,每个浓度重复3孔,独立重复3次,以不加药物组作为阴性对照),孵育24小时后用完全培养基洗细胞一次,作为效应细胞。取对数生长期H22肝癌细胞为靶细胞,用RPMI1640培养液配成1×105ml-1悬液。按效靶比10∶1接种于96孔培养板。另设单独靶细胞和单独效应细胞组,用酶标仪检测各孔570 nm波长的光密度(OD)值,计算PMφ杀伤活性[6]。
1.4 腹腔巨噬细胞释放一氧化氮量的检测 按一氧化氮试剂盒说明书操作,测定NO释放量。
1.5 SEM观察 PMφ超微结构 收集经100mg/L GS作用 20小时的 PMφ,经浸洗,固定,再浸洗,后固、漂洗、乙醇梯度脱水,样品室干燥,离子溅射镀膜,SEM观察。
1.6 巨噬细胞MHCⅡ表达 将PMφ以1×106m l-1浓度培养2小时后,用D-Hanks液洗去未贴壁细胞,然后分组培养:25、50、100mg/LGS诱导培养的实验组和对照组(不加药物)。20小时后浸洗3次,75%乙醇室温固定30分钟,浸洗3次,5%BSA(牛血清白蛋白)封闭,滴加入生物素-抗小鼠MHC-Ⅱ分子抗体(1∶500稀释),4℃过夜,浸洗3次,滴加入量子点(QDs)-亲和素(Rock land公司)(1∶4)标记的生物素(本室合成)室温下染色 20~30分钟,浸洗3次,无荧光甘油封片剂封片,LSCM观察荧光强度及分布特点。
1.7 细胞内Ca2+浓度的检测 将巨噬细胞接种于96孔培养板培养24小时后,再将对照组(不加药物)、GS 给药组(25、50、100、200 mg/L)培养4小时,用HEPES缓冲液洗3次,加入用HEPES缓冲液稀释的Fluo-3/AM 0.1m l,37℃孵育45分钟,HEPES洗3次,再加入HEPES 0.1 m l,37℃孵育30分钟后置LSCM下观察,各组均以同一参数迅速扫描3个不同的视野,从各视野中随机选取20个细胞,计算60个细胞的平均荧光强度用于统计学分析(荧光强度数据为Leica confocal software软件对扫描图像进行处理所得)。
2 结果
2.1 腹腔巨噬细胞体外杀瘤活性 随GS作用浓度的增加,杀瘤活性不断增强,各浓度组与对照组差异显著(P<0.01),25mg/L组与50mg/L之间差异无显著(P>0.05),其余各浓度组之间差异显著(P<0.05),见表 1。
2.2 腹腔巨噬细胞一氧化氮释放量 随GS作用浓度的增加,NO释放量依次增加,各浓度组与对照组差异显著(P<0.01),各浓度组之间差异均显著(P<0.05),见表1。
2.3 SEM观察巨噬细胞超微结构
2.3.1 对照组 PMφ细胞呈圆形,形态规则,表面突起少(图1A)。
2.3.2 GS(100 mg/L)诱导组 PMφ呈不规则形,细胞表面布满不规则微绒毛,还有一些较长的伪足,向四周伸出(图1B)。
2.4 腹腔巨噬细胞MHCⅡ的表达
2.4.1 PMφ的MHCⅡ阳性表达率的变化 对照组PMφ的MHCⅡ阳性表达率为(18.60±3.16)%,GS不同浓度(25、50和100mg/L)PMφ的MHCⅡ阳性表达率分别为(35.74±1.73)%、(48.63±1.05)%和(65.45±3.42)%,随GS作用浓度的升高,PMφ的MHCⅡ阳性表达率逐渐升高,与对照组存在显著差异(P<0.01),各组间相比差异有统计学意义(P<0.05)。
表1 腹腔巨噬细胞杀伤活性及一氧化氮释放量(±s,n=3)Tab.1 Release of of NO and killer activity of PMφ(±s,n=3)

表1 腹腔巨噬细胞杀伤活性及一氧化氮释放量(±s,n=3)Tab.1 Release of of NO and killer activity of PMφ(±s,n=3)
Note:Compared with controlgroup,1)P<0.01.
GS concentration(mg/L)Kill probability(%)Release ofofNO(mol/L)24.60±5.06 335.60±5.68 25 38.86±1.561) 416.10±7.211)50 42.19±2.791) 448.20±2.351)100 68.55±4.411) 510.11±11.301)200 79.62±5.951) 578.10±6.201)0
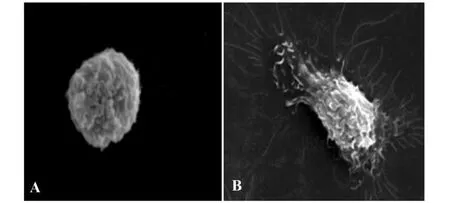
图1 SEM下观察GS诱导的PMφ超微结构Fig.1 The observation of ultram icrostructure changes of PMφ by SEM

图2 PMφMHCⅡ分子表达强度及分布Fig.2 The expression of cell surface MHCⅡ

表2 巨噬细胞内Ca2+荧光强度Tab.2 The fluorescence intensity of intercellular calcium in PMφ

图3 巨噬细胞内钙离子荧光强度Fig.3 The fluorescence intensity of intercellular calcium in PMφ
2.4.2 PMφ的MHCⅡ表达强度及分布变化 经480 nm波长激发,量子点标记的MHCⅡ分子发绿色荧光,对照组PMφ上MHCⅡ分子荧光多呈点状、颗粒状零星分布于细胞膜和胞质,荧光强度弱(图2A);经50mg/LGS诱导的PMφ上MHCⅡ分子荧光以较大颗粒样,呈串珠状沿胞膜排列,有的呈块状分布于胞膜和胞质(图 2B);经100mg/L GS诱导的PMφ上MHCⅡ分子呈强荧光物质沿包膜均匀、连续地环状分布,并向胞质内均匀延伸,甚至覆盖整个细胞(图2C)。
2.5 细胞内Ca2+浓度的检测 LSCM观察结果可见随着GS浓度升高,细胞的荧光强度增强。结果见表2、图3。25mg/L组增加不明显,与对照组差异无统计学意义(P>0.05),其余GS组与对照组差异显著(P<0.01)。
3 讨论
GS是人参诸多组份中主要的有效成分。人参对免疫系统的影响已有许多研究,但有关GS对巨噬细胞的影响所知甚少。巨噬细胞是机体中分布广泛并具有十分活跃的生物学功能的细胞,在启动及协调免疫应答等方面有着重要作用[7]。本实验证实在体外GS对小鼠PMφ有直接激活作用,激活的PMφ细胞毒作用增强。经GS刺激20小时的PMφ,对H22肿瘤细胞的细胞毒作用明显增强,从50、100到200 mg/L组杀伤活性呈缓慢上升趋势,到200 mg/L组杀瘤率达79.62%。本实验还发现,经GS作用的PMφ,NO分泌水平增加呈剂量依赖性。NO是一种高活性和不稳定的自由基,是活化的PMφ杀灭肿瘤细胞及病原微生物的主要效应分子之一。实验结果提示GS增强PMφ细胞毒作用可能与NO有关。
巨噬细胞激活后,诱导表面受体表达,促进杀伤靶细胞,同时活化巨噬细胞分泌的TNF能诱导靶细胞发生凋亡[8]。本研究以GS(100mg/L)刺激巨噬细胞20小时后,扫描电镜观察超微结构发现经GS处理的巨噬细胞与对照组细胞相比,细胞处于极度活跃状态:细胞呈不规则形,表面布满不规则微绒毛,还有一些较长的伪足,向四周伸出,进一步说明GS对巨噬细胞有激活作用。
MHCⅡ类抗原是巨噬细胞发挥抗原递呈作用的关键性效应分子,巨噬细胞表达MHCⅡ类抗原受多种外来信号的调节,只有活化的巨噬细胞才表达MHCⅡ类抗原,具备抗原递呈功能[9]。本研究发现经GS处理后小鼠PMφ的MHCⅡ的表达增强,此结果与抗原递呈分子MHCⅡ在未激活的抗原递呈细胞上固有低表达,与激活后高表达的既往研究报道相符[10]。结果表明,GS能增强PMφ抗原递呈能力,与GS的抗肿瘤作用和调节机体的免疫功能密切相关。
以上实验结果表明,体外培养的小鼠PMφ经GS作用后,细胞毒作用增强,NO分泌水平增加,MHC-Ⅱ的表达增强。Kim等[11]研究表明,脂多糖诱导PMφ表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)mRNA的表达,并诱导PMφNO的产生与细胞内游离Ca2+浓度有关。因此,我们推测GS诱导巨噬细胞活化也可能与Ca2+浓度有关。本研究发现GS能激活PMφ而起到免疫增强、杀瘤灭菌的作用;同时用LSCM观察发现受GS诱导后的PMφ内Ca2+浓度显著增加,且呈剂量依赖性。细胞内游离Ca2+浓度的变化是细胞生理功能的重要物质基础,胞内游离Ca2+水平的调节是信号转导过程中的关键环节。GS的作用机制可能是通过增加Mφ内Ca2+浓度的途径影响细胞的信息转导,从而激活巨噬细胞,发挥其免疫调节的作用。
1 王卫霞,王 谦.人参皂苷的免疫调节作用及其应用[J].中华中医药杂志,2005;(4):42-44.
2 Kong X,Hu Y,Rui Retal.Effects of Chinese herbalmedicinal ingredientson peripheral lymphocyte proliferation and serum antibody titer after vaccination in chicken[J].International Immunopharmacology,2004;4(7):975-982.
3 Lee E J,Ko E,Lee Jetal.Ginsenoside Rg1 enhances CD4(+)T-cell activities and modulates Th1/Th2 differentiation[J].International Immunopharmacology,2004;4(2):235-244.
4 魏翠柏,贾建平,王 芬etal.人参皂苷Rg1及 Rb1对Aβ25-35诱导CHO细胞毒性影响[J].中华中医药杂志,2008;23(7):58-60.
5 Yamamoto Y,K lein TW,TomiokaMetal.Differential effectsof granulocyte/macrophage colony-stimulating factor(GM-CSF)in enhancing macrophage resistance to Legionella pneumophila vs Candida albicans[J].Cellular Immunology,1997;176(1):75-81.
6 李淑艳,杨秀珍,杨凤坤.MTT法检测CIK细胞的体外杀瘤活性[J].齐齐哈尔医学院学报,2003;24(1):3-4.
7 Melendez A J,Ibrahim F B.Antisense knockdown of sphingosine kinase 1 in human macrophages inhibits C5a receptor-dependent signal transduction,Ca2+signals,enzyme release,cytokine production,and chemotaxis[J].JImmunol,2004;173(3):1596-1603.
8 Allenbach C,Zufferey C,Perez Cetal.Tacchini-Cottier F.Macrophages induce neutrophilapoptosis throughmembrane TNF,a processamplified by Leishmaniamajor[J].J Immunol,2006;176(11):6656-6664.
9 孙泉红,彭 景.MHC-Ⅱ类分子表达调控的研究进展[J].生理科学进展,2004;35(1):25-28.
10 龚非力.医学免疫学[M].第2版.北京:科学出版社,2005:193-196.
11 K im Y,Moon JS,Lee K Setal.Ca2+/calmodulin-dependent protein phosphatase calcineurinmediates the expression of iNOS through IKK and NF-kappaB activity in LPS-stimulatedmouse peritonealmacrophagesand RAW 264.7 cells[J].Biochemical and Biophysical Research Communications,2004;314(3):695-703.
[收稿2010-12-04 修回2011-02-14]
(编辑 许四平)
Effects of ginsenoside on activity ofm ice peritokinealmacrophage and initial study on mechanism of its function
CAOLi,GUXue-Wen,ZHANGTian-Yi,WANGHua.ClinicalMedicalCollegeofYangzhouUniversity,Yangzhou225001,China
Objective:To study effects of Ginsenoside on activity ofmacrophage in vitro and further investigate themechanism of Ginsenoside onmaorophage activation and immunomodulation.Methods:By adding different concentrations of GS into cultured mice peritoneal macrophage in vitro,the influenceofGSon the synthesis ofnitrooxide(NO)and killer activity of tumorcellswereobserved.Themorphological changes ofmacrophagewere viewed by Scan Electron Microscope.The exp ression of cell surface MHC-Ⅱwas measured by Laser Scanning ConfocalMicroscope(LSCM).The cellwas loaded with specificity fluorescent probe Fluo-3/AM.The intercellular calcium concentration and changesweremeasured by LSCM.Results:GS significantly increased NO synthesis,enhanced the effects ofmouse peritonealmacrophages on killing carcinoma cells and MHC-Ⅱ molecule expression were found to be increased.With 25-200mg·L-1GS exposure for 4 h,intercellular calcium concentration was increased,and revealed a positive correlation between the increaseofCa2+and the concentrationofGS.Conclusion:GS can activatemice peritonealmacrophage in vitro,and contribute to its immunomodulatory function.Themechanism of immunomodulatory effectmay be related to the increaseof intracellular Ca2+inmicemacrophage.
Ginsenoside;Peritonealmacrophage;Nitro oxide;Ca2+
R392.12
A
1000-484X(2011)05-0423-04
10.3969/j.issn.1000-484X.2011.05.009
①通讯作者,E-mail:yzgxw@yahoo.com.cn
②南通大学神经再生重点实验室,南通226001
曹 丽(1978年-),女,硕士,住院医师,主要从事免疫和肿瘤病理研究。
·神经内分泌与免疫·