pTAT-XIAP融合蛋白表达载体的构建及其在大肠杆菌中的表达
2011-02-02张晓红夏春波刘源劼蒋常文
张晓红,夏春波,刘源劼,蒋常文,门 楠
(桂林医学院人体解剖学教研室,广西桂林541004)
X连锁凋亡抑制蛋白(XIAP)是IAP家族中最有效的Caspase抑制剂[1],可直接抑制Ccaspase并可多途径调节细胞凋亡[2],与肿瘤的发生、发展及预后有密切关系。但XIAP是大分子物质,难以通过血脑屏障而限制了其临床应用[3]。研究显示人类免疫缺陷病毒—反式转录激活因子(TAT)蛋白的转导域(PTD)是TAT蛋白的碱性氨基酸区[4,5],是转导功能较强而确切的一种PTD。以TAT连接构成融合蛋白,在体内、外已成功使胶质细胞源性神经营养因子等生物大分子跨越血脑屏障至脑内[6]。2010年4~9月,我们将大鼠 XIAP基因克隆至pTAT-HA质粒载体,构建了pTAT-XIAP融合蛋白表达载体,旨在为其用于临床神经系统疾病的治疗奠定基础。
1 材料与方法
1.1 材料 质粒及菌株:pTAT-HA质粒(美国Steven F Dowdy惠赠),BL21plysS感受态细胞(TI ANGEN公司)。主要试剂:UNIQ-10柱式质粒小量抽提试剂盒(Sangon公司),DNA Marker(MBI公司),考马斯亮蓝蛋白测定试剂盒(南京建成科技有限公司),蛋白Marker(Fermentas公司),IPTG、考马斯亮蓝R250染色液、尿素、咪唑(Amresco公司),氨苄青霉素。
1.2 实验方法
1.2.1 XIAP基因合成 根据大鼠XIAP的cDNA序列由上海生工公司合成基因,两端带有Nco I和Xho I酶切位点。
1.2.2 pTAT-XIAP融合蛋白表达载体构建 用Nco I和Xho I酶对pTAT-HA质粒进行双酶切,将XIAP基因插入Nco I和Xho I酶切位点,构建pTAT XIAP融合蛋白表达载体。取50 μl BL21plysS感受态细胞于冰水浴,加入5 μl pTAT-XIAP质粒DNA,冰浴静置30 min,将离心管置于42℃水浴90 s,冰浴冷却3 min,向离心管中加入450 μl LB液体培养基(不含抗生素),37℃摇床震荡培养45 min。取转化菌液加到LB固体培养基(含氨苄青霉素),37℃培养12~16 h。以未转化菌和转化pTAT-HA空载体的菌株作为对照。
1.2.3 pTAT-XIAP质粒扩增及鉴定 挑取pTATXIAP质粒阳性菌落接种至LB液体培养基培养过夜,以UNIQ-10柱式质粒小量抽提试剂盒说明书操作,获取质粒DNA,1%琼脂糖凝胶上电泳,凝胶成像系统检测。质粒于-80℃保存备用。
1.2.4 pTAT-XIAP融合蛋白在大肠杆菌中的诱导表达及可溶性分析 将阳性克隆菌落接种于含氨苄青霉素的LB固体培养基中,37℃过夜培养,挑取转化的阳性菌落置于3 ml含氨苄青霉素100 mg/L的LB培养液中,37℃摇床培养过夜,取活化的大肠杆菌(pTAT-XIAPBL21plysS)菌液接种于 10 ml LB (Amp 100 mg/L)培养液中,当OD600达0.8~1时,IPTG 30℃诱导表达4 h。离心收集诱导菌,PBS洗涤2次,用菌裂解液[含0.5 mol/L的NaCl、0.02 mol/L的Tris-HCI(pH7.9)、0.01 mol/L的咪唑]重悬菌体,4℃静置30 min,冰浴下超声破菌,4℃、12 000 r/min离心10 min,留取总蛋白、上清进行电泳分析,沉淀部分分别用2 M和4 M尿素洗涤,8 M尿素溶解包涵体于4℃过夜。将总蛋白、上清和包涵体蛋白及空质粒转化菌,加入1×SDS凝胶加样缓冲液100℃煮沸10 min,沉淀4℃离心1 min取上清加样,用12%聚丙烯酰胺凝胶进行SDS-PAGE电泳,将凝胶浸泡于考马斯亮蓝R250染色2 h,脱色液脱色至背景清晰为止。照相,确定融合蛋白的表达情况。
1.2.5 重组pTAT-XIAP融合蛋白鉴定 各取20 μl蛋白样品100℃加热10 min,行12%SDS-PAGE,电泳结束后电转移到硝酸纤维素膜上进行Western blot分析:5%脱脂奶粉封闭1 h,加入小鼠抗6×His单克隆抗体作用3 h,TBS洗涤3×10 min,再用HRP标记的山羊抗小鼠IgG抗体孵育1 h,洗膜后用ECL发光试剂显色,X线曝光显影。
2 结果
2.1 载体琼脂糖凝胶电泳结果 pTAT-XIAP质粒约4 500 bp,pTAT-HA质粒约3 000 bp,条带大小与质粒图谱一致。pTAT-XIAP经 NcoI/XhoI酶切鉴定,在Marker 3 000 bp可见载体pTAT-HA的条带,在Marker1 500 bp可见XIAP的条带,与预期结果相符。
2.2 融合蛋白表达形式鉴定 SDS-PAGE显示pTAT-XIAP在约64 kD有一明显的蛋白条带出现,与理论值相符。pTAT-XIAP主要以包涵体的形式存在,进一步优化诱导条件,经调整诱导温度及IPTG浓度、诱导时间等,pTAT-XIAP仍主要以包涵体的形式存在。见图1。
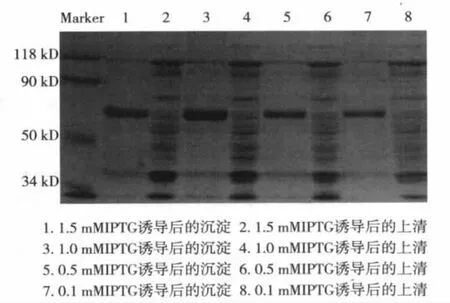
图1 不同浓度IPTG 37℃诱导4 h的SOS-PAGE分析
2.3 重组pTAT-XIAP融合蛋白鉴定 取诱导后上清和沉淀、未诱导菌体及空载体蛋白进行 SDSPAGE,然后电转移到NC膜上,用小鼠抗6×His单克隆抗体作为一抗,HRP标记的山羊抗小鼠IgG作为二抗,显影后于约64 kD处可见一清晰条带,与预期结果相符。
3 讨论
影响E.coil蛋白表达量的因素除载体启动子结构外,表达菌对密码子的偏好性、表达产物对宿主菌毒性作用而引起质粒的不稳定等均是导致原核表达失败的原因[7,8]。本研究质粒构建及转化菌的选择时已排除以上因素的影响,目的融合蛋白主要以包涵体的形式存在。
人类Ⅰ型免疫缺陷病毒(HIV-1)的转录反式激活因子(Tat)能够主动穿过细胞膜进入细胞内部。研究表明,TAT蛋白转导域能够将与之共价连接的生物大分子(如核酸、多肽、蛋白质等)非特异地转导入细胞内部,这种过程既不依赖于受体和转运蛋白,也与温度和能量无关[9],且对宿主细胞几乎没有毒性,显示出巨大的应用价值。TAT蛋白转导域具有以下优点:①操作简单,转导效率高。②转导的蛋白质在细胞中均具有生物活性,并能够穿过血脑屏障,因此对心脑血管疾病的治疗具有重要意义[10]。③作用迅速,可进入所有细胞,对细胞的损害相对较小。TAT蛋白转导域目前已成功将相对分子质量在15~120 kD的不同蛋白导入细胞,且均具有生物活性,并能够穿过血脑屏障[11]。另有研究显示XIAP具有强大的抗凋亡作用,有望用于治疗神经退行性疾病、脑缺血等神经系统疾病。
本研究构建了pTAT-XIAP原核表达载体并成功表达出目的融合蛋白,为研究该蛋白的体内生物活性奠定了基础;pTAT-XIAP原核表达载体有望为治疗神经退行性疾病开辟新途径。
[1]Holcik M,Korneluk RG.XIAP,the guardian angel[J].Nat Rev Mol Cell Bio,2001,2(7):550-556.
[2]Devereaux QL,Takahashi R,Salvesen GS,et al.X-linked IAP is a direct inhibitor of cell-death proteases[J].Nature,1997,388 (6639):300-304.
[3]蒋常文,夏春波,徐雅娟,等.pTAT-XIAP融合蛋白表达载体的构建[J].医学研究杂志,2009,38(4):65-66.
[4]Kerkis A,Hayashi MA,Yamane T,et al.Properties of cell penetrating peptides(CPPs)[J].IUBMB Life,2006,58(1):7-13.
[5]Mae,Langel U.Cell-penetrating peptides as vector for peptide,protein and oilgonucleotide delivery[J].Curr Opin Phamacol,2006,6 (5):509-514.
[6]Kilic U,Kilic E,Dietz G,et al.Intravenous TAT-GDNF Is Protective After Focal Cerebral Ischemia in Mice[J].Stroke,2003,34 (5):1304-1310.
[7]樊永锋,吕传真,赵延欣,等.融合蛋白PTD-XIAP的原核表达、纯化及其血脑屏障穿透功能的初步鉴定[J].中国临床神经科学,2003,11(4):397-399.
[8]Boon P,Vandekerckhove T,Achten E,et al.Epilepsy surgery in Belgium,the experience in Gent[J].Acta Neurol Belg,1999,99(4): 256-265.
[9]王海珍,许予明,陈奎生,等.反式激活蛋白转导结构域介导绿色荧光蛋白在小鼠体内的跨膜转运[J].中国现代医学杂志,2007,17(10):1161-1163.
[10]Dietz GP,Bahr M.Delivery of bioactive molecules into the cell: the Trojan horse approach[J].Mol Cell Neurosci,2004,27(2): 85-131.
[11]秦成峰,秦鄂德.TAT蛋白转导域:蛋白质治疗的新曙光[J].中国生物化学与分子生物学报,2007,23(7):519-524.
