油菜花粉脂溶性提取物对前列腺癌细胞生长抑制的实验研究
2011-01-31朱赤红杜灵彬钱丽娟顾琳慧浙江省肿瘤医院肿瘤研究所杭州310222曹明富杭州师范大学生命与环境科学学院
朱赤红 杜灵彬 高 赟 钱丽娟 顾琳慧 浙江省肿瘤医院肿瘤研究所 杭州 310222曹明富 杭州师范大学生命与环境科学学院
油菜花粉脂溶性提取物对前列腺癌细胞生长抑制的实验研究
朱赤红 杜灵彬 高 赟 钱丽娟 顾琳慧 浙江省肿瘤医院肿瘤研究所 杭州 310222曹明富 杭州师范大学生命与环境科学学院
目的:研究油菜花粉脂溶性提取物(BPE)对体外培养的人前列腺癌细胞的杀伤效应。方法:以人前列腺癌细胞PC-3和DU-145为研究对象,光镜观察用药前后细胞形态,透射电镜观察细胞凋亡的形态变化;CCK-8法测定油菜花粉脂溶性提取物对细胞生长抑制率,流式细胞术检测BPE对PC-3和DU-145细胞周期的影响。结果:不同浓度油菜花粉脂溶性提取物(BPE)对两株前列腺癌细胞有明显的抑制作用;形态学观察BPE处理后的前列腺癌细胞出现显著改变;流式细胞仪检测结果显示:PC-3及DU-145细胞在油菜花粉脂溶性提取物处理48h后,细胞周期出现变化,G0/G1期比例上升,S期和G2-M期比例下降。结论:油菜花粉脂溶性提取物对两株前列腺癌细胞的生长有明显的抑制作用。
油菜花粉脂溶性提取物 人前列腺癌细胞 生长抑制 肿瘤
研究表明,花粉及其组分具有抗肿瘤、抗氧化性、治疗前列腺疾病、降血脂及增强机体免疫能力等多种生理功能。本研究选用纯度较高的油菜花脂溶性提取物,作用于两株人激素非依赖性前列腺癌细胞,观察其对前列腺癌细胞的抑制效应和形态学变化,为后续进一步实验研究打下基础。
1 实验材料
1.1 细胞株 非激素依赖型前列腺癌细胞PC-3和DU-145(中国科学院上海细胞所)。
1.2 药 物 花粉脂溶性提取物(Brassica campestris pollen extract,BPE)(浙江康恩贝制药公司提供);F-12培养基(Gibco公司);新生小牛血清(杭州四季青生物工程材料有限公司);碘化丙啶(PI)(Sigma公司);CCK-8试剂盒(株式会社同仁化学研究所DOJI NDO);DNA REAGENT KIT试剂盒(美国BD公司)。
1.3 主要仪器 CO2培养箱(德国HERAEUS B5060EU公司);流式细胞仪FAC SCailibur(美国BD公司);万能倒置显微镜OLYMPUS JMT-2和H-600型电子显微镜(日本OLYMPUS);全波长酶标仪MSS(美国Thermo公司)。
2 实验方法
2.1 细胞培养 人前列腺癌细胞PC-3和DU-145用F-12培养基培养,内含15%新生小牛血清,100U/mL青霉素、100U/mL链霉素、10μg/mL氢化考的松以及0.01U/mL胰岛素。置于37℃、5%CO2培养箱中培养。实验时选用对数生长期细胞。
2.2 药物配制方法 临用时称取油菜花粉脂溶性提取物(030401 AA08)适量,DMSO助溶,DMSO最高浓度为0.08%。再用F-12培养液稀释成不同浓度药液组。
2.3 BPE对PC-3和DU-145细胞增殖抑制作用的影响 实验采用CCK-8的方法,取对数生长期的PC-3和DU-145细胞,制成1×105/mL的细胞悬液,以每孔100μL细胞悬液接种于96孔板上,约1×104/孔,另外每孔加100μL新鲜F-12培养液,总量200μL/孔。每个浓度组设5个复孔。置于37℃、含5%CO2的培养箱中培养24h后,按组别换入不同浓度的药液,最高浓度为4000μg/mL,以2倍浓度稀释,共8个浓度梯度。对照组换入等体积F-12培养液。待药物作用48h后,加入CCK-8 10μL/孔,37℃培养箱孵育3h后,在酶联免疫测定仪上检测吸光度(OD值),采用双波长测定,检测波长450nm,参比波长630nm。实验重复3次,取平均值。抑制率(IR)按下列公式计算:细胞增殖抑制率(IR)=(阴性对照组平均OD值-处理组平均OD值)/阴性对照组平均OD值×100%。
2.4 光镜和透射电镜观察细胞形态 PC-3和DU-145细胞前期处理同前。1000μg/mL药物作用48h后,取对照和实验组细胞的培养瓶,显微镜下观察并摄影。药物作用后收集,2.5%戊二醛固定、1%锇酸固定、丙酮梯度脱水、环氧树脂浸透、包埋、超薄切片、以铀、铅双重染色法染色,在H-600型电子显微镜下观察形态并摄影。
2.5 流式检测 取BPE刺激过的PC-3和DU-145细胞进行标本处理,调整细胞数为1×106/ml的单细胞悬液。800rpm/min离心5min,去上清后加PBS 2mL,混匀离心洗涤2次,弃上清,边震荡边滴入70%乙醇固定,再离心去上清后,按DNA REAGENT KIT试剂盒操作说明进行后续实验。流式细胞仪采集窗内10 000个细胞,用Modfit LT 2.0软件分析细胞周期。
3 实验结果
3.1 不同浓度BPE对前列腺癌细胞抑制率的影响随着BPE浓度的升高,细胞的抑制率(IR)皆呈上升趋势,在一定浓度范围内(0~1000μg/mL)随着BPE浓度的增大,细胞的抑制率越高(F=22.33~197.32,P均<0.01)。在BPE浓度为1000μg/mL时,PC-3、DU-145细胞的抑制率均达到最高,分别为74.19%、72.77%。但当浓度继续升高时,前列腺癌细胞的抑制率反而下降。抑制率下降的程度随肿瘤细胞株的不同而不同,在BPE浓度为4000μg/mL时,PC-3及DU-145细胞的抑制率分别下降至28.95%和38.47%。不同浓度的BPE处理对肿瘤细胞的抑制率的影响结果表明,两株前列腺癌细胞对BPE的敏感性略有不同,PC-3和DU-145细胞的半数抑制浓度(IC50)分别为386μ g/mL和545μg/mL,见图1。
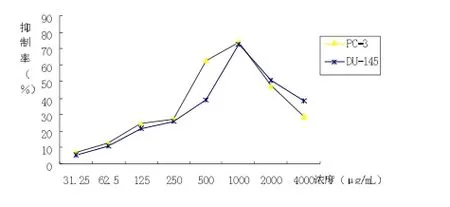
图1 不同浓度油菜花粉提取物作用48h后前列腺癌细胞的抑制率
3.2 药物作用后的前列腺癌细胞形态学观察 PC-3与DU-145细胞的对照组细胞细胞增殖旺盛,排列紧密,边界清楚,有的细胞重叠生长,折光度好,胞质饱满;实验组细胞与对照组相比,由于浓度的作用,细胞数量锐减,细胞排列稀疏、胞膜有破损现象,胞浆内有空泡变性,见图2~5。
PC-3对照组细胞膜完整,细胞胞浆中有丰富的细胞器,细胞膜表面伪足、微绒毛结构丰富,核膜完整;经1000μg/mL浓度BPE作用48h的PC-3细胞可见线粒体肿胀变性,线粒体嵴消失,核结构破坏,细胞表面微绒毛减少,部分脱落。DU-145对照组细胞膜完整,细胞核大,染色质丰富。DU-145经1000μg/mL浓度 BPE作用48h后可见胞膜破,胞浆流失,未见明显的细胞器,见图6~9。

图2 PC-3对照组(×100)

图3 PC-3实验组48h(×200)

图4 DU-145对照组(×100)

图5 DU-145实验组48h(×200)
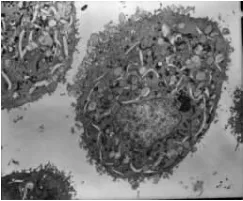
图6 PC-3对照组
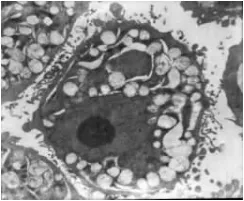
图7 PC-3实验组48h
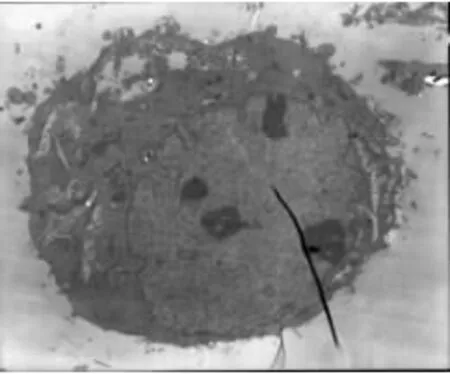
图8 DU145对照组
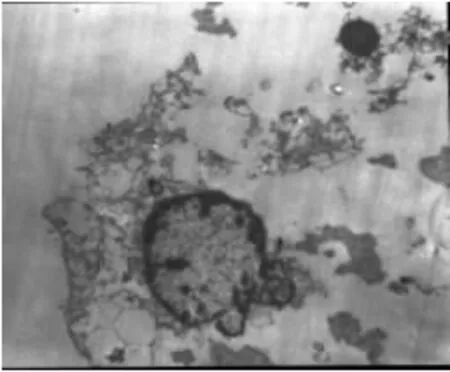
图9 DU-145实验组48h
3.3 BPE对PC-3、DU-145细胞周期的影响 PC-3及DU-145细胞在油菜花粉提取物(浓度为1000ug/mL)处理48h后,G0/G1期比例上升,分别为67.33%和68.15%。S期、G2-M期比例下降,PC-3分别下降16.66%和16.01%,DU-145分别下降21.22%和10.63%。油菜花提取物可能通过调控各肿瘤周期来发挥其对各肿瘤细胞的生长抑制作用,其可通过阻止前列腺癌细胞在G0/G1期,抑制细胞增殖。
4 讨 论
高增殖性是恶性肿瘤的重要生物学特性之一,也是临床肿瘤患者死亡的主要原因。目前,对肿瘤生长抑制的研究已经成为肿瘤治疗学研究的主要内容[1]。非激素依赖性前列腺癌(hormone refractory prostate cancer,HRPC)是前列腺癌发展的最后阶段,除少数局限于前列腺包膜内的早期前列腺癌患者可行根治性前列腺切除术外,患者往往死于激素非依赖性细胞的增殖扩散[2]。
本实验应用CCK-8法检测BPE对PC-3和DU-145细胞增殖的抑制作用。CCK-8是一种新型的活细胞计数试剂,可用于简便而准确的细胞增殖和毒性分析,与MTT等其它四唑盐相比具有操作简便、灵敏度高、可重复性好等优点,已经开始被广泛应用[3]。研究结果表明,在一定范围内随着BPE浓度的增加,其对PC-3和DU-145细胞增殖的抑制作用越明显,呈典型的剂量依赖性,PC-3和DU-145细胞的半数抑制浓度(IC50)分别为386μg/mL和545μg/mL,当浓度继续升高时,对前列腺癌细胞的抑制率反而下降,具体的原因和机制,需进一步实验和探讨其原因和机制。
实验结果证实,BPE对前列腺癌PC-3和DU-145细胞有明显杀伤作用,电镜摄片中可见BPE作用细胞后,线粒体肿胀变性,线粒体嵴消失,提示线粒体可能是BPE作用的靶细胞器之一。线粒体为细胞各种生命活动提供能量,线粒体参与细胞凋亡,在细胞凋亡过程中关键作用的Bcl-2家族蛋白分布在线粒体外膜,核膜和内质网膜上,该家族成员通过操控线粒体膜间隙蛋白的释放对细胞凋亡加以调控。BPE是否通过Bcl-2/Bax蛋白通路来调控细胞凋亡,抑制肿瘤细胞增殖有待进一步研究证实。
流式细胞仪检测结果显示,BPE作用后两株前列腺癌细胞大多被阻滞在G0/G1期,这说明BPE主要作用在DNA合成前期,为BPE与其他细胞周期特异性化疗药物联合使用提供了理论依据,这一结果与石柱等[4]研究天花粉蛋白对小鼠前列腺癌细胞RM21的实验结果类似。细胞周期调控异常是细胞癌变的重要机制之一,通过药物对细胞周期干预或调控使肿瘤细胞周期停滞,避免肿瘤细胞进入有丝分裂期,从而可阻抑其进一步增殖,这也是治疗肿瘤的有效手段之一。对BPE具体抗肿瘤机制及其安全有效地给药方式深入研究,将为应用于临床治疗前列腺癌提供更多理论和实验依据。
[1]耿国军,姜杰,杜好信,等.苦参碱对肺腺癌细胞生长抑制的实验研究[J]. 浙江中西医结合杂志,2009,19(4)207-208.
[2]李涛,李世文,郑新民, 等. 白藜芦醇对人激素非依赖性前列腺癌PC-3 Survivin蛋白表达的影响[J].武汉大学学报(医学版),2009,(3):337-340.
[3]Hsieh JL, Wu CL, Lee CH, et al. Hepatitis B virus X protein sensitizes hepatocellular carcinoma cells to cytolysis induced by E1B - deleted adenovirus through the disruption of p53 function[J]. Clin Cancer Res, 2003, 9 (1) : 338 - 345.
[4]石柱,单圣道,袁涛,等.天花粉蛋白诱导小鼠前列腺癌细胞RM-1凋亡的实验研究[J].中药材,2009,32(2):239-242.
Suppression Effect of Brassica Campestris Pollen Extract on the Growth of Prostate Cancer Cell in vitro
ZHUChihong,DULingbin,GAOYun,et al.Cancer Research Institute,Zhejiang Cancer Hospital,Hangzhou(310003),China
Objective:To study the effects ofBrassica campestris pollen extract(BPE)on prostate cancer cell line in vitro. Methods:PC-3 and DU-145 cell line from prostate cancer were treated with various concentrations of BPE.Morphologic change was observed with light microscope and apoptosis change by electron microscope.The suppression rate of the growth of prostate cancer cell was evaluated by using CCK-8 assay.Changes in prostate cancer cell cycle were observed by FAC SCailibur.Result:The growth of prostate cancer cells were markedly inhibited after being treated with BPE.After the treatment,obvious morphological change was observed;FCMshowed that the rate ofG0/G1 phase was increased and that the rate of S and G2-Mphase was decreased in the cell cycle.ConclusionBPE may have remarkable effect on inhibitingthe growth ofPC-3 and DU-145 cell line fromprostate cancer.
Brassica campestris pollen extract prostate cancer cell line growth suppression anti-tumo
浙江省科技攻关计划项目(No.2005C33005)
曹明富E-mail:mfcao@hztc.edu.cn
2010-08-04
