和厚朴酚抑制内毒素诱导的人肾小球系膜细胞炎症因子表达的研究
2011-01-31王叶萍李学琴浙江省长兴县人民医院检验科长兴313100
王叶萍 李学琴 浙江省长兴县人民医院检验科 长兴 313100
吴志刚 程林芳 姚航平 浙江大学医学院附属第一医院传染病诊治国家重点实验室
和厚朴酚抑制内毒素诱导的人肾小球系膜细胞炎症因子表达的研究
王叶萍 李学琴 浙江省长兴县人民医院检验科 长兴 313100
吴志刚 程林芳 姚航平 浙江大学医学院附属第一医院传染病诊治国家重点实验室
目的:观察和厚朴酚(HNK)对内毒素(LPS)诱导人肾小球系膜细胞(HRMCs)炎症反应的抑制作用及其分子机制研究。方法:以MTS法检测和厚朴酚(0~160μmol/L)对人肾小球系膜细胞的毒性作用,确定合适的药物实验浓度。将系膜细胞与LPS(1μg/ml)及不同浓度的和厚朴酚(0~20μmol/L)共同培养24h后收集培养上清液和细胞,并提取细胞蛋白。ELISA法检测各组培养上清液中IL-1β、TNF-α、IL-18及TGF-β1的表达水平,免疫印迹Western blot法检测细胞NF-κB p65,IKK-α/β及IKB-α磷酸化、非磷酸化蛋白表达水平,探讨和厚朴酚的抗炎作用机制。结果:20μmol/L及以下的和厚朴酚浓度对系膜细胞无明显毒性作用,但40μmol/L及以上的浓度明显降低系膜细胞的增殖活力。LPS刺激可显著诱导系膜细胞炎症因子IL-1β、TNF-α、IL-18及TGF-β1的产生。和厚朴酚(0~20μmol/L)剂量依赖性地抑制LPS诱导的炎症因子的表达。免疫印迹结果显示,和厚朴酚可显著抑制LPS诱导的系膜细胞NF-κB p65,IKK-α/β及IKB-α等信号分子蛋白磷酸化水平。结论:和厚朴酚能有效抑制LPS诱导的人肾小球系膜细胞炎性细胞因子的表达,其机制部分通过抑制细胞NF-κB p65、IKK-α/β及IKB-α等信号分子的磷酸化水平。
人肾小球系膜细胞 和厚朴酚 炎症因子
肾小球系膜细胞在肾小球滤过率的调节中起着很重要的作用,包括吞噬免疫复合物及产生细胞外基质。当系膜细胞受到免疫因素或者炎症刺激时,可产生大量的炎症因子造成或加重肾损伤[1]。脂多糖(Lipopolysaccharides,LPS)或者其他刺激因素如高血糖均可激活系膜细胞,增加炎症因子的表达。因此,探讨抑制肾脏疾病中系膜细胞炎症因子表达的药物治疗意义重大。和厚朴酚是从木兰科中药中纯化出来的一种活性成分,研究表明,和厚朴酚具有抗氧化,抗炎及抗血管增生等作用[2]。和厚朴酚还能强烈抑制细胞核因子NF-κB的转位和磷酸化活性,而NF-κB的转位和磷酸化激活正是炎症及肿瘤血管再生的关键步骤[3]。本研究通过建立LPS刺激系膜细胞,观察和厚朴酚对系膜细胞炎症因子表达的抑制作用,并初步探讨其抗炎作用机制。
1 材料和方法
1.1 材 料 LPS(美国Sigma公司)。和厚朴酚(HNK,纯度98.7%,北京中国药品生物制品检定所)。MTS细胞增殖及毒性检测试剂盒(美国Promega公司)。细胞因子 IL-1β、IL-18、TNF-α、TGF-β1 ELISA试剂盒(美国R&D公司)。NF-κB p65、IKK-α/β、IKB-α的磷酸化及非磷酸化抗体和细胞裂解液(美国Cell Signaling Technilogy公司)。兔抗β-actin抗体及辣根过氧化物酶(HRP)标记的二抗(美国Santa Cruz公司)。细胞培养基及胎牛血清(Invitrogen公司)。
1.2 细胞培养 人肾小球系膜细胞(HRMCs)购自美国ScienCell研究所。细胞自复苏后第3~5代用于本实验研究。细胞用含10%胎牛血清的DMEM培养液置37℃、5%CO2温箱培养中传代培养,取处于对数生长期的细胞进行实验。
1.3 MTS法检测细胞增殖活性 细胞以1×104/孔的浓度接种于96孔培养板中,待细胞贴壁后,用含不同浓度和厚朴酚(0、1.25、2.5、5、10、20、40、80、160μmol/L)的培养液培养24h后,每孔加入20μL MTS/PMS反应液,继续培养2h,于酶标仪490nm测定吸光度值,以吸光值的表示细胞增殖活性的高低和药物对细胞毒性作用的大小。
1.4 ELISA法炎症细胞因子检测 将细胞以3×105/孔接种于24孔板中,待细胞贴壁后,用不同浓度(0~20μmol/L)的和厚朴酚预处理1h,然后加入终浓度为1μg/mL的LPS继续培养24h。实验分组见表1。收集培养上清液用ELISA法检测炎症因子IL-1β、IL-18、TNF-α、TGF-β1的表达水平。检测程序严格按试剂盒说明书进行,最后根据标准反应曲线求得各检测样本中相应的细胞因子水平。
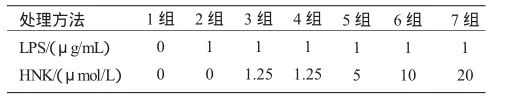
表1 实验分组及处理方法
1.5 Western Blot法检测 NF-κB p65、IKK-α/β、IKB-α的磷酸化及非磷酸蛋白 收集各组细胞,加细胞裂解液冰浴30min后,于4℃ 10 000rpm离心3min,收集离心上清液,于蛋白分析仪上用BCA法测定各样品蛋白含量。取20μg蛋白样品加蛋白上样缓冲液煮沸变性后,进行10%SDS-PAGE,并转移至硝酸纤维素膜,于封闭液(5%BSA)室温封闭2h,分别加入抗NF-κB p65、抗IKK-α/β、抗IKB-α磷酸化及非磷酸抗体和抗β-actin抗体,于杂交炉中室温滚动反应2h;洗膜5min×3次,加相应的辣根过氧化物酶(HRP)标记的二抗(1∶5000),室温反应2h;充分洗膜后加ECL化学发光底物,于全自动化学发光荧光成像分析系统(BioRad,VersaDoc5000MP)曝光成像。
1.6 统计学方法 采用SPSS 13.0统计学软件。计量资料以(±s)表示,实验数据采用one-way analysis of variance(ANOVA)方差分析和t检验,P<0.05表示有统计学意义。
2 实验结果
2.1 和厚朴酚对系膜细胞增殖活力的影响 将系膜细胞培养在含不同浓度的和厚朴酚(0~160μ mol/L)的培养液中24h后进行MTS检测。0~20μmol/L浓度的和厚朴酚没有改变系膜细胞的增殖活力,对细胞无明显的毒性作用。而40μmol/L及以上的浓度显著影响系膜细胞的增殖活力,见图1。因此,在本研究选择0~20μmol/L的和厚朴酚浓度进行后续实验。
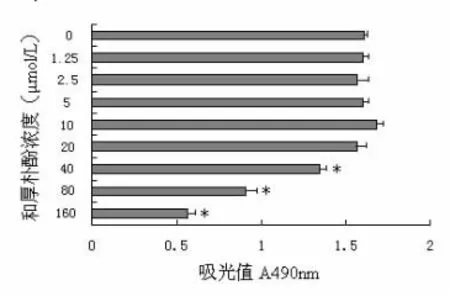
图1 和厚朴酚对系膜细胞增殖活力的影响
2.2 对LPS诱导的系膜细胞炎症因子表达的抑制作用 使用ELISA法检测系膜细胞培养上清液中IL-1β、IL-18、TNF-α及TGF-β1的表达水平。结果表明,LPS刺激可显著诱导系膜细胞IL-1β、IL-18、 TNF-α及TGF-β1的产生,而和厚朴酚则可呈剂量依赖性地抑制LPS诱导的以上炎性细胞因子的表达。其IC50对IL-1β约为10μmol/L,对IL-18、TNF-α、TGF-β1约为20μmol/L,见图2。
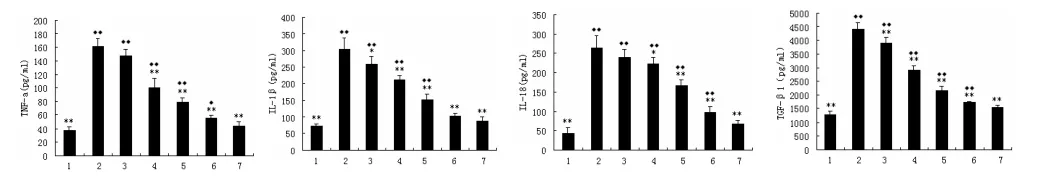
图2 和厚朴酚对LPS诱导的系膜细胞炎症因子表达增加的抑制作用
2.3 和厚朴酚对系膜细胞NF-κB途径信号分子表达及磷酸化的影响 在本研究中,Western blot检测结果显示,LPS刺激显著增加系膜细胞NF-κB p65、IKK-α/β、IKB-α的磷酸化活性。和厚朴酚处理显著抑制LPS诱导的NF-κB p65、IKK-α/β、IKB-α信号分子的磷酸化活性,其抑制作用呈剂量依赖性,见图3。
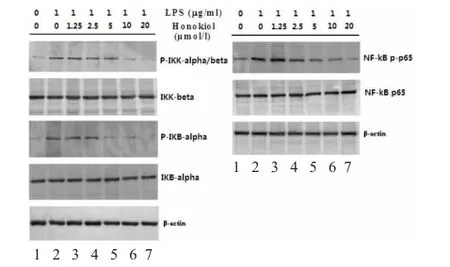
图3 和厚朴酚对系膜细胞NF-κB途径信号分子表达及磷酸化的影响
3 讨 论
系膜在肾小球的解剖结构中占据着中心位置,并在免疫介导的肾小球疾病中通过积极参与局部炎症反应发挥重要的调节作用。系膜细胞的作用正是对肾小球损伤的病理刺激进行应答[4]。近年来,从天然植物中寻找安全有效的药物成为研究的热点之一。有体内研究表明,和厚朴酚2.5mg/kg体重灌胃可明显减少抗Thy1抗体诱导的肾炎大鼠模型肾小球细胞内黏附分子-1及I型胶原的表达[5]。新近研究表明,和厚朴酚能有效抑制LPS及PMA刺激的多种细胞包括巨噬细胞和单核细胞的免疫反应[6]。本研究MTS分析结果显示,和厚朴酚0~20μmol/L浓度完全不影响系膜细胞的增殖活力,对细胞无毒性作用,且可明显抑制LPS诱导的人肾小球系膜细胞炎症因子的表达。
TNF-α在炎症过程中往往是一个起始因素,肾脏疾病时,其他炎症因子如IL-1β、IL-18、TGF-β1[7-9]在肾脏表达明显增加。这些因子可进一步刺激系膜细胞产生细胞外基质并促进肾脏疾病进展[7]。本研究中,LPS处理导致系膜细胞上清液中以上炎症因子表达增加,而此炎症因子表达增加的效应被加入的和厚朴酚显著抑制,且其抑制作用呈剂量依赖性。同时,本研究也初步探讨了和厚朴酚抑制LPS诱导的系膜细胞炎症因子表达的细胞信号途径。众所周知,NF-κB通过调节编码前炎症细胞因子、黏附分子、趋化因子及生长因子基因的表达体现其在炎症过程中的中心地位[10]。研究结果表明,和厚朴酚可剂量依赖地抑制LPS诱导的细胞NF-κB p65、IKK-α/β及IKB-α的磷酸化活性,并在20μmol/L时达到最大的效应。
本研究表明,和厚朴酚可显著抑制LPS诱导的系膜细胞炎症因子的表达,其抑制炎症因子表达的作用,至少部分是通过抑制细胞NF-κB信号途径的NF-κB p65、IKK-α/β及IKB-α等信息分子的磷酸化活性而实现的。和厚朴酚对肾系膜细胞炎症因子表达的抑制效应,有可能在临床炎性肾病的防治中发挥重要作用。
[1]Yu Z,Zhang W,Kone BC.Signal transducers and activators of transcription 3(STAT3)inhibits transcription of the in ducible nitric oxide synthase gene by interacting with nuclear factor κB[J].Biochem J,2002,367:97-105.
[2]Sheu ML,Chiang CK,Tsai KS,et al.Inhibition of NADPH oxidase-related oxidative stress-triggered signaling by honokiol suppresses high glucose-induced human endothelial cell apoptosis[J].Free Radic Biol Med,2008,44:20432050.
[3]Kim BH,Cho JY.Anti-inflammatory effect of honokiol ismediated by PI3K/Aktpathwaysuppression[J].Acta Phar-macol Sin,2008,29:113-122.
[4]Gómez-Guerrero C,Hernández-Vargas P,López-Franco O, et al.Mesangial cells and glomerular inflammation:from the pathogenesis to novel therapeutic approaches[J].Curr Drug Targets Inflamm Allergy,2005,4:341-351.
[5]Chiang CK,Sheu ML,Hung KY,et al.Honokiol,a small molecular weight natural product,alleviates experimental mesangial proliferative glomerulonephritis[J].Kidney Int,2006, 70:682-689.
[6]Lee SY,Cho JY.Inhibitory effects of honokiol on LPS and PMA-induced cellular responses of macrophages and monocytes[J].BMB Rep,2009,42:574-579.
[7]Sánchez-López E,Rodriguez-Vita J,Cartier C,et al.Inhibitory effect of interleukin-1β on angiotensin II-induced connective tissue growth factor and type IV collagen production in cultured mesangial cells[J].Am J Physiol Renal Physiol, 2008,294:F149-160.
[8]Shui HA,Ka SM,Wu WM,et al.LPS-evoked IL-18 expression in mesangial cells plays a role in accelerating lupus nephritis[J].Rheumatology(Oxford),2007,46:1277-1284.
[9]Schnaper HW,Hayashida T,Hubchak SC,et al.TGF-beta signal transduction and mesangial cell fibrogenesis[J].Am J Physiol Renal Physiol,2003,284:F243-252.
[10]Hanada T,Yoshimura A.Regulation of cytokine signaling and inflammation[J].Cytokine Growth Factor Rev,2002, 13:413-421.
Inhibitory Effects of Honokiol on Lipopolysaccharide-Induced inflammatory Cytokine Production in Human Renal Mesangial Cells
WANG Yeping,WU Zhigang,LI Xueqin,et al.Department of Clinical Laboratory,the People's Hospital of Changxing, Changxing(313100),China
Objective:To investigate the anti-inflammatory effects of honokiol and the signaling mechanisms involved in lipopolysaccharide(LPS)-induced conditions in human renal mesangial cells(HRMCs).MethodsThe safe dosage of honokiol for HRMCs was initially identified by using the[3,4-(5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl) -2-(4-sulfophenyl)-2H-tetrazolium,inner salt(MTS)]assay.HRMCs were pretreated with honokiol(0~20 μmol/L)and then incubated in the presence or absence of LPS (1 μg/mL)for 24 h.The expression levels of interleukin(IL)-1β, IL-18,tumor necrosis factor-(TNF-α),and transforming growth factor-β1(TGF-β1)in treated HRMCs were determined by ELISA.The levels of phosphorylated and nonphosphorylated antibodies against NF-κB p65,IKK-α/β and IKB-α were detected with western blotting.ResultsHonokiol did not significantly change HRMCs viability at a concentration of<20 μmol/L but markedly altered cell viability at concentrations of>40 μmol/L.LPS treatment led to a marked upregulation of the levels of IL-1β,IL-18,TNF-α and TGF-β1 in HRMCs.The upregulation of these molecules was significantly abolished by honokiol in a dose-dependent manner;honokiol almost completely reversed IL-1β expression at 10 μmol/L,and IL-18,TNF-α,TGF-β1 expression at 20 μmol/L.In addition,phospho-NF-p65,phospho-IKK-α/β and phospho-IKB-α were dramatically suppressed by honokiol.ConclusionHonokiol can inhibit the LPS-induced expression of inflammatory cytokines in HRMCs,partly by suppressing the NF-κB signaling pathway.
human renal mesangial cells honokiolinflammation cytokine
浙江省中医药科技计划项目(No.2006Y007,2008CA047).通讯作者:姚航平,Email:yaohangping@zju.edu.cn
2010-09-13
·病例报道·
