实时荧光PCR技术快速检测禽流感病毒H5型探讨
2011-01-29王七生
王七生
(桂林市疾病预防控制中心,广西 桂林 541001)
PCR技术一直作为一种敏感性高的核酸分子检测方法于科学研究中广泛应用。但由于其难以进行定量检测,同时还存在污染[1]等问题,在临床应用中受到限制。随着实时荧光PCR技术的引入与发展,PCR技术逐步应用于临床病原体等检测与诊断。考虑到H5型是国内禽流感病毒常见的血清型[2],笔者现将实时PCR技术应用于禽流感病毒H5型检测,以期为禽流感病毒研究提供更快速有效的检测方法。
1 材料与方法
1.1 病毒菌株
禽流感病毒H5型均本研究所提供。
1.2 主要试剂及仪器
本研究所用PCR仪器为美国ABI公司生产,型号为7300。所用凝胶成像系统为美国Bio-Rad生产的Gel Doc2000。所用分光光度计为美国Varian生产的Cary50Probe紫外光度计。试剂盒包括提取RNA的试剂盒等均从Amersham Biosciences 购买。所用超速离心机为德国Eppendorf生产。本研究所用试剂TaKaRa实时PCR试剂盒等均从大连宝生物公司购买。
1.2 方法
1.2.1 PCR引物及探针设计、合成
根据GenBank上禽流感H5型HA核酸序列,并结合DNASTAR软件做同源分析,以获得研究所需H5型HA保守核算序列,并经引物相关软件(如Primer等)、探针相关软件如(Oligo等)进行引物、探针设计,同时将已设计好的引物、探针交由宝生物公司合成。
1.2.2 目的基因扩增、测序、特异性检测
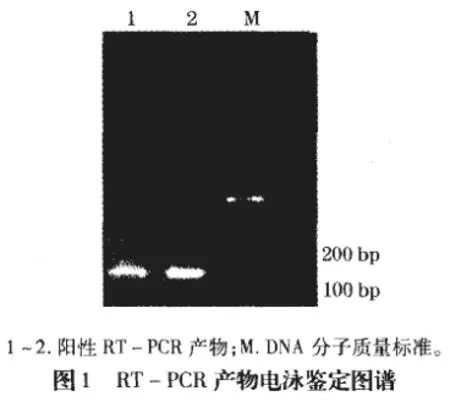
先根据试剂盒方法提前RNA,并以其为模板,逆转录为cDNA,进一步扩增目的基因。制备阳性标准品,并进行测序以确定所获阳性标准品为禽流感H5型HA基因。之后根据实时PCR试剂盒提供的优化方法进行退火温度、离子浓度(主要是Mg2+)、探针浓度、引物浓度等优化,并建立标准曲线。标准曲线建立方法即:将阳性标准品置于260nm紫外光下进行吸光度测定,以计算出DNA的拷贝数。并分别连续10倍稀释且进行荧光PCR检测以获得标准曲线,且经重复性、敏感性检测。同时H5型HA基因与禽流感H7、H9、其他病毒包括ILTV、DPV、大肠菌O46进行特异性检测。
2 结 果
2.1 引物、探针序列及特异性检测结果
禽流感H5型HA基因引物、探针序列如表所示,基因片段150bp,与另82种禽流感H5亚型同源性达100%,高度保守。经RT-PCR扩增片段并进行测序,与预期片段基本一致(图1),可初步证实扩增片段是目的片段。RT-PCR扩增(50μL体系):dNTPs取2μL,上下游引物分别取1μL,聚合酶取0.5μL,PCR缓冲液取102μL,Mg2+取2 μL,并加入去酶水至总体积为50μL。以95℃ 3min预变性并进行95℃ 20s退火、56℃30s变性、72℃ 40s延伸,循环32次,72℃ 5min结束(表1)。
表1 禽流感H5型HA基因引物、探针序列
2.2 实时荧光定量逆转录PCR优化条件
最终优化的25μL反应体系见表2。最佳PCR条件:95℃ 15s退火、60℃ 20s变性、72℃ 40s延伸,循环38次,并以95℃ 2min、72℃5min进行预扩增及终止。
2.3 标准曲线及特异性检测
标准曲线相关系数r=0.996,线性相关性良好。特异性检测见PCR扩增产物与禽流感H5型HA基因同源性100%,其他病原菌包括禽流感H7、H9、DPV、大肠菌等检测结果阴性。
2.4 检测时间
从对样品进行处理至检测结果,平均时间为(3.8±0.4)h。
3 讨 论
实时荧光PCR技术检测灵敏度、特异度高,且检测速度快,在传染病等检测上具有重要意义[3]。在本研究中,我们可以看到对禽流感H5型进行实时荧光PCR检测同源性高,检测时间短,仅(3.8±0.4)h,可用于禽流感H5型病毒菌株的快速筛查。

表3 最终优化的25μL反应体系各组分情况
[1] 高斌,刘敬忠.实时荧光PCR技术的研究及其应用进展[J].诊断学理论与实践,2005,4(6):507-509.
[2] 唐秀英,田国斌,赵传珊,等.中国禽流感流行株的分离鉴定[J].中国预防兽医学报,1998,20(1):1-5.
[3] 马莉,汤承,岳华,等.TaqMan实时荧光RT-PCR快速检测H5亚型禽流感病毒[J].黑龙江畜牧兽医,2009(3):12-14.
