纳米金放大SPR技术检测前列腺癌肿瘤标志物free PSA
2011-01-29陈胜华王文武
陈胜华,王文武,向 娟
(1.中南大学化学化工学院,长沙410083;2.中州大学化工食品学院,郑州450044)
1. 绪论
肿瘤标志物检测是肿瘤普查、诊断和预后的主要技术手段之一。前列腺癌肿瘤标志物前列腺特异性抗原(prostate-specific antigen,PSA)是前列腺癌诊断的标志物,对其检测可以有效的检测和预防前列腺癌的发生[1-2]。PSA 又可以分为 f-PSA 和PSA -ACT[3],近年来发现检测 f- PSA,并且比较 f-PSA/t-PSA的比值可以有效的区分前列腺增生和前列腺癌,特别是在诊断灰色区(PSA浓度在4-10 ng/mL),可以有效地提高诊断真实性,降低误诊率。表面等离子体激元共振(surface plasmon resonance,SPR)技术[4]是一种基于芯片表面折射率变化的光学检测技术,具有快速、灵敏、免标记等优点,可实时在线地跟踪固液界面反应,在蛋白及核酸等生物分子检测方面具有广阔的应用前景。但是,传统的SPR检测方法难以检测低分子量、超低浓度的生物分子。f-PSA在人血清中的浓度非常低,直接利用传统的SPR技术很难检测。而纳米金具有密度大、介电常数大、良好的生物相容性,可以极大的增强SPR信号[5-6]。因此,我们结合两者的优点,设计出基于纳米金放大的SPR技术检测f-PSA,这种方法既可保持生物分子的生物活性,又可有效突破传统SPR的限制。
2. 实验部分
2.1 试剂
实验所用的载液为磷酸缓冲液(PBS,15 mmol/L,pH=7.4 包含0.85%NaCl),使用前用0.22 - μm的膜过滤器进行过滤,且避光存于冰箱内待用。11-巯基十一酸(MUA)溶解纯酒精中(10 mmol/L);羧基活化剂 NHS(0.1 mol/L)和 EDC(0.4 mol/L)、氨基乙醇(AE 1 mol/L)、游离前列腺特异性抗体(anti-f-PSA)、均溶解在PBS缓冲液中。游离前列腺特异性抗原(f-PSA)溶解在醋酸钠缓冲液(10 mmol/L,pH=5.6 包含 0.85%NaCl)。实验所用试剂均为分析纯。所有溶液均用18.0 M·cm的超纯水配置。
2.2 仪器
实验采用由美国BI公司研制的BI-3000 SPR双通道检测系统,配备有美国Kent Scientific公司的流动注射泵(型号Genie Plus),构建成流动注射表面等离子体激元共振 (FI-SPR)装置。此装置含六个流通阀,流通池的进样端与六通阀的一端相连,六通阀上进样环的体积为200 μl。实验时用注射器将载液注入注射泵上,在流动注射泵的推动下,载液流经六通阀后流过流通池,如果进样环中注入了检测样品,载液将会把样品带入流通池进行分析检测,计算机将实时的记录时间与角度变化感应图。
2.3 SPR 芯片制备
将BK7盖玻片先用水虎鱼(双氧水:浓硫酸=3:7,体积比)在80°C条件下煮约30分钟,随后用二次去离子水清洗干净玻片上的浓硫酸,放置氨水中(水∶浓氨水∶双氧水 =5∶1∶1,体积比),超声 20分钟,然后用二次去离子水冲洗干净,N2吹干。处理干净后的玻片放到真空磁控溅喷镀膜机(Sputter Coater 108auto/SE,Kert J.Lester Inc.,Clariton,PA)上进行喷镀,先在玻片的表面镀一层2 nm厚的铬,随后在玻片表面镀一层50nm左右的金[101],通常镀铬的时候,选用的时间是295s,镀金选用的时间是295s。组装修饰芯片前先可用氢火焰进行退火,以除去金膜表面的杂质和附着物,或者将金膜用水虎鱼快速清洗,去除金膜表面杂质。首先需将处理干净的金膜在浸泡10 mmol/L11-巯基十一酸(MUA)水溶液中,在室温下避光浸泡12小时,使其表面形成一层规则的巯基自组装单分子层;依次用酒精溶液、二次水清洗金膜,氮气吹干金膜备用。
2.4 纳米金复合物制备
纳米金采用一步法柠檬酸钠还原制备。0.125 mg/ml f-PSA与纳米金溶液混合于 pH 9的0.1 mol/L的K2CO3溶液中,振荡4小时,然后再4℃下以9000r/min速度冷冻离心25 min。移去上层清液,以去除多余的未结合的蛋白,沉淀用pH 7.4的15 mmol/L的PBS稀释。
3. 结果与讨论
由于作为肿瘤标志物的f-PSA的分子量仅为30 kD,如果在传感芯片上面直接检测,当检测到低浓度,特别是纳克级的水平时,SPR信号受到仪器的限制而难以获得。本文采用纳米金放大信号检测f-PSA,其检测原理见图1。首先,在金膜表面通过特异性的免疫反应形成anti-f-PSA-f-PSA或者Au-f-PSA复合物。芯片表面首先固定单分子层的anti-f-PSA,然后注射不同浓度的f-PSA,最后注射固定浓度的Au-f-PSA复合物与anti-f-PSA发生免疫反应,芯片表面固定的f-PSA越少,anti-f-PSA裸露的位点越多,当最后注入Au-f-PSA复合物后,与基底裸露的anti-f-PSA特异性免疫结合产生的SPR信号越大。显然,竞争型免疫模式在低浓度检测中具有独特的优势。

图1 竞争型免疫反应模式SPR检测原理示意图(为了清晰表示,图中分子及纳米金均未按实际比例给出)
图2所示为竞争型免疫模式检测f-PSA的SPR响应曲线图。图中虚线所示为没有注射f-PSA的控制实验,Au-f-PSA复合物直接与基底的anti-f-PSA特异性结合,理论上产生最大的SPR信号,其信号变化为198 mDeg。图中实线为此实验的一个主体实验,图中检测的f-PSA的浓度为5 g/mL,由此产生的SPR信号有108 mDeg变化,当Au-f-PSA复合物注入后,其产生的信号仅为9 mDeg。这个时候可以认为Au-f-PSA复合物基本上不与基底的anti-f-PSA作用。当检测的 f-PSA的浓度减小时,基底上将剩余抗原结合位点,当Au-f-PSA复合物注入后便会与基底作用,产生信号。当检测的f-PSA浓度逐渐降低时,Au-f-PSA复合物产生的信号逐渐增多,最后基本上达到控制实验的198 mDeg.

图2 竞争型免疫模式检测f-PSA的SPR响应信号图
对于浓度大于5 ng/ml的f-PSA,可以直接通过SPR检测,SPR不需要纳米金等的放大作用,直接可以检测。并且在一定的浓度范围内(5 ng/ml~50 ng/ml)存在一定的线性关系。对低于5 ng/ml的f-PSA,直接利用SPR检测,很难检测到信号变化。f-PSA在人血清中的浓度一般较低,即便是患有前列腺癌的患者血清中浓度也有低于纳克级每毫升的浓度,所以直接利用SPR检测人血清中的f-PSA的浓度远远不能达到诊断的目的,因此利用纳米金复合物放大SPR检测信号,从而降低f-PSA检测的的检测下限,达到诊断前列腺癌的目的。建立的竞争型免疫反应模式也是基于 anti-f-PSA/f-PSA和anti-f-PSA/Au-f-PSA之间的特异性作用。从图3可以明显的看出,其纳米金复合物有明显的放大作用,由于所采用的是竞争结构,所以当浓度检测的f-PSA浓度越低时,纳米金的放大信号就越大。通过这种免疫竞争法,观察SPR共振角度变化,可以很容易的检测出低浓度的f-PSA(0.05 ng/mL至5 ng/ml)。

图3 竞争型免疫模式检测f-PSA,Au-f-PSA复合物的SPR信号与f-PSA浓度的关系曲线图
从图3可以看出,Au-f-PSA信号与f-PSA的浓度在整个检测区域内不成线性关系。假设anti-f-PSA与f-PSA的反应遵从Langmuir吸附等温式假定的准一级反应,通过吸附和解离平衡公式的推导得到以下公式:
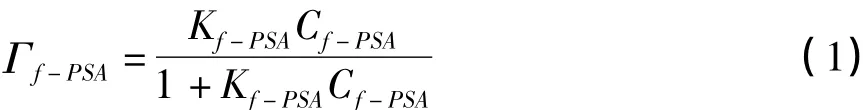
式中Γf-PSA代表f-PSA在传感表面的覆盖度,也就是相当于SPR角度偏移值,Cf-PSA代表f-PSA的浓度,Kf-PSA代表抗原抗体反应平衡常数。当Cf-PSA浓度极低时,即 Kf-PSACf-PSA≪ 1 时,则可以得到以下公式:

由于我们实验过程中采用的是竞争模式检测,所以,anti-f-PSA不仅与 f-PSA结合,剩余的结合位点还会与Au-f-PSA结合。根据Langmuir吸附等温式,在反应达到平衡时有:

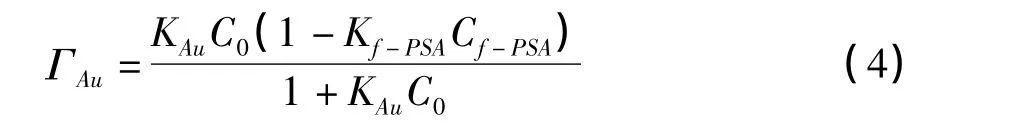
式中,KAu为抗体与纳米金蛋白复合物反应平衡常数,ΓAu代表纳米金复合物的表面覆盖度,也表示的是纳米金复合物的SPR角度偏移值。C0代表纳米金复合物的浓度值。如公式(4)所示,当C0的浓度极低时,即KAuC0≪1时,那么可以得到以下的公式:

从公式(5)可以看出,当f-PSA浓度极低时,纳米金复合物的SPR角度偏移值与f-PSA的浓度是成线性关系的,而且是成反比例关系的。
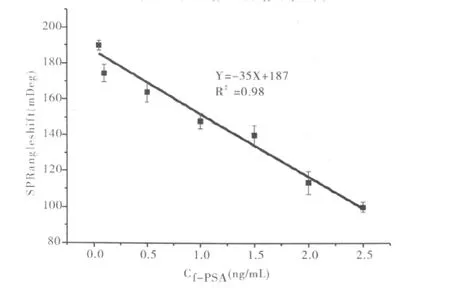
图4 Au-f-PSA复合物的SPR信号与f-PSA低浓度下的的关系曲线图
图4为低浓度(0 ~2.5 ng/ml)下,Au-f-PSA复合物的SPR信号与f-PSA低浓度下的的关系曲线图。通过线性拟合发现:当f-PSA浓度范围为(0.05 ng/ml~2.5 ng/ml)时,Au -f-PSA 与基底anti-f-PSA特异性作用所产生的SPR角度变化与所检测的f-PSA浓度成良好的线性关系。其线性回归方程为(Y= -35X+187,R2=0.98,其中 Y 代表SPR角度偏移值,X代表f-PSA浓度(ng/ml)相对标准偏差为3.0)。这与我们理论推出来的结果一致,即在低浓度下存在一定的线性关系。在实验中我们所达到的检测下限为0.05 ng/ml,这个检测水平已经达到前列腺癌早期诊断的检测标准。
4. 结论
本文采用纳米金放大SPR技术实现了前列腺癌肿瘤标志物f-PSA在线检测。利用抗原-抗体特异性相互作用,设计了竞争型检测模式进行超灵敏检测。结果显示:当检测f-PSA浓度越低时,Au-f-PSA复合物与基底anti-f-PSA结合产生的信号越大。当检测的浓度范围为0.05 ng/ml至2.5 ng/ml时,Au-f-PSA所产生的SPR角度变化与所检测的f-PSA浓度成良好的线性关系。此方法能够检测0.05 ng/ml的水平,已经达到诊断前列腺癌早期诊断的标准。
[1]Schaller J,Akiyama K,Tsuda R,et al.Isolation,characterization and amino-acid sequence of y-seminoprotein,a glycoprotein from human seminal plasma Eur[J].J.Biochem,1987,170:111 -120.
[2]赵洪,张琚,冯剑利.血清PSA水平与前列腺癌的检测[J].中华泌尿外科杂志,1998,19(10):638 -639.
[3]Sozen H O.PSA Isoforms in Prostate Cancer Detection[J].European urology supplements,2006,5:495 -499.
[4]Liedberg B,Nylander C,Lundstrom I.Surface - Plasmon Resonance for Gas - Detection and Biosensing[J].Sens.Actuators,1983,4:299 -304.
[5]Faulk W P,Taylor G M.An immunocolloid method for the electron microscope,Immunochemistry[J].Immunochemistry,1971,8:1081 -1083.
[6]Sperling R A,Gil P R,Zhang F,et al.2008 Gold:Chemistry,Materials and Catalysis Issue[J].Chemical Society Reviews,2008,37(9):1896 -1908.
