登革2型病毒与整合素β3相互作用机制的研究
2011-01-28张俊磊范东瀛吴江漫
明 颖,高 娜,张俊磊,陈 辉,王 娟,范东瀛,吴江漫,安 静
登革病毒(dengue virus,DV)为黄病毒科单股正链RNA 病毒,仅含有一个开放读码框,编码3 个结构蛋白(C,prM 和E)以及7 个非结构蛋白(NS1~NS5)。依E 蛋白抗原性的不同,DV 分为4 个血清型(DV1~4),以埃及伊蚊和白纹伊蚊为传播媒介,引起人类的登革热(dengue fever,DF)、登革出血热/登革休克综合征(dengue hemorrhagic fever/dengue shock syndrome,DHF/DSS),后者症状较重,有明显的出血倾向,病死率高,但发病机制尚不明确,目前多数学者认为可能与血管内皮细胞(vascular endothelial cell,VEC)功能改变或者结构改变有关[1-2]。
整合素是广泛分布于细胞表面的跨膜糖蛋白受体,由α 和β 亚单位组成。作为信号受体,不仅介导细胞与细胞之间、细胞与细胞外基质之间的相互作用,并在细胞的生长、移行、增殖和分化等诸多生理过程中亦发挥重要作用。已知VEC 表面分布着丰富的整合素β1 和β3。有研究发现,整合素β3 对维持毛细血管的完整性、调节血管通透性方面具有重要作用[3-4]。在前期研究中,我们发现DV2 进入哺乳动物株ECV304 细胞需要整合素β3 分子的参与[5-6]。但有研究表明,依据细胞类型的不同,介导DV 吸附和进入宿主细胞的蛋白分子有所不同[7-9]。本实验旨在探讨DV2 感染VEC 株EA.hy926过程中,整合素β3 的可能作用及其与之相互作用的病毒蛋白,在观察DV2 感染后整合素β3 表达变化的基础上,进一步将表达DV2 各个蛋白的质粒转染EA.hy926 细胞,分析病毒蛋白与整合素β3表达及共存关系,期望为深入阐明DV 致病机制提供有价值参考资料。
1 材料与方法
1.1 实验材料
1.1.1 细胞株和病毒株 EA.hy926、C6/36 和Vero细胞由本教研室保存。DV2(Tr1751 株)分离自登革热患者,由日本感染病研究所大谷明博士惠赠。病毒经C6/36 细胞增殖,-80 ℃冻存备用。Vero 细胞噬斑法检测病毒滴度。
1.1.2 抗体 DV2 兔多克隆抗体为本实验室自制,鼠抗人整合素β3 单克隆抗体购自英国abcam 公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔IgG 及Cy3 标记的羊抗鼠IgG 购自美国Sigma 公司。
1.1.3 质粒 DV2 各病毒蛋白质粒pRe-C、pRe-E、pRe-NS1-2a、pRe-NS2b、pRe-NS3、pRe-NS5 及空载体pReceiverM01 由本实验室构建和保存,pNS4a-HA、pNS4-HA 由Adolfo García-Sastre[10]惠赠,HCV C 蛋白质粒pHCV-C 由本室构建和保存。
1.2 实验方法
1.2.1 增殖曲线测定 将EA.hy926 细胞制成细胞悬液,传代于六孔培养板,2×105/孔,37 ℃,5%CO2,孵育18~24 h 后,吸出培养上清液,磷酸缓冲液(phosphate buffer solution,PBS)润洗1 次,进而加入DV2[感染复数(multiplicity of infection,MOI)=1]感染,分别于感染后1、2、3、4、5、6 d 各取出200 μl 培养上清液,采用Vero 细胞噬斑法检测病毒滴度,绘制增殖曲线。实验重复3 次。
1.2.2 病毒感染实验 将EA.hy926 细胞制成细胞悬液,以2×105/孔接种于内置玻片的六孔培养板中,37 ℃,5% CO2,孵育18~24 h 后,吸出培养上清液,用PBS 润洗1 次,进而加入DV2(MOI=1)。模拟感染组(mock 组)则加入56 ℃灭活30 min 的DV2 液,同等条件置于37 ℃,5%CO2孵育,于24、48、72 h 将细胞爬片取出进行免疫荧光双染色。
1.2.3 病毒蛋白转染EA.hy926 细胞 抽提质粒pRe-C、pRe-E、pRe-NS1、pRe-NS2b、pRe-NS3、pRe-NS5、pNS4a-HA、pNS4b-HA DNA,分别转染EA.hy926细胞,同时设pHCV-C、pReceiverM01 空质粒转染EA.hy926 细胞作为对照。操作步骤参照Lipofectin Reagent 脂质体转染说明书,转染后48 h,免疫荧光方法检测整合素β3 的表达量变化及其与各蛋白的共存情况。
1.2.4 免疫荧光双染色 将病毒感染或转染后得到的细胞爬片以4%多聚甲醛固定20 min,0.2%Triron X-100 通透5 min,进而用含1%的牛血清白蛋白PBS 进行封闭20 min,加兔抗DV2 抗体(1∶100稀释),4 ℃孵育过夜,PBS 洗3 次(5 min/次),加入羊抗兔IgG-FITC(1∶300 稀释),室温孵育1 h 后,PBS洗3 次(5 min/次),加入鼠抗人整合素β3 单克隆抗体(1∶100 稀释),4 ℃孵育过夜,用PBS 洗3 次(5 min/次),加入羊抗鼠IgG-Cy3(1∶300 稀释),室温孵育1 h后,PBS 洗3 次(5 min/次),以荧光显微镜(Olympus BX61)及激光共聚焦显微镜(Leica TCS SP5)观察β3 表达量的变化及与病毒蛋白的共存情况。
2 结 果
2.1 增殖曲线测定 DV2 感染EA.hy926 细胞后于不同的时相点收获培养上清液,采用Vero 细胞进行滴度测定,结果见图1:在该细胞株中,DV2 最高滴度在感染后第5 天出现,滴度达到1.7×105pfu/ml,说明DV2 能够在EA.hy926 细胞中进行增殖,可以将该细胞株作为实验对象用于后续试验。
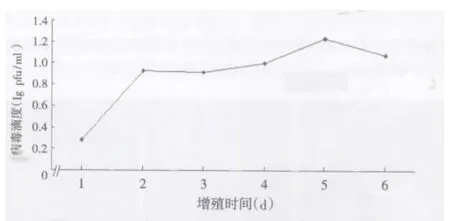
图1 DV2在EA.hy926细胞中的增殖曲线Figure1 Growth curve of DV2 in EA.hy926 cells
2.2 病毒感染实验 病毒感染后不同时相点采用间接免疫荧光检测整合素β3 表达量的变化(图2)。结果如图所示:与mock 组相比较,病毒感染后可见红色荧光染色较强的细胞,整合素β3 的表达明显增强,荧光主要分布于细胞膜,并且随着感染时间的延长,整合素的表达量增加,胞浆也可见特异性荧光。经免疫荧光双染色,激光共聚焦显微镜下观察病毒抗原和整合素β3 的共存,发现病毒感染后整合素β3 的表达量增高,且病毒抗原与整合素β3 有明显共存(图3~5),24 h 共存主要分布在包膜,48~72 h胞浆内也可见一定量的共存。

图3 DV2 感染24 h 后病毒抗原与整合素β3 共存(Bar=10 μm)Figure3 Co-localization of virus antigen and β3 integrin after 24 hours of DV2 infection (Bar=10 μm)

图4 DV2感染48 h后病毒抗原与整合素β3共存(Bar=10 μm)Figure4 Co-localization of virus antigen and β3 integrin after 48 hours of DV2 infection (Bar=10 μm)

图5 DV2感染72 h后病毒抗原与整合素β3共存(Bar=10 μm)Figure5 Co-localization of virus antigen and β3 integrin after 72 hours of DV2 infection (Bar=10 μm)
2.3 转染实验结果 将pRe-C、pRe-E、pRe-NS1-NS2a、pRe-NS2b、pRe-NS3、pRe-NS5、pNS4a-HA、pNS4b-HA、pHCV-C、pReceiverM01 分 别 转 染 至EA.hy926 细胞后,间接免疫荧光检测病毒蛋白与整合素β3 表达情况见图6~7。结果显示转染后48 h,pRe-E 蛋白的表达可诱导整合素β3 的表达,且E蛋白与整合素β3 的表达存在明显共存。除E 蛋白外,其他9 种DV2 蛋白质粒和pHCV-C 及空质粒的转染对整合素β3 表达无明显影响,也未见其与整合素β3 有明显共存。

图6 空载体质粒转染48 h 免疫荧光染色结果(Bar=10 μm)Figure6 EA.hy926 cells were double-stained for empty vector plasmid and β3 integrin after 48 hours of trans-fection (Bar=10 μm)
3 讨 论

图7 pRe-E 蛋白质粒转染后免疫荧光染色结果(Bar=10 μm)Figure7 EA.hy926 cells were double-stained for pRe-E and β3 integrin(Bar=10 μm)
DV 感染已成为热带和亚热带地区一个严重的公共卫生问题,全世界每年有5 千万~1 亿人感染DV,特别是以与我国接壤的东南亚地区最为严重[11]。目前对DV 感染尚无有效的疫苗和治疗措施。DHF/DSS 的主要病理生理特点是血浆渗漏,而病理学检查未发现VEC 有明显器质性损害,提示VEC 功能障碍导致血管通透性增加可能是DHF/DSS 发生的主要原因。
VEC 表面整合素含量丰富,多种病毒受体研究结果提示,整合素分子可以作为病毒受体或共受体[12-13],协助病毒进入宿主细胞,在病毒与宿主细胞相互作用的过程中发挥重要作用[13-14]。而DV 感染VEC 的受体目前尚不明确[15],因此本研究选用血管VEC 株EA.hy926 细胞作为研究对象,探讨整合素在病毒进入VEC 的过程中所发挥的作用。
前期的实验中,我们研究了整合素β3 在DV2感染中的作用,提示整合素β3 有助于DV2 进入宿主细胞[5-6]。本实验首先证明了EA.hy926 能够支持DV的复制,增殖曲线显示,最高滴度出现在感染后第5 天,且光镜下感染组与对照组细胞形态无明显差别,因此EA.hy926 可以作为研究DV感染机制的细胞模型。进一步实验发现,DV 感染可使EA.hy926 细胞中整合素β3 的表达量增高,且随感染时间的延长有渐增趋势。在此基础上,我们将编码DV2 病毒蛋白的10 个质粒分别转染EA.hy926 细胞,观察不同病毒蛋白转染后整合素β3 表达量的变化。结果表明,转染E 蛋白可诱导整合素β3 的表达,E 蛋白与整合素β3 有明显的共存,而其他病毒蛋白的表达对整合素β3 表达无明显影响,也无明显共存。提示E 蛋白有可能作为DV感染细胞的吸附蛋白,与整合素β3 相互作用,介导DV2 的进入细胞。
整合素β3可以特异性识别配体的精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)三肽序列,从而介导细胞与细胞、细胞与细胞外基质之间的相互作用,发挥其粘附和信号转导两大基本功能。研究发现,口蹄疫病毒、柯萨奇病毒以及腺病毒都通过RGD 依赖的方式与整合素分子结合进入细胞,但是DV2 的相关区域不含有RGD 序列,表明DV2 与整合素的相互作用并不依赖RGD 序列[16]。近期的研究发现,DV E 蛋白Ⅲ区外侧的FG 环被认为是宿主细胞感染的关键分子,为哺乳动物细胞感染DV2所必需[17]。然而也有研究表明,E 蛋白Ⅲ区与哺乳动物细胞株的结合可能不依赖于FG 环[18]。因此,整合素β3 与E 蛋白是否通过上述位点结合,尚须进一步研究证实。
综上所述,本文从血管通透性增高的机制入手,研究DV 感染对VEC 功能的影响,将有助于阐明DHF/DSS 的成因,为DV 感染的防治提供理论依据。
[1] Lin CF,Lei HY,Shiau AL,et al.Endothelial cell apoptosis induced by antibodies against dengue virus nonstructural protein 1 via production of nitric oxide[J].JImmunol,2002,169(2):657-664.
[2] Murgue B,Cassar O,Deparis X.Plasma concentrations of sVCAM-1 and severity of dengueinfections[J].JMed Virol,2001,65(1):97-104.
[3] Borges E,Jan Y,Ruoslahti E.Platelet-derived growth factor receptor beta and vascular endothelial growth factor receptor 2 bind to the beta3 integrin through its extracellular domain[J].JBiol Chem,2000,275(51):39867-39873.
[4] Gavrilovskaya IN,Peresleni T,Geimonen E,et al.Pathogenic hantaviruses selectively inhibit beta3 integrin directed endothelial cell migration[J].Arch Virol,2002,147(10):1913-1931.
[5] Zhang JL,Wang JL,Gao N,et al.Up-regulated expression of beta3 integrin induced by dengue virus serotype 2 infection associated with virus entry into human dermal microvascular endothelial cells[J].Biochem Biophys Res Commun,2007,356(3):763-768.
[6] 张俊磊,高娜,陈炜,等.CHO细胞中稳定表达人整合素β3对登革2型病毒感染的影响[J].第三军医大学学报,2009,31(2):98-100.
[7] Thepparit C,Smith DR.Serotype-specific entry of dengue virus into liver cells:identification of the 37-kilodalton/67-kilodalton highaffinity laminin receptor as a dengue virus serotype 1 receptor[J].J Virol,2004,78(22):12647-12656.
[8] Jindadamrongwech S,Thepparit C,Smith DR.Identification of GRP 78(BiP)as a liver cell expressed receptor element for dengue virus serotype 2[J].Arch Virol,2004,149(5):915-927.
[9] Reyes-Del Valle J,Chávez-Salinas S,Medina F,et al.Heat shock protein 90 and heat shock protein 70 arecomponents of dengue virus receptor complex in human cells[J].JVirol,2005,79(8):4557-4567.
[10] Muñoz-Jordan JL,Sánchez-Burgos GG,Laurent-Rolle M,et al.Inhibition of interferon signaling by dengue virus[J].Proc Natl Acad Sci U SA,2003,100(24):14333-14338.
[11] Brandler S,Ruffie C,Najburg V,et al.Pediatric measles vaccine expressinga denguetetravalent antigen elicits neutralizing antibodies against all four dengue viruses[J].Vaccine,2010,28(41):6730-6739.
[12] Guerrero CA,Méndez E,Zárate S,et al.Integrin alpha(v)beta(3)mediates rotavirus cell entry[J].Proc Natl Acad Sci U SA,2000,97(26):14644-14649.
[13] Chu JJ,Ng ML.Interaction of West Nile virus with alpha v beta 3 integrin mediates virus entry into cells[J].J Biol Chem,2004,279(52):54533-54541.
[14] Akula SM,Pramod NP,Wang FZ,et al.Integrin alpha3beta1(CD 49c/29)is a cellular receptor for Kaposi's sarcoma-associated herpesvirus(KSHV/HHV-8)entry into the target cells[J].Cell,2002,108(8):407-419.
[15] Peyrefitte CN,Pastorino B,Grau GE,et al.Dengue virus infection of human microvascular endothelial cells from different vascular beds promotes both common and specific functional changes[J].J Med Virol,2006,78(2):229-242.
[16] van der Most RG,Corver J,Strauss JH.Mutagenesis of the RGD motif in the yellow fever virus 17D envelope protein[J].Virol,1999,265(1):83-95.
[17] Erb SM,Butrapet S,Moss KJ,et al.Domain-ⅢFG loop of the dengue virus type 2 envelope protein is important for infection of mammalian cells and Aedes aegypti mosquitoes[J].Virology,2010,406(2):328-335.
[18] Hung JJ,Hsieh MT,Young MJ,et al.An external loop region of domain III of dengue virus type 2 envelope protein is involved in serotype-specific binding to mosquito but not mammalian cells[J].JVirol,2004,78(1):378-388.
