γ-突触核蛋白的克隆、表达及纯化
2011-01-25刘晓娟张力青翟方丽李慎涛
刘晓娟 张力青 李 健 翟方丽 李慎涛,2*
(1.首都医科大学基础医学院生物化学与分子生物学系;2.首都医科大学基础医学院免疫学系; 3.清华大学第一附属医院华信医院检验科)
1997年,Ji H等[1]通过cDNA直接差异测序法(direct-differential cDNA sequencing)分析克隆发现了一种新的基因——乳腺癌特异性基因1(breast cancer-specific gene 1,bcsg1)。该基因在乳腺癌cDNA文库中高表达,而在正常乳腺中几乎不表达[1]。它与神经蛋白突触核蛋白家族成员具有高度的同源性,其后证实它与从脑基因文库和cDNA文库分离的γ-突触核蛋白基因及persyn是同一基因,是突触核蛋白家族的第3个成员[2]。突触核蛋白是一个广泛分布于中枢神经系统突触前成分内的小分子可溶性蛋白质家族,由α-突触核蛋白(SNCA)、β-突触核蛋白(SNCB)和γ-突触核蛋白(SNCG)3个成员组成,是一组氨基酸序列及结构高度同源的天然伸展蛋白。目前,对于它们的生物学功能还未充分了解,有研究[3]表明它们与神经系统的发育及某些神经退行性疾病相关。
γ-突触核蛋白的异常表达与多种肿瘤的发生、发展有关,包括女性激素敏感性乳腺癌、卵巢癌,男性激素敏感性前列腺癌,消化系统肿瘤如食管癌、胃癌、肝癌、胰腺癌,以及肺癌、膀胱癌等[4-5]。虽然γ-突触核蛋白在各种肿瘤中的阳性率不同,但它们有个共同特点,除食管癌外,γ-突触核蛋白表达水平具有明显的期别相关性特征,即随病期进展,其表达率及表达强度渐增[6]。
人γ-突触核蛋白与小鼠和大鼠γ-突触核蛋白的一致性分别为87.7%和83.8%,与α-突触核蛋白、β-突触核蛋白和 synoretin的一致性分别为54%、56%和84%[7]。突触核蛋白家族序列具有高度相似性,都由一个氨基端脂质结合区域、一段11个残基的重复序列和一个酸性羧基末端组成[8]。氨基末端高度保守,在羧基末端,γ-突触核蛋白与α、β-突触核蛋白不同,缺乏2个16个残基的串联重复序列,仅保留了其强酸性的特点。高度保守的氨基端在脂质相互作用中起重要作用,强酸性的羧基末端具有类似分子伴侣活性的作用,介导蛋白质-蛋白质相互作用。突触核蛋白蛋白家族各成员结构的差异也将引起彼此间功能的差异,继而导致其在各种疾病中的不同作用[9]。
1 材料和方法
1.1 材料和试剂
人脑cDNA文库由清华大学医学院杨茂君教授惠赠;原核表达载体pGEX-6p-1、大肠杆菌克隆菌株DH5α及表达菌株BL21(DE3)均为本实验室保存; DNA聚合酶、各种限制性内切酶和T4 DNA连接酶购自NEB公司;DNA片段胶回收试剂盒、质粒提取试剂盒购自Omega公司;Glutathione SepharoseTM4B购自Amersham公司;Sephadex G25、Superdex 75 Hiload 16/ 60和Resource Q预装柱购自GE公司。引物合成及DNA测序由上海生工公司完成,Phenylmethylsulfonyl fluoride(PMSF),二硫基苏糖醇(DTT),异丙基硫代-β-D半乳糖苷(IPTG)均购自Sigma公司;胰蛋白胨和酵母提取物(LB)购自Oxoid公司;其他常用化学试剂均为分析纯,购自北京现代东方精细化学品有限公司。
制冷恒温摇床(Thermo公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司,JY92-2D);电泳仪(BIO-RAD,PowerPac3000);高速离心机(BECKMAN J2-HS);凝胶成像处理系统(GE healthcare ImageQuant 300);AKTA purifier蛋白纯化系统(GE公司);MALDI-TOF质谱仪(PE公司)。
1.2 方法
1)目的基因片段的扩增:根据GenBank报道的γ-突触核蛋白(NM_003087)序列,设计特异性引物,分别添加BamHI和XhoI酶切位点。以人cDNA文库为模板,PCR扩增γ-突触核蛋白的编码序列。将PCR产物进行1%琼脂糖凝胶电泳。
2)克隆及鉴定:将扩增的PCR产物用BamHI和XhoI双酶切,回收酶切后的片段,与经过同样双酶切的载体pGEX-6p-1按5:1摩尔比混合,在T4 DNA连接酶作用下于16℃连接过夜,用连接产物转化Ecoli DH5α,涂布到含氨苄青霉素(100 μg/mL)的LB平板上,于37℃培养过夜,次日,从LB平板上随机挑取5个菌落,接种于含氨苄青霉素(100 μg/mL)的LB培养基中,于37℃培养16 h,提取质粒,进行PCR鉴定,将PCR鉴定为阳性的质粒再进行酶切鉴定,将酶切鉴定为阳性的质粒测序。
3)诱导表达分析:用测序正确的质粒转化大肠杆菌BL21(DE3),随机挑取5个菌落,接种于含氨苄青霉素(100 μg/mL)的LB培养基中,于37℃培养过夜,次日,按1∶100的比例将过夜培养物转接到5 mL含氨苄青霉素(100 μg/mL)的LB液体培养基中,于37℃培养,当培养液OD600值达到0.6~0.8时,加入IPTG(终浓度1 mmol/L),诱导表达8~12 h,5 000 r/ min离心15 min收集菌体,取适量菌体用SDS-PAGE分析蛋白表达情况。
4)蛋白表达条件的优化及表达形式分析:分别对在不同温度、不同IPTG终浓度、培养液的不同OD600值及不同表达时间4种条件下诱导后的菌体取样进行SDS-PAGE,确定目标蛋白的最佳表达条件。在最佳表达条件下诱导目标蛋白表达,4 000 r/min离心15 min收集菌体,用 PBS(140 mmol/L NaCl、2.7 mmol/L KCl、10 mmol/L Na2HPO4·12H2O、1.8 mmol/ L KH2PO4)重悬菌体,4 000 r/min离心15 min,收集菌体,用PBS重悬菌体,加入溶菌酶(终浓度至1 mg/ mL)、DTT及PMSF(终浓度至1 mmol/L),冰上作用30 min后,在冰浴上超声至菌体完全裂解,15 000 r/ min离心50 min,上清和沉淀分别取样进行 SDSPAGE,确定目标蛋白的表达形式。
5)γ-突触核蛋白重组蛋白的诱导表达:将γ-突触核蛋白工程菌接种于40 mL含氨苄青霉素(100 μg/ mL)的LB液体培养基中,37℃振荡培养过夜,次日,按1∶100的体积比转接于1 L含氨苄青霉素(100 μg/ mL)的LB液体培养基中,于37℃培养,当培养液OD600值达到0.8时,加入IPTG(终浓度0.4 mmol/ L),于30℃下诱导表达11 h,5 000 r/min离心15 min收集菌体用于目标蛋白的纯化。
6)γ-突触核蛋白的纯化:将诱导表达的菌体用超声波破菌,离心收集上清,加到已用PBS平衡的Glutathione SepharoseTM4B亲和层析柱上,让其自然通过柱,然后用PBS洗涤杂蛋白,用酶切缓冲液(25 mmol/ L Tris、200 mmol/L NaCl、2 mmol/L DTT,pH 7.5)平衡柱,加入200 μL(1 mg/mL)PreScission蛋白酶,于4℃酶切过夜。次日,用洗脱缓冲液(25 mmol/L Tris-HCL、200 mmol/L NaCl、2 mmol/L DTT,pH 7.5)洗脱,收集穿过的蛋白样品,用15%的SDS-PAGE鉴定。
收集蛋白,用Sepherdex G25柱脱盐,缓冲液用阴离子交换A液(25 mmol/L Tris、50 mmol/L NaCl、2 mmol/L DTT,pH 8.0),随后将脱盐后的蛋白样品过Resource Q阴离子交换柱,所用缓冲液为:A液(25 mmol/L Tris、50 mmol/L NaCl、2 mmol/L DTT,pH 8.0)、B液(25 mmol/L Tris、1 mol/L NaCl、2 mmol/L DTT,pH 8.0)。收集含有蛋白质的组分,用 SDSPAGE鉴定,将含有目标蛋白质的组分合并,用浓缩管浓缩至适当的体积,加至Superdex 75 Hiload 16/60柱上,进行凝胶过滤纯化,所用缓冲液为凝胶过滤缓冲液(25 mmol/L Tris、200 mmol/L NaCl、2 mmol/L DTT,pH 8.0)。利用AKTA纯化仪随机软件对洗脱峰进行积分并估算蛋白质浓度。
7)目标蛋白的质谱分析:从SDS-PAGE胶上切取含有目标蛋白质的胶点,经还原烷基化消化后,用MALDI-TOF质谱仪进行肽质量指纹图谱(Peptide mass fingerprinting,PMF)分析。运用Mascot软件对PMF的结果与NCBI中的蛋白质库的理论图谱进行比较和评价,得出蛋白质的可能性分数,根据所用蛋白数据库来确定阳性的分数,从而判定是否为γ-突触核蛋白。
2 结果
2.1 γ-突触核蛋白表达载体的构建
PCR扩增得到了编码γ-突触核蛋白的DNA片段,经1%琼脂糖凝胶电泳鉴定,大小与预期的一致。将该片段和pGEX-6p-1载体连接后,转化大肠杆菌DH5α,挑取单菌落,经菌液PCR鉴定得到阳性克隆,经质粒酶切鉴定,得到阳性克隆,测序结果证实为γ-突触核蛋白编码序列。
2.2 诱导表达分析
γ-突触核蛋白工程菌在37℃、1 mmol/L IPTG的条件下诱导表达8~12 h,在破菌沉淀中可见相对分子质量约为39 000的特异性蛋白质表达条带,大小与预期的一致。
2.3 蛋白表达条件的优化
1)在培养液 OD600值等于0.8、IPTG浓度0.5 mmol/L条件下,分别在16℃、23℃、30℃及37℃诱导菌体表达目标蛋白,于诱导后7 h取样进行SDS-PAGE,结果表明30℃时目标蛋白的表达量最大(图1)。
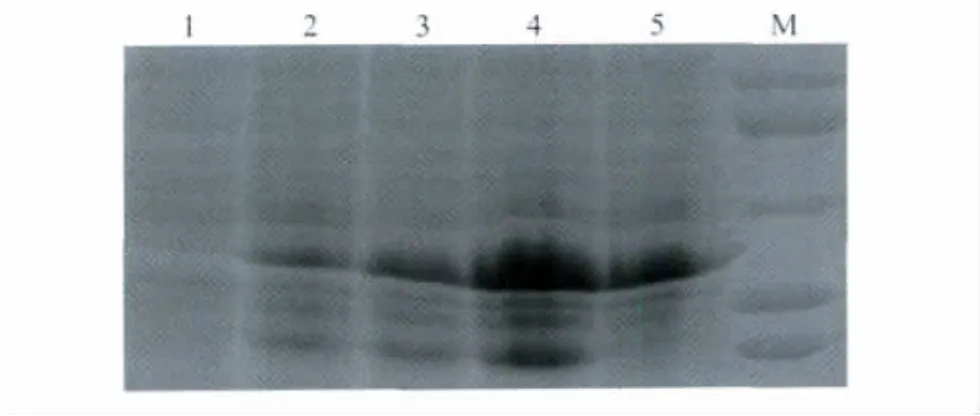
图1 目标蛋白在不同温度下诱导后的SDS-PAGEFig.1 SDS-PAGE analysis of target protein induced with IPTG at different temperature1:before induction;2:16℃;3:23℃;4:30℃;5:37℃;M:96 000,66 000,46 000,34 000,26 000;IPTG:isopropyl β-D-1-thiogalactopyranoside.
2)在培养液OD600值等于0.8、30℃条件下,用终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mmol/L的IPTG诱导菌体表达目标蛋白,于诱导后7 h取样SDS-PAGE,结果表明当IPTG终浓度为0.4 mmol/L时目标蛋白的表达量最大(图2)。
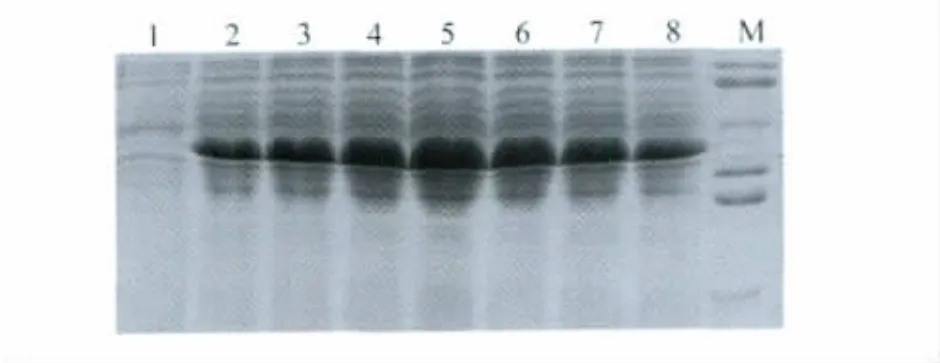
图2 目标蛋白在不同浓度IPTG诱导后的SDS-PAGEFig.2 SDS-PAGE analysis of target protein induced with different final concentration of IPTG1:before induction;2:0.1 mmol/L IPTG;3:0.2 mmol/L IPTG;4:0.3 mmol/L IPTG;5:0.4 mmol/L IPTG;6:0.5 mmol/L IPTG;7:0.6 mmol/L IPTG;8:0.7 mmol/L IPTG; M:96 000,66 000,46 000,34 000,26 000,16 000; IPTG:isopropyl β-D-1-thiogalactopyranoside.
3)在培养液OD600值等于0.8、30℃、IPTG终浓度为0.4 mmol/L条件下诱导菌体表达目标蛋白,于诱导后1 h、3 h、5 h、7 h、9 h、11 h、13 h取样SDS-PAGE,结果表明诱导后11 h目标蛋白的表达量最大(图3)。
4)在IPTG终浓度为0.4 mmol/L、30℃诱导条件下,在培养液OD600值分别为0.4、0.6、0.8、1.0、1.2时诱导菌体表达目标蛋白,于诱导后7 h取样SDSPAGE,结果表明当培养液OD600值为0.8时目标蛋白的表达量最大(图4)。
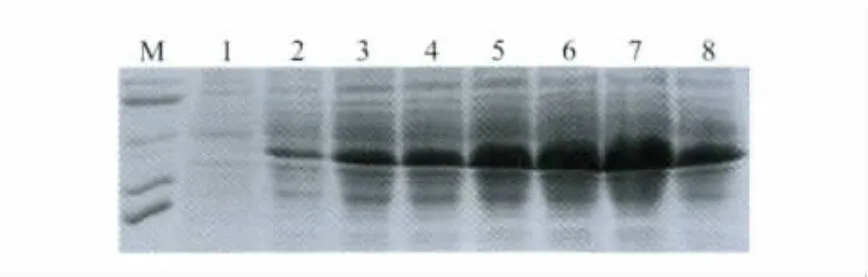
图3 目标蛋白在诱导后不同时间的SDS-PAGEFig.3 SDS-PAGE analysis of target protein induced with IPTG for different time1:Before induction;2:1 h;3:3 h;4:5 h;5:7 h;6:9 h; 7:11 h;8:13 h;M:96 000,66 000,46 000,34 000,26 000,16 000;IPTG:isopropyl β-D-1-thiogalactopyranoside.
由上述实验可知,γ-突触核蛋白在大肠杆菌中的最佳表达条件为:培养温度30℃、培养液OD600值等于0.8、IPTG终浓度0.4 mmol/L、诱导时间11 h。
2.4 蛋白表达形式分析
在最佳表达条件下诱导菌体表达目标蛋白后,用超声完全裂解菌体,SDS-PAGE表明,上清中含有大量目标蛋白,说明γ-突触核蛋白在大肠杆菌中可溶性表达。
2.5 蛋白纯化
将收集的菌体破碎、离心后,收集上清,进行Glutathione SepharoseTM4B亲和层析纯化,得到较高纯度的目的蛋白。利用阴离子交换进一步纯化目标蛋白,收集主峰各组分。合并后经电泳鉴定,得到较高纯度的目的蛋白(图5)。将含有目标蛋白的组分合并,用浓缩管浓缩至0.5 mL,再用分子筛层析进行进一步纯化,得到纯度较好的目标蛋白(图6)。
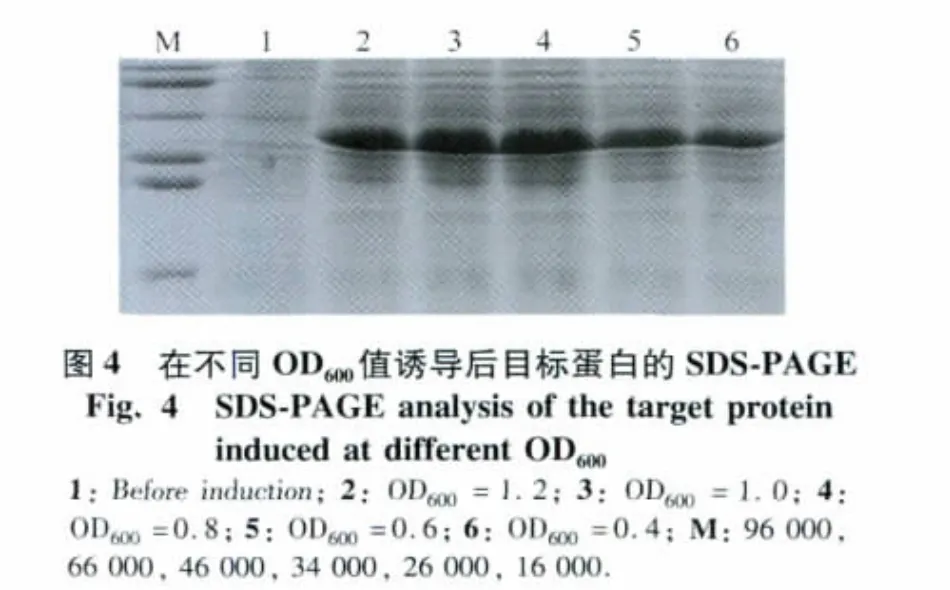
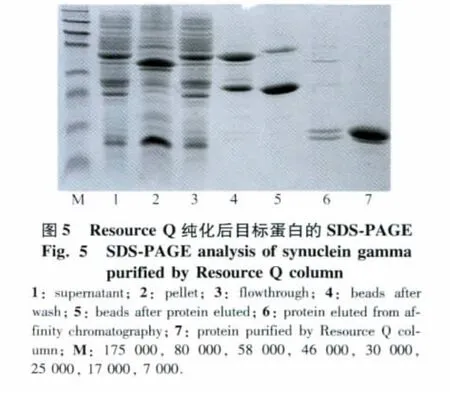

图6 分子筛纯化图及SDS-PAGE结果Fig.6 Purification profile of human synuclein gamma by Superdex 75 column and analysis by SDS-PAGEA:Purification profile on Superdex 75 Hiload 16/60;B:SDS-PAGE;1:fraction A3 of gel filtration; 2:fraction A4 of gel filtration;M:116 000,66 200,45 000,25 000,18 400,14 400.
2.6 蛋白的质谱鉴定
将样品SDS-PAGE胶点消化后,进行质谱分析表明,经数据库搜索,该蛋白与蛋白质库中γ-突触核蛋白的可能性分值为90。从蛋白水平证实该蛋白为γ-突触核蛋白(图7)。
3 讨论
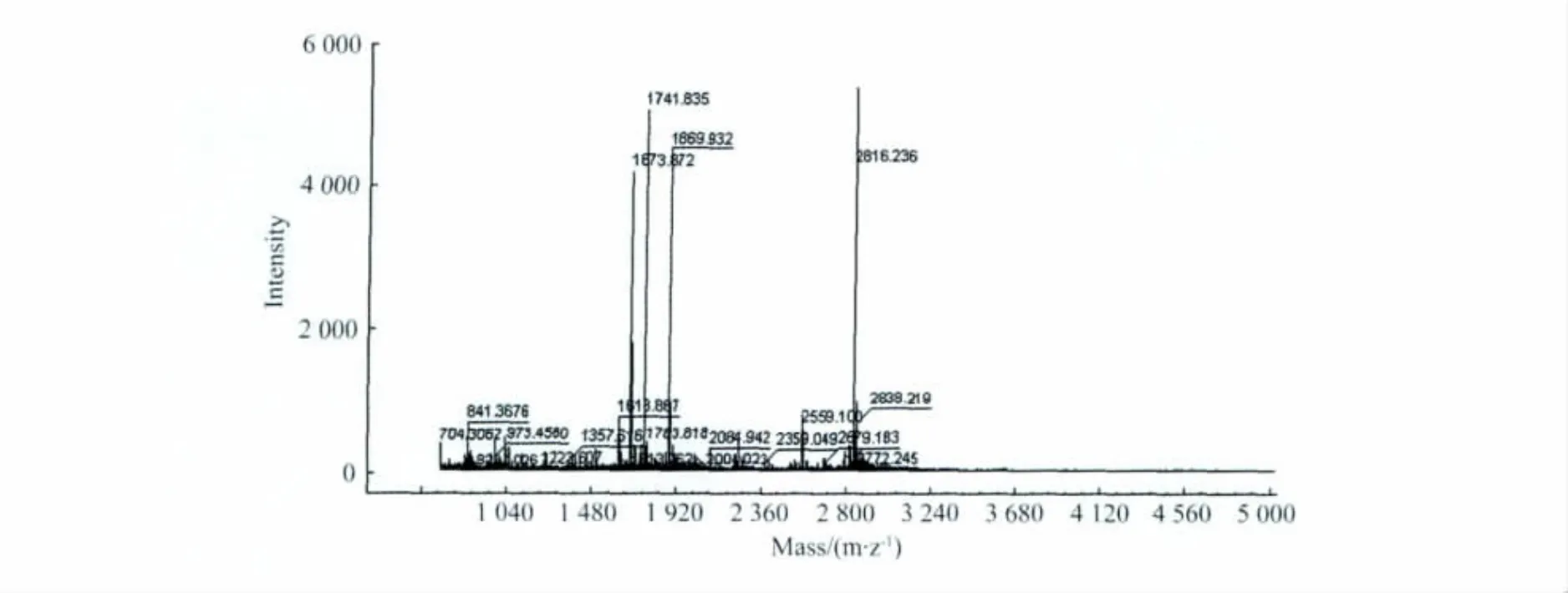
图7 蛋白的质谱分析结果Fig.7 The result of mass spectrography
γ-突触核蛋白作为一种全新的基因,因其独特的表达特点和病理机制正受到越来越多的关注。它在神经退行性疾病、视觉组织、嗅觉组织的一些病理状态和肿瘤发生发展过程中起作用。γ-突触核蛋白是一种提示肿瘤恶性表型和不良预后的分子标志物,在肿瘤分期、早期诊断、治疗中有重要作用。随着对该基因研究的逐步深入,它有可能成为某些肿瘤治疗的全新分子靶点,指导设计最优化和个性化的治疗方案,开发新药,逆转肿瘤恶化,改善预后,为肿瘤的攻克提供一个新的方向。但对其的研究工作仅得到一些初步结果,其在各种疾病中的功能仍需进一步探究。
本研究已成功地在大肠杆菌中表达了γ-突触核蛋白,并建立了纯化工艺,目前正在进行γ-突触核蛋白的晶体学及功能研究,试图从结构生物学的角度阐明γ-突触核蛋白的功能。
[1] Ji H,Liu Y E,Jia T,et al.Identification of a breast cancer-specific gene,BCSG1,by direct differential cDNA sequencing[J].Cancer Res,1997,57:759-764.
[2] Lavedan C,Leroy E,Dehejia A,et al.Identification,localization and characterization of the human gamma synuclein gene[J].Hum Genet,1998,103:106-112.
[3] Bruening W,Giasson B I,Klein-Szanto A J,et al.Synucleins are expressed in the majority of breast and ovarian carcinomas and in preneoplastic lesions of the ovary[J].Cancer,2000,88:2154-2163.
[4] Yanagawa N,Tamura G,Honda T,et al.Demethylation of the synuclein gamma gene CpG island in primary gastric cancers and gastric cancer cell lines[J].Clin Cancer Res,2004,10:2447-2451.
[5] Liu Y E,Pu W,Jiang Y,et al.Chaperoning of estrogen receptor and induction of mammary gland proliferation by neuronal protein synuclein gamma[J].Oncogene,2007,26:2115-2125.
[6] Wu K,Quan Z,Weng Z,et al.Expression of neuronal protein synuclein gamma gene as a novel marker for breast cancer prognosis[J].Breast Cancer Res Treat,2007,101: 259-267.
[7] Zhao W,Liu H,Liu W,et al.Abnormal activation of the synuclein-gamma gene in hepatocellular carcinomas by epigenetic alteration[J].Int J Oncol,2006,28:1081-1088.
[8] Liu H,Zhou Y,Boggs S E,et al.Cigarette smoke induces demethylation of prometastatic oncogene synuclein-gamma in lung cancer cells by downregulation of DNMT3B[J].Oncogene,2007,26:5900-5910.
[9] Surgucheva I,Park B C,Yue B Y,et al.Interaction of myocilin with gamma-synuclein affects its secretion and aggregation[J].Cell Mol Neurobiol,2005,25:1009-1033.
