PDCD5和TRAIL诱导胃癌细胞凋亡的实验研究*
2011-01-24王庆才
张 玲 王庆才
(泰山医学院附属泰山医院肿瘤内科,山东 泰安 271000)
肿瘤坏死因子相关凋亡诱导配体(TRAIL)[1]是TNF家族中诱导凋亡的分子之一,TRAIL通过与其特异性膜受体结合而诱导凋亡?其受体DR4、DR5在肿瘤细胞中高表达[2,3]研究发现 TRAIL能够选择性诱导肿瘤细胞凋亡。凋亡相关新基因PDCD5(TFAR19)[4], 是由北京大学人类疾病基因中心于1999年在国际上首先报道的一个人类新基因,较多证据表明PDCD5在肿瘤组织的表达低于正常组织[5]。
本研究进一步探讨PDCD5 和TRAIL分别及联合对胃癌细胞株MKN28细胞体外诱导凋亡的影响?为胃癌的治疗提供新的途径。
1 材料与方法
1.1 细胞培养
人胃癌细胞MKN28细胞购于第四军医大实验动物中心,在5%C02~37 ℃饱和湿度培养箱内孵育,一般3~4天用0.25%胰酶消化传代一次?
1.2 试剂
人可溶性PDCD5蛋白购于北京人类疾病与基因研究中心; TRAIL购于美国 peprotech公司;Annexin V细胞凋亡检测试剂盒购于广州长瑞生物技术有限公司;兔SP检测试剂盒购于中杉金桥;MTT购于Sigma公司。
1.3 药液的制备及分组
将人可溶性TRAIL及PDCD5蛋白稀释到所需浓度,TRAIL联合PDCD5组为PDCD5各组剂量给药外,每孔另加TRAIL蛋白200ng/ml(亚浓度),同时设置对照组
1.4 MTT实验
取处于指数生长期的人胃癌细胞株MKN28细胞,按照实验步骤用酶标仪在490nm处测定细胞OD值,计算抑制率(%)=(1-实验组OD/对照组OD)×100%,形态学观察用不同浓度的PDCD5和 TRAIL处理人胃癌细胞株MKN28在倒置显微镜下形态变化,并摄影
1.5 流式细胞仪检测细胞凋亡
将各浓度的PDCD5和 TRAIL分别加入培养细胞至预定时间后,按照实验步骤消化,吹打,收集待测细胞,细胞悬液,加入10Annexin V-FITC和5~10碘化丙啶,,孵育后,加入400ml1倍结合缓冲液后上机检测,利用流式细胞仪488 nm波长分析凋亡细胞,并设定PBS组对照
1.6 流式细胞仪分析细胞DNA含量
PDCD5和TRAIL蛋白处理过的MKN28细胞及对照组至预定时间后,依实验要求上机检测,用流式细胞仪测定细胞DNA结合PI的荧光强度,分析DNA含量和细胞周期。
1.7 AO/EB双染色
分别收集经PDCD5和TRAIL蛋白处理至预定时间的MKN28细胞及对照组细胞, 制备单细胞悬液, 加入AO和EB后显微镜直接观察,荧光显微镜510 nm激发波长观察。
2 结 果
2.1 倒置显微镜观察治疗前后各组细胞形态学变化
治疗前,胃癌MKN28细胞呈贴壁生长,生长旺盛,治疗后细胞部分变圆浮起,细胞间接触变松,间距增宽,增殖变慢,细胞中颗粒增多,细胞周围出现碎片。而且随着PDCD5和TRAIL蛋白浓度的升高,这种变化越发明显。在PDCD5联合TRAIL组最大浓度组中,70-80%的细胞变圆浮起,出现大量碎片。对照组变化不明显。(图1)

图1 200ng/ml TRAIL+20ug/mlPDCD5作用后的MKN28细胞
2.2 AO/EB双染色结果
AO/EB染色及荧光显微镜观察:不同浓度的TRAIL作用MKN28细胞后后,早期凋亡细胞表现为细胞体积缩小,胞核呈黄绿色,致密固缩浓染或碎片状,胞膜尚完整,胞质桔红色;而晚期凋亡细胞表现为,染色质被EB染成橙色呈固缩状或圆珠状;坏死细胞核染色质也被EB染成橙色或红色,但细胞核染色质结构尚正常。空白对照组未经TRAIL处理的正常活细胞核呈圆形,核染色质被AO染成均匀一致的绿色或黄绿色,核染色质呈正常结构。(图2)

图2 200ng/mlTRAIL+20ug/mlPDCD5作用后MKN28细胞
2.3 MTT细胞增殖活性结果
PDCD5作用于胃癌MKN28细胞,对胃癌细胞的抑制作用不明显,随着PDCD5蛋白浓度的升高对细胞的抑制率并不呈梯度增长的趋势,不具有剂量依赖性。与空白对照组差异不明显,不具有统计学意义(P>0.05);TRAIL蛋白作用于胃癌MKN28细胞,抑制率具有剂量依赖性(表1);PDCD5联合TRAIL组对胃癌MKN28细胞的抑制率最高(表2); TRAIL蛋白治疗组与空白对照组、PDCD5组、PDCD5联合TRAIL组相比较均具有统计学意义(P<0.05)。

表1 不同浓度不同时间TRAIL蛋白(ng/ml)作用胃癌MKN28细胞的抑制率

表2 PDCD5(ug/ml)联合TRAIL( ng/ml)蛋白在不同的时间作用于胃癌MKN28细胞的抑制率
2.4 流式细胞仪检测细胞凋亡率结果
流式细胞仪检测PDCD5单独作用于MKN28细胞未显示凋亡细胞群,经不同浓度TRAIL处理MKN28细胞,其凋亡率随着浓度的增高而升高,各实验组与对照组相比有统计学意义(P<0.05), 各组之间比较差异有统计学意义(P<0.05)。TRAIL联合PDCD5作用于细胞凋亡率显著增加,并具有剂量依赖性。
2.5 流式细胞仪检测DNA含量及细胞周期结果
MKN28细胞经TRAIL,TRAIL联合PDCD5作用后,细胞被阻滞于G0/G1,S期和G2/M期细胞数明显减少,细胞分裂受到抑制,凋亡率增加,DNA含量图可见,在DNA细胞周期峰前有一个亚二倍体峰,经凋亡程序软件分析,确认为凋亡峰。(图1~4)
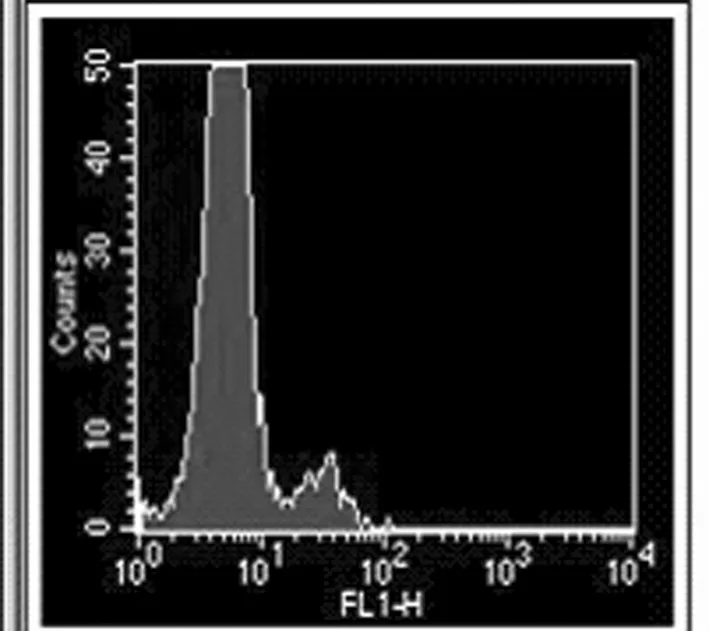
图1 50ng/ml TRAIL作用于MKN28细胞的凋亡率(Annexin V)

图2 50ng/ml TRAIL作用于MKN28细胞的凋亡率(DNA含量)
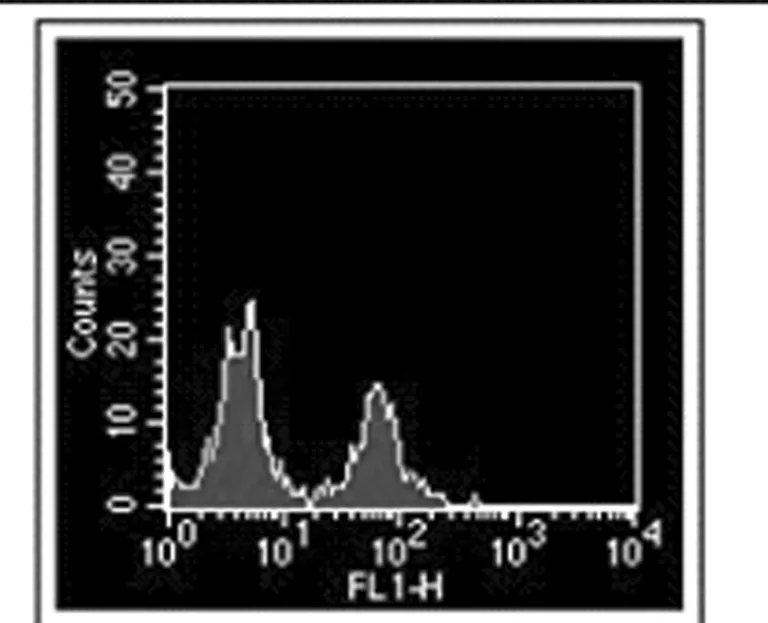
图3 200ng/ml TRAIL+ 40ug/mlPDCD5作用后细胞的凋亡率(Annexin V )

图4 200ng/ml TRAIL+ 40ug/mlPDCD5作用后MKN28细胞的凋亡率(DNA含量)
3 讨论
胃癌是我国最常见的恶性肿瘤之一,死亡率在恶性肿瘤中名列前茅。胃癌的发生与胃粘膜上皮细胞和胃癌细胞凋亡、增殖调控失衡有关。基因突变或基因表达失常是肿瘤发生的关键[6]。对凋亡相关基因及其表达产物与肿瘤关系的深入研究,在揭示肿瘤的发病机制、早期诊断、预防及治疗肿瘤方面均具有重要意义。
PDCD5及TRAIL均是近年新发现的凋亡相关基因。肿瘤坏死因子相关的凋亡诱导配体或凋亡素2配体是TNF家庭的新成员。TRAIL与新近发现的受体相结合启动细胞内的信号传导,具有大量、快速诱导凋亡的作用并且仅诱导转化细胞、肿瘤细胞发生凋亡,而正常组织细胞却对其不敏感,提示TRAIL在肿瘤治疗方面具有广阔的前景。PDCD5基因是人类新基因,参与细胞凋亡调控过程, 是一个表达广泛、进化保守的重要凋亡正调控基因,在多种肿瘤和白血病中表达下调,具有临床检测价值,并有可能作为肿瘤的凋亡促进剂应用于临床现研究证实.PDCD5和TRAIL在胃癌中的研究报道不多,两者联合检测实验更具有临床指导价值。
本实验结果显示,PDCD5作用于胃癌MKN28细胞,其抑制作用不明显,说明PDCD5蛋白质是TF-1细胞凋亡早期过程发挥作用的、凋亡相关基因所表达的凋亡相关蛋白。PDCD5蛋白为凋亡促进剂而非诱导剂[7],对细胞生物学特性影响较小,单独使用对细胞无毒性作用。实验结果同时表明,不同浓度的TRAIL均能抑制胃癌MKN28细胞细胞的增殖活性,对细胞生长的抑制呈时间和剂量依赖性。可以判断TRAIL在体外对胃癌MKN28细胞具有杀伤作用,可抑制肿瘤细胞的增殖。PDCD5联合TRAIL作用于 MKN28细胞进一步揭示了PDCD5与TRAIL协同作用的机制。此机制是提高了TRAIL对肿瘤细胞的敏感性,也就是与其死亡受体DR4, DR5mRNA的上调有关[8-9]。
总之,本实验对调亡相关基因的研究为胃癌的诊断及治疗提供了新的思路。为胃癌治疗的成功提供了科学依据,并且为发掘新的抗癌药物拓宽研究领域。但是,尚有许多问题需进一步阐明,如本实验的研究表明PDCD5在胃癌组织中的表达的规律, PDCD5在细胞凋亡过程中提高TRAIL对肿瘤细胞的敏感性的机制。细胞内还有哪些分子和PDCD5结合共同调控细胞的凋亡?以上问题尚待进一步研究阐明,也将为肿瘤及其它与凋亡调控异常相关疾病的病因全面揭示提供重要线索。
[1] Wiley SR,Schooley K,Smolak PJ,et al.Identification and character-ization of a new member of the TNF family that induces apoptosis[J].Immunity,1995,3(6):673-682.
[2] Greco FA, Bonomi P, Crawford J, et al. Phase 2 study of mapatumumab, a fully human agonistic monoclonal antibody which targets and activates the TRAIL receptor-1, in patients with advanced non-small cell lung cancer[J]. Lung Cancer,2008, 61(1):82-90.
[3] Schneider P,Thome M,Burns K ,et al.Receptors 1(DR4) and 2(DR5) signal FADD-dependent apoptosis and activate NF-kappaB [J].Immunity,1997,7(6):831-836.
[4] 马大龙,新细胞因子及细胞凋亡的发现与功能研究[J].北京大学学报(医学版),2002,34(5):488-492.
[5] Zhang YM,Wang Y,Xu QM,et al.Application of NF-kappaB reporter and Dual-Luciferase assays in the measure of bioactivity of interleukin-1 beta and interleukin-1 receptor antagonist[J].Bei jing Da Xue Bao,2006,38(6):653-656.
[6] K im S, Ch in K, Gray JW, et al. A screen for genes that suppress loss of contact inh ib it ion: ident ification of ING4 as a cand idate tum or suppressor gene in hum an can cer. ProcNat lA cad SciU S A, 2004,101: 16251-16256.
[7] 刘晓冬,侯毅鞠,李艳,等.胃癌组织中促凋亡因子PDCD5的表达及意义[J].肿瘤防治研究, 2011,38(5):?532-534 .
[8] Mitsiades CS,Treon SP,Mitsiades N,et al.TRAIL/Apo2L ligand selectively induces apoptosis and overcomes drug resistance in multiple myeloma: therapeutic applications[J].Blood, 2001,98:795-804.
[9] Greco FA, Bonomi P, Crawford J, et al. Phase 2 study of mapatumumab, a fully human agonistic monoclonal antibody which targets and activates the TRAIL receptor-1, in patients with advanced non-small cell lung cancer[J]. Lung Cancer,2008, 61(1):82-90.
