富马酸阿奇霉素的体内抗菌活性与安全性评价*
2011-01-24孙丰斌辛晓明赵晓民高允生
王 丽 孙丰斌 米 宁 辛晓明 赵晓民 高允生
(1.泰山医学院药理学教研室,山东 泰安 271016;2.山东泰邦生物制品有限公司,山东 泰安 271016)
阿奇霉素(azithromycin,AM)为15元环大环内酯类抗生素,抗菌作用机制与红霉素相似,抗菌谱较广,具有细胞渗透性强、半衰期长等药动学特点,对革兰阳性菌、革兰阴性菌、支原体、衣原体、厌氧菌等均具有较强抗菌作用,临床广泛应用于呼吸系统、泌尿生殖系统、皮肤和软组织感染[1,2]。富马酸阿奇霉素(azithromycin fumarate,AMF)为AM的富马酸盐(商品名:亿松),是由山东诚创医药技术开发有限公司与山东德药制药股份有限公司研制生产水溶性口服制剂。本文以红霉素(erythromycin, EM)为对照,对AMF和AM的体内抗菌活性进行了比较研究,并对AMF的安全性进行评价。
1 材料与方法
1.1 材 料
1.1.1药品 AMF由山东诚创医药技术开发有限公司提供,批号970406,效价828.6 U?mg-1;AM由山东齐鲁制药厂提供,批号940422,效价957 U?mg-1;EM由大连制药厂生产,批号950604,效价1000 U?mg-1。三种药物均用0.5%羧甲基纤维素纳(CMC)在使用前配制成混悬液供实验用。AMF按其所含AM计算剂量。
1.1.2菌株 金黄色葡萄球菌(26001,金葡菌)和乙型溶血性链球菌(32210-11,链球菌),均为泰安市区临床分离的致病菌,由泰山医学院微生物学教研室鉴定和提供。
1.1.3动物 昆明种小白鼠,空腹体重18~22 g,由山东省卫生防疫站实验动物中心提供,合格证号:鲁动质950103。实验前禁食供水12 h。
1.2 体内抗菌实验[3]
1.2.1菌液制备
取临床分离的致病金葡菌和链球菌,分别接种于2 ml肉汤培养基中,37℃孵育6 h;取0.1 ml转种于10 ml肉汤培养基中,37℃孵育18 h,得实验用菌原液。菌原液用5%胃膜素进行低比值系列稀释,得实验用感染菌液。
1.2.2感染菌量预试
取空腹体重18~22 g小鼠分为若干组,每组4只,分别腹腔注射(ip)不同浓度的金葡菌或链球菌感染菌液,每鼠0.5 ml。观察48 h内各组小鼠存活情况,分别确定两种致病菌对感染小鼠的最小100%致死菌量(MLD)。
1.2.3金葡菌全身感染小鼠的实验治疗
取空腹体重18~22 g小鼠190只,♀♂各半,按1 MLD菌量每鼠ip金葡菌液0.5 ml制备全身感染模型。将感染小鼠按性别和体重随机分为19组,每组10只。其中,用AMF、AM、EM灌胃给药(ig)治疗各6个剂量组,0.5%CMC空白对照1组。AMF、AM和EM各实验治疗组的给药剂量根据预试验结果确定,三种药物相邻剂量组间的公比均为0.75,AMF各组剂量分别为15.0、19.9、26.6、35.4、47.3、63.0 mg?kg-1体重,AM各组剂量分别为26.6、35.4、47.3、63.0、84.0、112.0 mg?kg-1体重,EM各组剂量分别为53.8、71.7、95.6、127.5、170.0、226.7 mg?kg-1体重。各组每次ig容量均为20 mg?kg-1体重,分别于感染后即刻和6 h后各给药一次,空白对照组同法给予等容量0.5%CMC。定时观察记录7天内各组小鼠的反应和死亡情况,对观察期内死亡小鼠立即进行解剖观察。
1.2.4链球菌全身感染小鼠的实验治疗
小鼠感染链球菌、分组、实验治疗和观察方法均与“1.2.3”相同。小鼠感染后,AMF各组治疗剂量分别为8.4、11.2、15.0、19.9、26.6、35.4 mg.kg-1体重,AM各组剂量分别为10.1、13.5、18.0、24.0、32.0、42.5 mg?kg-1体重,EM各组剂量分别为22.5、30.0、40.0、53.3、71.1、94.8 mg?kg-1体重。
1.3 急性毒性实验[4]
取空腹体重18~22 g小鼠70只,♀♂各半,按性别和体重随机分为7组,每组10只。其中,6组单次ig不同剂量的AMF,1组同法给予等容量0.5%CMC。根据预试结果,AMF最高和最低剂量组分别为4833.6和2144.7 mg?kg-1体重,各剂量组间公比为0.85,各组ig容量均为20 mg?kg-1体重。给药后即刻观察动物反应,并定时观察记录7 d内小鼠的毒性症状及死亡情况,对观察期内死亡小鼠立即进行解剖观察。
1.4 数据处理
应用DAS ver 1.0软件包,按Bliss法分别计算AMF、AM、EM治疗金葡菌和链球菌感染小鼠的半数有效量(ED50)及其95%可信限,小鼠AMF急性毒性实验的半数致死量(LD50)及其95%可信限。计算AMF的化疗指数(CI),CI= LD50/ ED50。各药物间ED50比较采用t检验。
2 结 果
2.1 对全身感染小鼠的保护作用
在观察期内,金葡菌和链球菌感染的对照组小鼠全部死亡,其平均存活时间(n=10)分别为18.70 ± 6.20 h和20.35 ± 6.51 h。各剂量AMF、AM、EM治疗组小鼠,在7d观察期结束时均有部分或全部动物存活,表明三种药物对金葡菌和链球菌全身感染小鼠具有保护作用。根据三种药物的ED50,AMF和AM对金葡菌和链球菌感染小鼠的体内抗菌活性均优于EM(P<0.01)。AMF治疗组与AM组比较,AMF对金葡菌感染的治疗作用优于AM(P<0.01),而两药对链球菌感染的治疗作用无明显差异(P>0.05)。结果见表1。
对各药物治疗组和空白对照组死亡小鼠进行解剖观察,可见前肢皮下淋巴结及颌下淋巴结肿大,十二指肠及其相邻空肠有3~7 cm不同长度的坏死,其他脏器和组织未见明显异常。各药物治疗组与空白对照组死亡小鼠的剖检结果无明显差异。
表1 富马酸阿奇霉素(AMF)、阿奇霉素 (AM)和红霉素(EM)对感染致病菌的小鼠的体内的抗菌活性
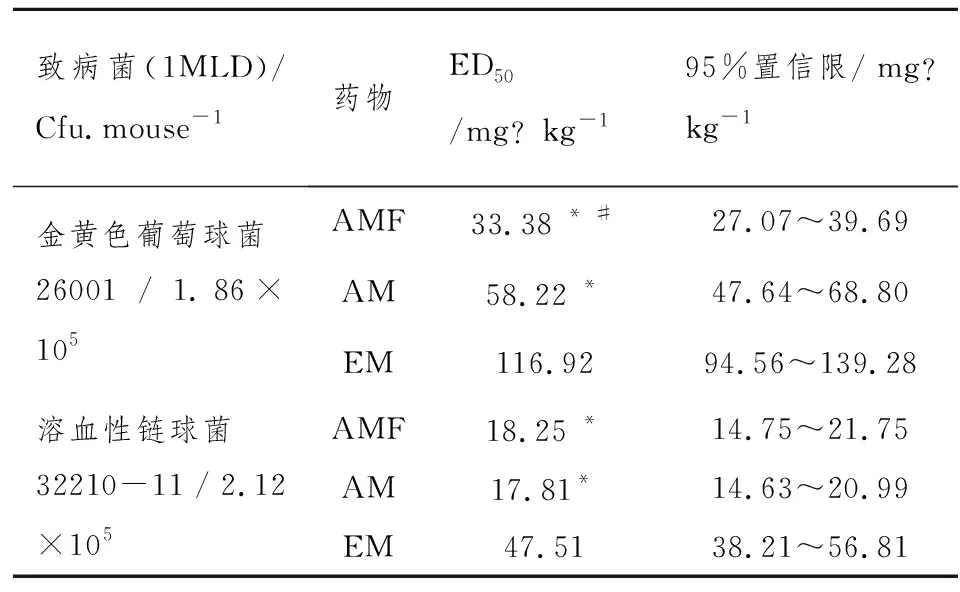
致病菌(1MLD)/Cfu.mouse-1药物ED50/mg?kg-195%置信限/ mg?kg-1金黄色葡萄球菌 26001 / 1.86×105 AMF33.38 * #27.07~39.69AM58.22 *47.64~68.80EM116.9294.56~139.28溶血性链球菌32210-11 / 2.12×105AMF18.25 *14.75~21.75AM17.81*14.63~20.99EM47.5138.21~56.81
*P<0.01 vs EM ;#P<0.01 vs AM
2.2 小鼠ig AMF的急性毒性
对照组小鼠在观察期结束时全部存活,食欲及活动情况正常。各剂量AMF组在ig后约0.5h,小鼠表现为自发活动减少,俯卧。给药后1.5~7h,多数动物出现呼吸急促或困难,四肢痉挛或惊厥,部分动物在给药后1~4 d内死亡。各剂量组小鼠的毒性反应强度、死亡速度和死亡率均与药物剂量呈正相关,其LD50为3273.4 mg?kg-1体重,95%可信限为 2834.6~3780.1 mg?kg-1体重。死亡小鼠进行解剖观察未见脏器组织异常。
2.3 小鼠ig AMF的化疗指数
根据AMF的LD50和ED50计算,其对金葡菌和链球菌感染小鼠ig的化疗指数分别为98.1和179.4。
3 讨 论
AM是具有独特抗菌活性和药动学特点的大环内酯类抗生素。其不仅抗菌谱较广,抗菌活性较强,抗菌后效应明显,而且对酸稳定,生物利用度高,半衰期长,组织细胞内分布浓度高,并能向感染病灶组织靶向转运和分布,临床用药方便,疗程短[1,2,5,6]。这些特点使阿奇霉素在临床得到越来越广泛的应用,已有多种新制剂和新剂型用于临床。AMF为新研制生产的水溶性口服制剂,为方便临床治疗提供了新的有效药物。
体内抗菌实验结果显示,AMF、AM和EM灌胃给药对小鼠实验性全身感染模型均具有显著的治疗保护作用。三种药物的ED50比较,AMF和AM对金葡菌感染的体内抗菌活性分别是EM的3.5倍和2.0倍,对链球菌感染的体内抗菌活性分别为EM的2.6倍和2.7倍,与文献报道的研究结果相一致[7-9]。AMF与AM治疗感染小鼠的ED50比较,AMF对金葡菌感染的体内抗菌活性为AM的1.74倍,差异具有统计学意义(P<0.01);对链球菌感染的治疗作用两药无明显差异(P>0.05)。
小鼠ig AMF的LD50为3273.4 mg?kg-1,按体重计算相当于人每日临床用量(250~500 mg)的455~909倍。其ig治疗金葡菌和链球菌感染小鼠的化疗指数分别为98.1和179.4。此体内抗菌活性和急性毒性研究表明,AMF具有显著抗菌活性和良好的安全性,其对致病金葡菌和链球菌感染的疗效优于AM或相同,提示其具有良好的临床应用前景。
[1] 张石革,孙定人. 新药临床药理与应用手册[M]. 北京:化学工业出版社,2001:689-690.
[2] 吕昭云,岳天辉,李淑斌,陈大为. 国产阿奇霉素的临床疗效及安全性[J]. 中国医院药学杂志,2004,24(5):305-307.
[3] 张淑华,徐志中,王浴生. 细菌性全身感染动物模型的实验治疗[M]// 徐叔云,卞如濂,陈修. 药理实验方法学. 第3版. 北京:人民卫生出版社,2001:1664-1666.
[4] 程鲁榕,宋书元. 急性毒性实验[M]// 徐叔云,卞如濂,陈修. 药理实验方法学. 第3版. 北京:人民卫生出版社,2001:227-229.
[5] Blandizzi C, Malizia T, Batoni G, et al. Distribution of azithromycin in plasma and tonsil tissue after repeated oral administration of 10 or 20 milligrams per kilogram in prediatric patients[J]. Antimicrob Agents Chemother, 2002,46(5):1594-1596.
[6] 李蓉凌,张先洲.阿奇霉素临床应用分析[J].中国医院药学杂志,2006,26(9):1132-1134.
[7] 孙曼琴,康子胜,许军,等. Azithromycin的体内抗菌作用研究[J]. 中国抗生素杂志,1995,20(5):362-436.
[8] 宋秀杰,刘又宁.20种抗菌药物对肺炎链球菌的体外抗菌活性研究[J].中国抗生素杂志,2010,7(1):20-23.
[9] 颜天华,卢是月,黎露刚,等. 国产注射用枸橼酸阿奇霉素体内外抗菌作用研究[J]. 中国医药导刊,2004,6(3):195-196.
