脊柱手术中皮层体感诱发电位基准的选择*
2011-01-24范新成
刘 峰 范新成
(泰山医学院附属泰山医院,山东 泰安 271000)
CSEP是目前脊髓监护中最常应用的电生理技术,特别在脊柱侧凸矫正术中应用率最高。研究表明[1],1.6%患者的神经系统在手术过程中受到损伤,而其中的72%案例可在监护过程中预测。在美国,约75%的脊柱手术患者进行了脊髓监护,而且监护记录具有法律效应[2]。但CSEP由于受许多因素影响,易产生假阳性。如何提高脊髓监护的准确性,增加手术安全性,已逐渐引起人们的关注。本研究通过对脊柱手术术中脊髓监护波形变化的回顾性分析,旨在探索不同类型的脊柱手术的监护基准特点和报警标准,降低假阳性率,从而提高脊髓监护的可靠性。
1 资料与方法
1.1 临床资料
本组76例,男43例,女33例;年龄14~72岁,平均49岁。其中脊柱侧凸患者38例,脊髓型颈椎病12例,胸椎黄韧带骨化症21例,脊柱骨折脱位15例。将术前有神经功能缺陷的58例为A组;B组无神经功能缺陷18例。神经功能缺陷标准定为有以下之一者:①有感觉、运动障碍;②肌肉萎缩、肢体变细;③反射亢进,有病理征;④大小便功能障碍;④影像学合并有脊髓空洞、脊髓拴系、Chiari畸形等。
1.1.1手术方法 63例后路矫正植骨融合,9例一期前路松解,二期后路矫正植骨融合;4例前路松解并矫正植骨融合。后路内固定采用椎弓根钉(椎板钩)-棒系统。
1.1.2麻醉方法 采用静脉吸入复合麻醉,力月西、仙林、芬太尼、福尔利诱导麻醉,瑞芬持续滴入,术中持续吸入异氟醚,仙林间歇静脉。术中麻醉深度和其它主要生理参数保持稳定。
1.2 CSEP术中监护
1.2.1室温22℃-25℃。采用Dantec公司Keypoint型肌电图诱发电位仪。刺激电极分别置于左右踝后部胫后神经走行处,刺激频率3Hz,波宽0.2ms,刺激电流范围10~30mA,强度以拇趾微动为度。刺激强度一经确定,整个监护过程保持恒定。头皮接收电极按脑电图学会制定系统(10~20系统),记录电极为Cz点(中央点:两耳连线与头颅冠状线之交点),参考电极为FPz点(额极点:两眉弓连线与头颅冠状线之交点),每次平均叠加100次,刺激电极为鞍状电极,参考电极为针式电极。
1.2.2观测方法 将监护期分为预测试期、调整期、重点监护期、报警期。摆好体位,安装监测装置,为预测试期,了解P40波形的潜伏期和基本形态。麻醉成功和暴露完全后分别间断监测,判断稳定性,此阶段为调整期。以置椎弓根钉或行椎管探查减压开始后为重点监护期。对应基准分别为I期、Ⅱ期、、Ⅲ期基准,I期基准为麻醉前的波形; Ⅱ期基准为麻醉成功后切皮之前的波形; Ⅲ期基准为置椎弓根钉或行椎管探查减压等有潜在损伤脊髓神经的操作前的波形;Ⅳ期基准为报警前的即时校正波形,为因时而异,综合分析制定的波形,也可称为报警基准。按照不同时期的基准记录所发生的报警次数;应用报警基准,记录A、B两组监护过程中报警次数,停止手术立即行唤醒试验,判断真假阳性并计算假阳性率。
1.2.3报警 CSEP异常标准为波幅下降50%或潜伏期延长10%。在重点监护期中如果进行有可能损伤脊髓神经的操作时或10分钟以内出现,立即报警。由于脊柱侧凸矫形手术时间长,各种影响因素在所难免,特别是出现麻醉不平稳、出血过多血压不稳、体温波动大,电刀及其它电器干扰等,波形出现较大变化,甚至达到报警标准,此时应该同麻醉师及手术者交流,仔细分析原因,如果在10分钟以内无危险操作,可不必停止手术或唤醒试验。如果此波形以后较稳定,应行基准调整即应用Ⅳ期基准。
1.3 统计学分析
应用SPSS12.0软件,分析不同条件下的报警率和假阳性率,对数据进行卡方检验分析。
1 结 果
按不同的基准,报警次数不同。I期基准最多,四期基准报警率之间有显著性差异,Ⅳ期基准的报警符合率最高(表1)。按Ⅳ期基准,A与B两个报警基准组的假阳性率之间有显著性差异,有神经功能缺陷 A组假阳性率高于B组(表2)。
表1 76例患者按照不同时期的基准所发生的报警次数和假阳性率

I期基准Ⅱ期基准Ⅲ期基准Ⅳ期基准(报警基准)报警次数68322114报警率89.5%●43.1%●27.6%●18.4%●符合率7.4%▲15.7%▲27.8%▲35.5%▲
注:报警率=报警次数/76;符合率=真阳性数(5)/报警次数。●经卡方检验,四期基准报警率之间有显著性差异,卡方值为74.146,P<0.01;▲四期基准的报警符合率之间有显著性差异,P<0.01, Ⅳ期基准的报警符合率最高。
表2 应用报警基准A、B两组监护过程中报警次数和假阳性率
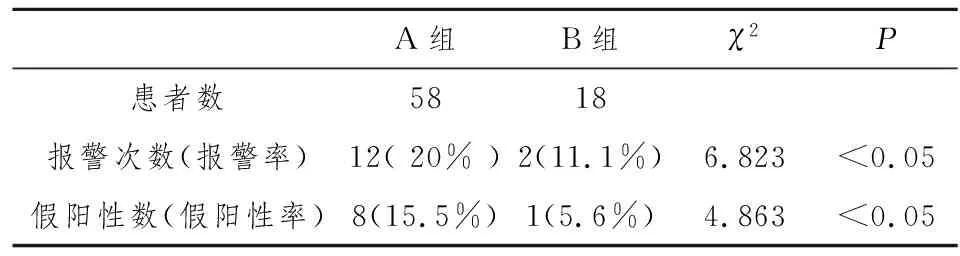
A组B组χ2P患者数5818报警次数(报警率) 12( 20% )2(11.1%)6.823<0.05假阳性数(假阳性率)8(15.5%)1(5.6%)4.863<0.05
注:报警率=报警次数/患者数;假阳性率=假阳性数/患者数
两组共报警14次,均停止手术,立即行唤醒试验,判断有5次为真阳性,其中3次在畸形矫正阶段,1次放置胸椎椎板钩后,1次在控制性低血压状态下,行胸廓矫形多条肋骨切除后,发生后针对原因,采取措施,包括减少矫正度数、椎板钩取出、输血回升血压、甲基强的松龙冲击治疗等。3例很快恢复至基准水平,术后无新的神经功能异常,2例部分恢复至基准水平,术后2周,除1例一侧足外展肌力下降外,均恢复正常。余9次唤醒试验正常,定为假阳性,将基准重新调整后,波形一直稳定,未发生再次报警。本组病例仅出现1例假阴性患者,为先天性脊柱侧凸,左侧下肢较对侧细。在预测试期和调整期不能监测到稳定的基准,在重点监护期曾出现一侧肢体的CSEP波幅降低,但没有达到50%未报警,术后该侧肢体,肌力由术前5级降至2级,CT发现有一椎弓根钉进入椎管内,再次手术取出,行侧凸返修术,半年后恢复至4级。
3 讨 论
神经系统损伤是脊柱畸形矫形中较严重的并发症。唤醒试验等术中神经功能检查方式不能满足实时、重复监测的要求,往往发现异常时损伤已难以挽回。CSEP能正确对脊髓功能做出定性和定量分析,判断可逆性脊髓损伤的病情演变,已成为脊髓损伤和评价脊髓功能的重要手段[3]。随着神经电生理的发展,术中监护的应用价值已广泛接受,它能时刻提醒术者,以避免损伤脊髓,能够最大程度上确保在脊髓永久性损伤之前采取纠正措施。采用诱发电位进行术中、术后神经功能的持续监测,是避免这一严重并发症的重要手段。国际脊柱侧凸研究协会和欧洲脊柱畸形协会对51000例脊柱侧凸手术行脊髓监测证实[4],术后发生神经损伤而术中没有SEP改变者(假阴性)仅为0.63%,其余术后有神经损伤者均伴有CSEP改变。本组患者出现一例假阴性,由于样本量较小,未做统计学分析。
如何设定CSEP的潜伏期和波幅基准值是CSEP检测的前提。在手术操作的不同阶段:麻醉、暴露、置钉、转棒、压缩、撑开、旋转、切肋骨时风险大不相同。胡勇[5]等认为以脊柱手术暴露后的CSEP作为监护基准稳定性及可靠性较好。本研究将监护期分为预测试期、调整期、重点监护期、报警期。对应基准分别为I期、Ⅱ期、Ⅲ期、Ⅳ期基准,并将Ⅳ期基准为报警前的即时校正波形,为因时而异,综合分析制定的波形,称为报警基准。预测试期和麻醉成功后的调试期,监测波的潜伏期和波幅变化较大,不能过早的确定基准,由于手术时间较长,受温度、血压、失血量、外界环境等影响,在非关键期容易出现变化,基线需做即时调整,如果确定基线发生了变化,应在5分钟左右重复测量,相应调整,否则会出现报警过频,本研究中,如果按I期、Ⅱ期期基准,报警率分别达到89.5%和43.1%,若全部报警则会严重影响手术进程;在重点监护期应用Ⅲ期、Ⅳ期基准,报警率下降而符合率明显提高。报警基准一旦确立,调整要慎重,需要和手术者、麻醉师密切配合。报警过频繁影响手术进程,知情不报更易铸成大错。
患者有无神经功能缺陷也直接影响监护的准确性,本研究已证实有神经缺陷较无神经缺陷的脊柱侧凸,CSCP假阳性率高。因此术前应评价脊髓的神经功能,神经功能较差时,轻度的再损伤,可使脊髓功能有较严重的损害,这就提醒在术中更加仔细,并研究对策,防范意外的发生,提前准备甲强龙等药物。有许多神经-肌肉型脊柱侧凸,术前CSEP波形隐约,不能辨认,术中监测的效能大大折扣,在研究中出现的1例假阴性患者,就有神经功能障碍。因此需要术中联合CSEP、MEP监测,必要时唤醒试验。有报道[6~8]显示,联合SEP、MEP监测无论对特发性脊柱侧凸患者还是合并脊髓异常的脊柱畸形患者都是安全、有效、准确的监测方法。尤其对特发性脊柱侧凸患者监测的假阳性低至0.014%,无假阴性,敏感性为98.6%。MEP有可靠的理论基础,特别对脊髓缺血性病变有更广阔的使用价值[9]。选择能同时监测脊髓感觉和运动功能的监护技术,可较好的减少假阳性和假阴性,使脊柱手术越来越安全
手术方案的制订应根据脊柱侧凸的种类、Cobb角度、有无合并后凸、旋转程度等,并结合脊柱的僵硬程度、椎体的骨质、内固定金属的刚性和弹性质量、预测残留的侧弯度数,兼顾代偿弯和身体平衡情况、神经的承受能力。本组出现的3例阳性报警,均由矫正度数过大,超过了脊髓神经的承受能力。一期前路松解和后方关节突切除、术前牵引,可使矫正更加安全,并能减少融合节段。
在实施CSEP监护过程中,应充分考虑其干扰因素。首先麻醉是最重要的影响因素。常用的吸入麻醉药如安氟醚、异氟醚、地氟醚、笑气等对CSEP均有较强的抑制作用[10]。特别是异氟醚对脊髓有明显的抑制作用,可使CSEP的潜伏期明显延迟[11]。Rampil[12]的研究提示,麻醉只需单独作用于脊髓即可抑制大鼠对疼痛刺激的保护性反射,并不依赖皮层、丘脑及延髓,其单突触和多突触的脊髓反射均易被异氟醚抑制。其次是温度的影响,Nuwer等[13]认为,神经传导速度有赖于温度,体温下降,则CSEP潜伏期延长。另外,影响脊髓实时监测的另一个主要问题是电刀所产生的干扰。当电刀被使用时,记录的信号会充分饱合,无法得到此时的监测信号,形成监护盲点。诱发电位的潜伏期由神经纤维的传导速度决定,而波幅是由神经元的数量和反映的同步性所决定。当脊髓有压迫时波幅和潜伏期都发生变化,如果只是牵拉所致的暂时缺血,可造成参加反应的纤维数量下降,引起波幅下降;麻醉和温度则对潜伏期影响更大,因此认为波幅下降和潜伏期延长的敏感性,要综合分析判断,因时而异。
[1] Dawson EG,Sherman JE,Kanim LE,et al. Spinal cord monitoring: results of the Scoliosis Research Society and European Spinal Deformity Society survey[J].Spinal,1991,16(8 suppl):s361-364
[2] 刘峰,朱海涛,范新成,等.颈脊髓急性压迫性损伤试验模型神经电生理学分析[J].中华物理医学与康复杂志,2008,10:671-675
[3] Blinder J, El-Mansouri M, Connelly NR. Survery of anesthesia practice in spine surgery patients in the United States[J].J Anesth ,2003,17(1):8-12.
[4] Kochs E, Scharein E, Mollenberg O, et al. Analgesic efficacy of low-dose ketamine[J].Somatosensory-evoked responses in relation to subjective pain ratings[J].Anesthesiology,1996,8(2):304-314
[6] 胡勇,胡从云,陆瓞冀. 脊柱侧凸矫形术中脊髓监护基准的选择[J] .中华骨科杂志.2000,20(9):555-558.
[7] MacDonald DB, AlZayed Z, Khoudeir I, etal. Monitoring scoliosis surgery with combined multiple pulse transcranial electric motor and cortical somatosensory-evoked potentials from the lower and upper extremities [J].Spine,2003,28(2):194-203.
[8] Pelosi L, Lamb J, Grevitt M, etal. Combined monitoring of motor and somatosensory evoked potentials in orthopaedic spinal surgery [J].Clin Neurophysiol,2002,113(7):1082-1091.
[9] Padberg AM, Wilson-Holden TJ, Lenke LG, etal. Somatosensory- and motor-evoked potential monitoring without awake-up test during idiopathic scoliosis surgery. An accepted standard of care[J].Spine,1998,23(12):1392-1400.
[10] 沈康平,叶晓健,贾宁阳等.脊髓前动脉损伤后运动诱发电位变化与病理学对照研究[J].中国矫形外科杂志,2002,9(6):682-684.
[11] Schindler E,Muller M,Zickmann B,et al.Modulation of somatosensory evoked potentials under various concentrations of desflurane with and without nitrous oxide[J].J Neurosurg Anesthesiol,1998,10(4):218-223
[12] 申新,叶平安.异氟醚麻醉下人躯体感觉诱发电位的改变[J].临床麻醉学杂志,2001,17(6):306-308.
[13] Rampil IJ.Anesthetic potency is not altered after hypothermic spinal cord transaction in rats[J].Anesthesiology,1994,80(3):606-610.
[14] Nuwer MR. Spinal cord monitoring [J]. Muscle Nerve,1999,22(12):1620-1630.
