丙型肝炎病毒高变区1中介导感染的关键氨基酸残基鉴定
2011-01-24解冰劳文光刘文宇关默刘小青陶清源王岩赵平戚中田
解冰,劳文光,刘文宇,关默,刘小青,陶清源,王岩,赵平,戚中田
第二军医大学微生物学教研室,上海 200433
丙型肝炎病毒(hepatitis C virus,HCV)主要经血液传播,是引起急、慢性肝炎的重要致病因子。目前全球约有1.7亿人感染HCV,大多数为慢性感染,部分感染者可发展为肝硬化和肝细胞癌,对人类健康造成了严重危害[1]。α干扰素联合利巴韦林标准治疗方案的疗效因HCV基因型不同而差异显著,对1型感染的持久应答率不到50%[2]。HCV基因组高度变异,其中介导HCV侵入细胞的包膜蛋白编码基因变异性最高,由此导致的免疫逃避是HCV能在宿主体内持续感染的重要机制,这也使得疫苗研究一直未有实质性进展[3]。高变区1(hypervariable region 1,HVR1)位于HCV包膜E2蛋白氨基端,由27个氨基酸残基组成。HVR1是HCV包膜E2蛋白与B类I型清道夫受体(scavenger receptor class B type I,SR-BI)结合必不可少的功能区域[4],也是诱导中和抗体及参与HCV免疫逃避的关键部位[5,6]。由于HVR1的序列高变,目前尚不清楚其结构与生物学功能的对应关系。
HCV假病毒(HCV pseudoviral particle,HCVpp)表面镶嵌有功能性HCV包膜蛋白,内部的结构蛋白为人类免疫缺陷病毒(human immunodeficiency virus,HIV)或小鼠白血病病毒(murine leukemia virus,MLV)的核衣壳蛋白及反转录酶,核心为编码报告基因及病毒包装信号的RNA[7,8]。HCVpp感染特性与HCV相似,是研究HCV侵入细胞机制的重要模型[7,8]。本研究以HCV1a亚型(H77株)为模板,对HVR1进行一系列缺失突变,制备各缺失突变体的HCVpp,分析不同突变对其感染力的影响,鉴定出HVR1中介导HCV感染的关键氨基酸残基,这对认识HCV的感染机制及疫苗研发具有重要意义。
1 材料和方法
1.1 材料
大肠埃希菌DH5α、人胚肾(human embryo kidney,HEK)293T细胞为本教研室保存。真核表达质粒载体pCI-neo为Promega产品。H77株E1E2基因、MLV包装质粒pCMV-gag-pol、报告基因表达质粒pCMV-Luc由法国国立卫生研究院Cosset FL教授惠赠。人肝癌细胞Huh7.5由美国洛克菲勒大学丙型肝炎研究室Rice CM教授惠赠。E2多克隆抗体为BioDesign产品,GAPDH单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记兔抗山羊IgG和兔抗小鼠IgG购自Sigma,DMEM培养基、胎牛血清及LipofectamineTM2000购自Invitrogen公司。
1.2 HVR1突变体表达载体的构建
H77株E1E2基因的HVR1缺失突变由上海捷瑞生物工程有限公司完成,连接于pMD-18T载体,E1E2基因两端分别含NheⅠ和SmaⅠ酶切位点。将含E1E2基因的质粒以NheⅠ和SmaⅠ酶切,回收目的片段,与经过相同酶切的pCI-neo表达载体连接,转化DH5α,用酶切及DNA测序鉴定重组质粒。
1.3 HCVpp的制备
分别将上述H77株E1E2表达质粒与pCMV-gag-pol及pCMV-Luc质粒共转染HEK 293T细胞(24孔板),6 h后换液,加完全DMEM培养液,继续培养48 h后收集上清液,离心去除残余细胞,然后将上清液冻存于-80 ℃。吸除培养液,每孔加120 μl细胞裂解液﹝含2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和鸡尾酒蛋白酶抑制剂的0.01 mol/L磷酸缓冲液(phosphate buffered saline,PBS),pH 7.0﹞裂解细胞,加30 μl 5×Loading Buffer,煮沸,用蛋白免疫印迹法检测包膜E2蛋白的表达。
1.4 蛋白免疫印迹法检测E2蛋白表达
转染的HEK 293T细胞裂解液先进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),然后电转移将凝胶中的蛋白转至硝酸纤维素膜,以1∶2 000稀释的E2多克隆抗体及1∶5 000稀释的GAPDH单克隆抗体为一抗,1∶1 000稀释的HRP兔抗羊IgG及兔抗小鼠IgG为二抗,化学发光法显示反应条带。
1.5 定量聚合酶链反应检测HCVpp产量
将冻存的HEK 293T细胞培养上清液融化后,用RNA酶和DNA酶处理30 min,立即用病毒RNA抽提试剂(Roche)抽提RNA。取10 μl RNA,用随机引物进行反转录反应,反应体积25 μl。取反转录产物5 μl,用荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测荧光素酶基因cDNA。将pCMV-Luc质粒作为标准品,上游引物:5′-ATGCACATATCGAGGTGG-3′;下游引物:5′-CCCAACACCGGCATAAAG-3′,共40个循环。仪器采用Rotor-Gene 3000。结果表示为每毫升细胞培养上清液中荧光素酶基因RNA拷贝数。
1.6 HCVpp感染力检测
人肝癌细胞Huh7.5接种于96孔板(104个/孔),培养基为含10%胎牛血清和非必需氨基酸的DMEM。12 h后,将50 μl含HCVpp的细胞上清液加入Huh7.5。72 h后每孔加50 μl细胞裂解液(Promega)裂解细胞,然后用Bright Glow试剂(Promega)检测细胞裂解液的荧光素酶活性,以相对荧光素酶活性单位(relative luciferase unit,RLU)表示。
2 结果
2.1 HVR1中的缺失突变
HVR1是包膜E2蛋白中介导HCV与受体SR-BI结合的关键功能区域。为分析HVR1及其中的肽段和氨基酸残基在介导HCV侵入细胞的作用,我们对H77株包膜E1E2基因中的HVR1编码序列进行了一系列缺失突变,将缺失突变的E1E2基因插入pCI-neo表达载体,经DNA测序、鉴定后用于制备HCVpp (表1)。
表1H77株HVR1缺失突变序列
Tab.1DeletionmutantsinHVR1ofH77isolate

No.Sequence of residuesDeletion of amino acid sitesH77ETHVTGGSAGHTTAGLVGLLTPGAKQN-D1--------AGHTTAGLVGLLTPGAKQN1-8D2------------TAGLVGLLTPGAKQN1-12D3ETHVTGGSAGHT------------KQN13-24D4ETHVTGGSAGHTTAG---------KQN16-24D5ETHVTGGSAGHTTAG------------16-27D6ETHVTGGSAGHT---LVGLLTPGAKQN13-15D7ETHVTGGSAGHTTAGLVGLLTPGA---25-27D8ETHVTGGSAGHT-AGLVGLLTPGAKQN13D9ETHVTGGSAGHTT-GLVGLLTPGAKQN14D10ETHVTGGSAGHTTA-LVGLLTPGAKQN15D11ETHVTGGSAGHTTAGLVGLLTPGA-QN25D12ETHVTGGSAGHTTAGLVGLLTPGAK-N26D13ETHVTGGSAGHTTAGLVGLLTPGAKQ-27D14---------------------------1-27
2.2 HVR1缺失突变不影响HCV包膜E2蛋白的表达
将上述各种缺失突变体质粒与MLV包装质粒共转染HEK 293T细胞,用E2多克隆抗体对细胞裂解液进行蛋白免疫印迹检测。结果显示,全部或部分HVR1缺失的突变体质粒在HEK 293T细胞中表达相似水平的包膜E2蛋白(图1),表明缺失HVR1中部分或全部氨基酸残基对包膜E2蛋白的表达水平均无明显影响。
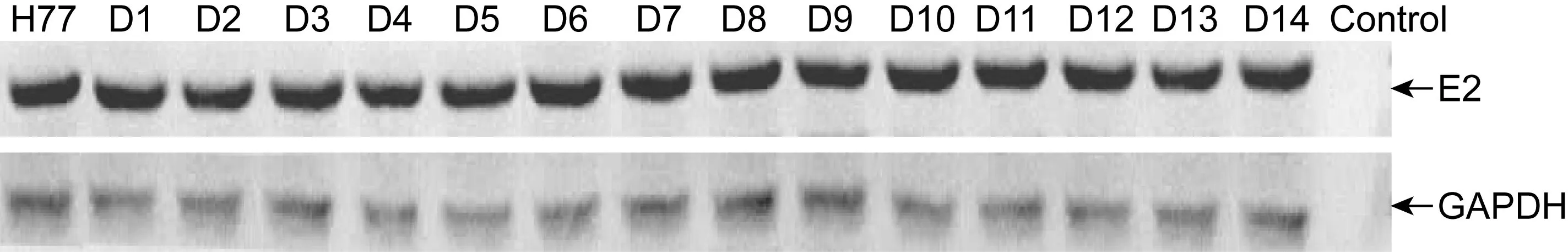
H77, D1-D14 show expression products of wild envelope protein and mutants of H77 strain described in Table 1, respectively. Control shows lysate of HEK 293T cells transfected with mock vector.
图1蛋白免疫印迹法检测HEK293T细胞中HCV包膜E2蛋白表达
Fig.1AssayofenvelopeglycoproteinE2expressioninHEK293TcellsbyWesternblot
2.3 HVR1缺失突变不影响HCVpp的包装
用DNA酶和RNA酶处理细胞培养上清液,以避免细胞内漏出的DNA和RNA对检测结果的影响。抽提总RNA,采用荧光定量PCR检测HCVpp内部的荧光素酶RNA。计算各突变体质粒转染上清液与完整HVR1质粒转染上清液中荧光素酶RNA的相对值(%),从而判断HVR1突变是否影响HCVpp的包装。结果见图2。各突变体与包装质粒共转染的HEK 293T培养上清液中荧光素酶mRNA含量相似,表明HVR1中的缺失突变对HCVpp的包装无明显影响。
Data are the mean±SD of four independent experiments.
图2荧光定量PCR检测HEK293T细胞上清液中HCVpp含量
Fig.2DeterminationofHCVppinHEK293TculturesupernatantbyfluorescentquantitativePCR
2.4 介导HCVpp感染的关键氨基酸残基位于HVR1的羧基端
用HCVpp感染Huh7.5细胞(接种于96孔板),72 h后裂解细胞,检测细胞中RLU,然后计算各突变体假病毒感染的靶细胞与原型假病毒感染的靶细胞中RLU相对值(%)。如图3所示,与H77原型株相比,缺失HVR1第1~8位(D1)和1~12位(D2)的氨基酸残基分别使HCVpp感染力降低约31%和19%。而缺失完整HVR1(D14)的HCVpp感染力为原型的4%,表明HVR1的存在对HCVpp的感染力至关重要。缺失第13~24位(D3)和16~27位(D5)氨基酸残基的HCVpp感染力低于原型的8%,表明介导HCVpp感染的关键氨基酸残基位于HVR1的羧基端。而缺失16~24位(D4)氨基酸残基不仅没有降低反而明显增强HCVpp感染力(上调35%),提示第13~15位和25~27位氨基酸残基可能是介导HCVpp感染力的关键位点。
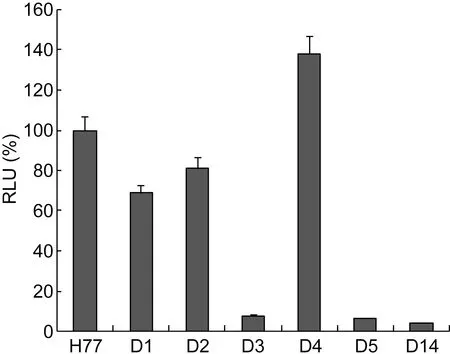
Data are the mean±SD of three independent experiments.
图3氨基端与羧基端肽段缺失对HCVpp感染力的影响
Fig.3EffectsofdeletionofN-orC-terminalpeptidesonHCVppinfectivity
2.5 HVR1第13~15位和25~27位氨基酸残基是介导HCVpp感染的关键氨基酸残基
检测第13~15位和25~27位氨基酸残基缺失或逐一突变的HCVpp感染力,结果如图4所示。缺失第13~15位、25~27位残基或任意一个氨基酸残基均导致HCVpp感染力几乎完全丧失(低于原型的5%),表明这6个氨基酸是介导HCVpp感染的关键残基。
3 讨论
HCV包膜蛋白由E1和E2 2种糖蛋白组成,是HCV中和抗体的靶抗原,两者通过非共价键结合。其中, E2蛋白在介导HCV与靶细胞结合过程中起更重要的作用[9,10]。在急性感染阶段,HVR1变异是HCV感染慢性化的重要原因[11,12]。HCV是多受体病毒,在HCV入侵宿主细胞过程中,SRBI是与HCV作用的第1个受体,而HVR1是HCV包膜E2蛋白与SR-BI结合必不可少的结构区域,从而影响HCV的感染力[13-15]。目前对HVR1结构与功能的相关性尚未见报道,而这对认识HCV的感染机制及研发抗HCV感染药物和疫苗具有十分重要的意义。
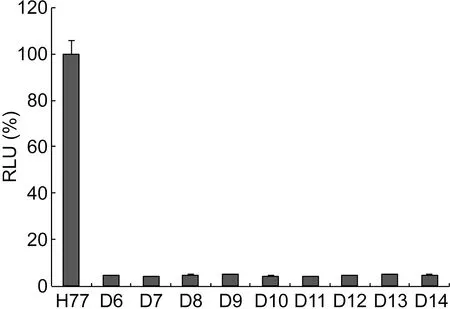
Data are the mean±SD of three independent experiments
图4缺失第13~15位和25~27位氨基酸残基对HCVpp感染力的影响
Fig.4Effectsofdeletionof13-15or25-27aminoacidresiduesonHCVppinfectivity
为鉴定出HVR1中与HCV侵入细胞有关的关键氨基酸位点,本研究首先构建了6种HVR1缺失突变的重组质粒(分别缺失第1~8、1~12、13~24、16~24、16~27位氨基酸残基和整个HVR1),分别将这些质粒与假病毒核心结构质粒共转染HEK 293T细胞。蛋白免疫印迹法和荧光定量PCR分析表明,HVR1中的缺失突变对HCV包膜蛋白表达和假病毒包装无明显影响。将各种假病毒感染Huh7.5细胞后检测其感染力,结果表明,缺失第1~8位和1~12位氨基酸残基的HCVpp感染力比原型株分别降低约31%和19%,缺失第13~24位和16~27位氨基酸残基的HCVpp感染力几乎完全丧失,但缺失第16~24位氨基酸残基的HCVpp感染力比原型株提高35%。这些结果提示,介导HCV感染的关键氨基酸残基可能位于第13~15位和25~27位。因此,我们又构建了8种重组质粒(分别缺失第13~15、25~27、13、14、15、25、26、27位残基),制备相应的假病毒后感染Huh7.5靶细胞。结果发现,第13、14、15、25、26、27位残基是介导HCV感染的关键残基,缺失这6个氨基酸残基中的任意一个均使HCVpp的感染力几乎完全丧失。分析多株1a型HCV的基因序列发现,这6个氨基酸残基并不保守,推测这些介导HCV侵入细胞的关键残基可能与整个包膜蛋白在长期进化中逐渐适应、在功能上相互协调有关。因此,长期监测同一感染者在不同病程阶段HVR1的序列变异能更准确界定各个残基的功能。
本研究证明,缺失HVR1的氨基端肽段对HCVpp感染力无根本性影响,表明氨基端残基在HCV侵入细胞过程中不起重要作用,与针对H77株HVR1氨基端的单克隆抗体无中和作用的报道相符[8]。多数研究报道,HVR1的中和抗体表位位于羧基端[16,17],因而理论上羧基端应具有更高的变异性。本研究虽证实羧基端含介导HCV感染力的关键残基,但删除羧基端的中段肽段(第16~24位残基)不仅没有导致HCVpp感染力下调,反而增强了感染力,而该肽段两侧的各3个残基对HCVpp感染力至关重要。我们推测,第16~24位残基可能参与中和表位的形成,中和抗体与该表位结合,通过空间阻遏效应干扰病毒与SR-BI受体结合。
本研究分析了14种HVR1中缺失突变的HCVpp对人肝癌细胞Huh7.5的感染力,鉴定出HVR1中第13~15位和25~27位共6个氨基酸残基为影响HCV感染力的关键残基。进一步分析这些氨基酸残基突变导致HCVpp感染力增强或降低的机制,并鉴定出HVR1的中和表位,将为HCV感染机制研究及疫苗研制提供更有价值的信息。
[1] Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection [J]. Lancet Infect Dis, 2005, 5(9):558-567.
[2] Enomoto M, Tamori A, Kawada N. Emerging antiviral drugs for hepatitis C virus [J]. Rev Recent Clin Trials, 2009, 4(3): 179-184.
[3] Klenerman P, Fleming V, Barnes E. What are the prospects for controlling hepatitis C [J]? PLoS Med, 2009, 6(6):e1000096.
[4] Scarselli E, Ansuini H, Cerino R, Roccasecca RM, Acali S, Filocamo G, Traboni C, Nicosia A, Cortese R, Vitelli A. The human scavenger receptor class B type I is a novel candidate receptor for the hepatitis C virus [J]. EMBO J, 2002, 21 (19):5017-5025.
[5] Weiner AJ, Brauer MJ, Rosenblatt J, Richman KH, Tung J, Crawford K, Bonino F, Saracco G, Choo QL, Houghton M. Variable and hypervariable domains are found in the regions of HCV corresponding to the flavivirus envelope and NS1 proteins and the pestivirus envelope glycoproteins [J]. Virology, 1991, 180 (2):842-848.
[6] Hijikata M, Kato N, Ootsuyama Y, Nakagawa M, Ohkoshi S, Shimotohno K. Hypervariable regions in the putative glycoprotein of hepatitis C virus [J]. Biochem Biophys Res Commun, 1991, 175(1): 220-228.
[7] Bartosch B, Dubuisson J, Cosset FL. Infectious hepatitis C virus pseudo-particles containing functional E1-E2 envelope protein complexes [J]. J Exp Med, 2003, 197 (5):633-642.
[8] Hsu M, Zhang J, Flint M, Logvinoff C, Cheng-Mayer C, Rice CM, McKeating JA. Hepatitis C virus glycoproteins mediate pH-dependent cell entry of pseudotyped retroviral particles [J]. Proc Natl Acad Sci USA, 2003, 100 (12):7271-7276.
[9] Op De Beeck A, Voisset C, Bartosch B, Ciczora Y, Cocquerel L, Keck Z, Foung S, Cosset FL, Dubuisson J. Characterization of functional hepatitis C virus envelope glycoproteins [J]. J Virol, 2004, 78(6): 2994-3002.
[10] Bartosch B, Cosset FL. Cell entry of hepatitis C virus [J]. Virology, 2006, 348(1): 1-12.
[11] Manzin A, Solforosi L, Petrelli E, Macarri G, Tosone G, Piazza M, Clementi M. Evolution of hypervariable region 1 of hepatitis C virus in primary infection [J]. J Virol, 1998, 72 (7):6271-6276.
[12] Ray SC, Wang YM, Laeyendecker O, Ticehurst JR, Villano SA, Thomas DL. Acute hepatitis C virus structural gene sequences as predictors of persistent viremia: hypervariable region 1 as a decoy [J]. J Virol, 1999, 73 (4):2938-2946.
[13] Bartosch B, Verney G, Dreux M, Donot P, Morice Y, Penin F, Pawlotsky JM, Lavillette D, Cosset FL. An interplay between hypervariable region 1 of the hepatitis C virus E2 glycoprotein, the scavenger receptor BI, and high-density lipoprotein promotes both enhancement of infection and protection against neutralizing antibodies [J]. J Virol, 2005, 79(13): 8217-8229.
[14] Bartosch B, Vitelli A, Granier C, Goujon C, Dubuisson J, Pascale S, Scarselli E, Cortese R, Nicosia A, Cosset FL. Cell entry of hepatitis C virus requires a set of co-receptors that include the CD81 tetraspanin and the SR-B1 scavenger receptor [J]. J Biol Chem, 2003, 278 (43):41624-41630.
[15] Bankwitz D, Steinmann E, Bitzegeio J, Ciesek S, Friesland M, Herrmann E, Zeisel MB, Baumert TF, Keck ZY, Foung SK, Pécheur EI, Pietschmann T. Hepatitis C virus hypervariable region 1 modulates receptor interactions, conceals the CD81 binding site, and protects conserved neutralizing epitopes [J]. J Virol, 2010, 84 (11): 5751-5763.
[16] Scarselli E, Cerino A, Esposito G, Silini E, Mondelli MU, Traboni C. Occurrence of antibodies reactive with more than one variant of the putative envelope glycoprotein (gp70) hypervariable region 1 in viremic hepatitis C virus-infected patients [J]. J Virol, 1995, 69 (7):4407-4412.
[17] Vieyres G, Dubuisson J, Patel AH. Characterization of antibody-mediated neutralization directed against the hypervariable region 1 of hepatitis C virus E2 glycoprotein [J]. J Gen Virol, 2011,92 (Pt 3):494-506.
