2010年上海部分地区440例手足口病病例的病原谱及分子流行病学分析
2011-01-24张晓玲俞慧菊余曜宋志刚管文彩马文艺胡芸文
张晓玲,俞慧菊,余曜,宋志刚,管文彩,马文艺,胡芸文
1.上海市(复旦大学附属)公共卫生临床中心,上海 201508; 2.上海交通大学医学院附属新华医院,上海 200092; 3. 中国科学院上海生命科学研究院生物信息中心,上海 200031
手足口病(hand, foot and mouth disease, HFMD) 通常是由肠道病毒引起的儿童急性传染病,在人口密度较高的亚太地区广泛流行。临床症状表现为手、足、口腔等部位的斑丘疹、疱疹,少数重症病例可出现无菌性脑炎、肺炎、肺水肿、心肌炎等,并较快死亡[1]。
引起手足口病的主要病原为肠道病毒71型(enterovirus 71, EV71)和柯萨奇病毒A组16型(coxsackievirus A16, CA16),其他肠道病毒如肠道病毒A组的CA2、CA4、CA5、CA6、CA8、CA9、CA10,肠道病毒B组的埃可病毒11、4、7型,以及肠道病毒B组3型都可引起手足口病[2]。尽管非EV71非CA16肠道病毒在手足口病病原谱中占一定比例,但目前对其构成和分子流行病学特征尚不清楚。日本、芬兰等国曾发生由非EV71非CA16肠道病毒引起的手足口病疫情,因此深入了解并日常监测这部分肠道病毒,对手足口病的防治具有重要意义。
本研究在分析2010年来自上海部分地区的440例手足口病病例的病原谱基础上,对引起手足口病的主要肠道病毒EV71和非EV71非CA16肠道病毒的分子流行病学特征进行了初步探讨。
1 材料和方法
1.1 材料
采集上海市(复旦大学附属)公共卫生临床中心、上海交通大学医学院附属新华医院、上海市东方医院和上海市长宁区中心医院2010年1~12月的440例手足口病临床诊断病例共836份标本,其中咽拭子417份、粪便373份、脑脊液46份。诊断依据为卫生部《手足口病诊疗指南》(2010年版)。在发病早期和抗生素使用前采集标本,采集后暂存于4 ℃冰箱,48 h内冷链转运至上海市(复旦大学附属)公共卫生临床中心并进行处理、分装,-80 ℃保存待用。
1.2 方法
1.2.1 核酸提取与反转录
用High Pure Viral Nucleic Acid Kit (Roche) 试剂盒提取样本核酸,按试剂盒操作步骤进行。取样本200 μl,加200 μl含poly(A)的Binding Buffer和50 μl蛋白酶K;72 ℃ 10 min后,用柱子吸附RNA,加入Inhibitor Removal Buffer;再用Wash Buffer洗2次,最后用50 μl Elution Buffer溶解,获RNA。
用随机引物和反转录酶(TaKaRa Random Primer D3801, PrimeScript Reverse Transcriptase D2680A)反转录核酸,按试剂盒操作步骤进行。加入4 μl 5×Buffer、1 μl 10 mmol/L dNTP、1 μl Random Primer和14 μl RNA模板;65 ℃ 15 min后,加入PrimeScript和人胎盘核糖核酸抑制剂(human placental ribonuclease inhibitor, HPRI)各0.5 μl,继续反应30 ℃ 10 min、42 ℃ 50 min、72 ℃ 10 min,得到cDNA。
1.2.2 肠道病毒通用荧光定量聚合酶链反应
所有标本经核酸抽提、反转录后,应用肠道病毒通用引物ENVs和ENVas及TaqMan探针ENVprobe进行荧光定量聚合酶链反应(polymerase chain reaction,PCR)。该方法参考了Verstrepen等的研究[3]。PCR反应条件:94 ℃ 2 min预变性;94 ℃ 10 s、55 ℃ 20 s、72 ℃ 40 s,5个循环;94 ℃ 10 s、60 ℃ 30 s,42个循环;60 ℃进行荧光检测。反应在Eppendorf 荧光PCR仪(Realplex 2)上进行,引物和探针序列见表1。
1.2.3 EV71和CA16的PCR检测
对肠道病毒通用荧光定量PCR检测阳性的标本,进一步采用卫生部发布的《手足口病预防控制指南》(2008年版)[4]中推荐的特异性分型PCR方法对EV71和CA16进行分型鉴定。其中,检测EV71的分型引物为EV71s和EV71as,CA16的分型引物为CA16s和CA16as (表1)。PCR反应条件:94 ℃ 2 min预变性;94 ℃ 15 s、55 ℃ 30 s、72 ℃ 30 s,5个循环;94 ℃ 15 s、50 ℃ 30 s、72 ℃ 30 s,5个循环;94 ℃ 15 s、45 ℃ 30 s、72 ℃ 30 s,25个循环;72 ℃延伸5 min。反应在PCR仪(Eppendorf)上进行。反应结束后,扩增产物5 μl用2%琼脂糖凝胶(Biowest agarose regular)电泳,观察电泳结果(UVItec, UVIpro Sliver)。
表1通用肠道病毒、EV71和CA16的特异性引物和探针
Tab.1Specificprimersandprobesforenterovirus,EV71andCA16
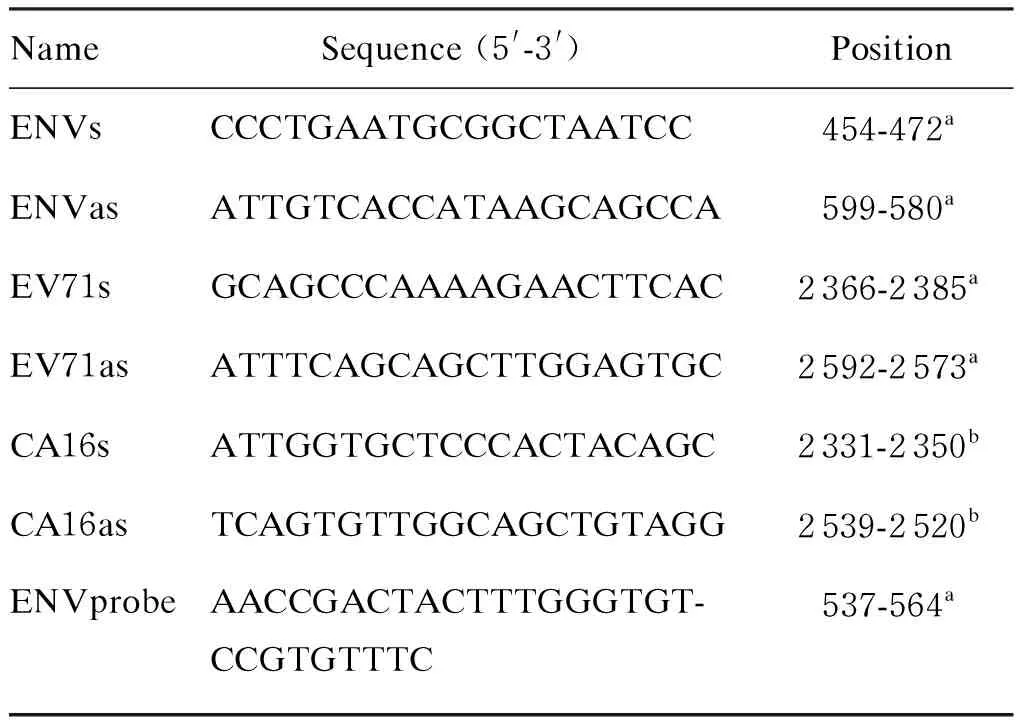
NameSequence (5'-3') PositionENVsCCCTGAATGCGGCTAATCC454-472aENVasATTGTCACCATAAGCAGCCA599-580aEV71sGCAGCCCAAAAGAACTTCAC2366-2385aEV71asATTTCAGCAGCTTGGAGTGC2592-2573aCA16sATTGGTGCTCCCACTACAGC2331-2350bCA16asTCAGTGTTGGCAGCTGTAGG2539-2520bENVprobeAACCGACTACTTTGGGTGT-CCGTGTTTC537-564a
a, according to the strain SHZH03 (GenBank No.: AY465356); b, according to the strain XM-CA16-3560 (GenBank No.: HQ269389).
1.2.4 肠道病毒的反转录半套式PCR检测
对肠道病毒通用荧光定量PCR阳性而EV71和CA16均为阴性的标本,应用反转录半套式PCR(reverse transcriptase-seminested PCR,RT-snPCR)检测。PCR反应条件:第1轮:95 ℃ 30 s、42 ℃30 s、72 ℃ 45 s,40个循环;第2轮:95 ℃ 30 s、60 ℃ 20 s、72 ℃ 15 s,40个循环。第2轮PCR产物割胶、回收、纯化后送上海博尚生物技术有限公司测序。使用引物见文献报道[5]。
1.2.5 CA6和CA10的RT-PCR检测
使用Prime 5软件,根据GenBank公布的病毒序列自行设计CA6引物(CA6s:5′-GGGGTC-AATGAGGCAGTGT-3′,CA6as:5′-CTGCCATT-GGTATGATTTCCTAC-3′)和CA10引物(5′-CCACTTCTTCTCHCGCTCYGG-3′,5′-GATG-GGTTDGTTGCYGTTTGC-3′),对RT-snPCR产物测序鉴定为CA6和CA10的阳性标本,使用上述2对引物进行CA6和CA10特异性RT-PCR,与测序鉴定结果完全一致。应用一步法RT-PCR试剂盒(TaKaRa DRR064A)。反应条件:42 ℃反转录20 min;95 ℃预变性30 s;95 ℃10 s、56 ℃20 s、72 ℃30 s,40个循环;72 ℃延伸5 min。
1.2.6 一步法RT-PCR扩增EV71 VP1区基因
扩增EV71 VP1全长基因所用引物序列如下。EV71-2312s:5′-AATTACGTGGTTCCAATCGGT-3′,EV71-3385as:5′-TGTGAGTGGCAAGATGT-CGG-3′。应用一步法RT-PCR 试剂盒(TaKaRa 0064A)。反应条件:42 ℃反转录20 min; 95 ℃预变性1 min; 95 ℃5 s、55 ℃20 s、72 ℃40 s,35个循环;72 ℃延伸5 min。
1.2.7 系统发生树分析
用于建立系统发生树的核酸序列选自GenBank中肠道病毒各基因型和亚型代表株,以及CA6和CA10的VP1-2A序列,使用ClustalX 2.0比对序列后,采用MEGA4软件中邻接法和Kimura 2-parameter模型自举检验且重复1 000次,建立系统发生树,分析序列进化特点。
2 结果
2010年共收集440例临床诊断为手足口病的836份标本。患儿发病年龄0~10岁,平均年龄2.6岁。1~3岁组病例数最多,占70.91%。男性多于女性,其中男性272例、女性168例,男女比例为1.62∶1(表2)。
散居(指分散居住且还没有进入幼儿园)和幼托患儿共415例,占94.32%。其中散居患儿最多,共318例,占72.27%。
2.1 肠道病毒病原谱的构成
使用肠道病毒通用PCR引物检测440例手足口病病例,结果肠道病毒阳性病例占88.86%(391/440),阴性病例占11.14%(49/440)。对391例肠道病毒阳性病例进一步分析各型肠道病毒阳性病例构成比(表2),发现EV71阳性病例占70.59%(276/391),CA16阳性病例占12.02%(47/391),EV71和CA16同时阳性病例占1.28%(5/391),非EV71非CA16肠道病毒感染病例占16.11%(63/391)。 对非EV71非CA16肠道病毒阳性标本使用RT-snPCR方法扩增基因片段, 并进行DNA测序和序列比对。结果显示,CA10阳性病例占5.63%(22/391),CA6占4.09%(16/391),CA12和CA4各占0.77%(3/391),CA9、埃可病毒13和埃可病毒9各占0.26%(1/391)。为确认上述结果, 使用自行设计的CA6和CA10特异性引物对标本进行验证,证实RT-snPCR的测序结果与特异性引物检测结果一致。
表22010年上海440例临床手足口病病例肠道病毒检测结果
Tab.2Theenterovirusdetectionof440HFMDcasesinShanghaiin2010
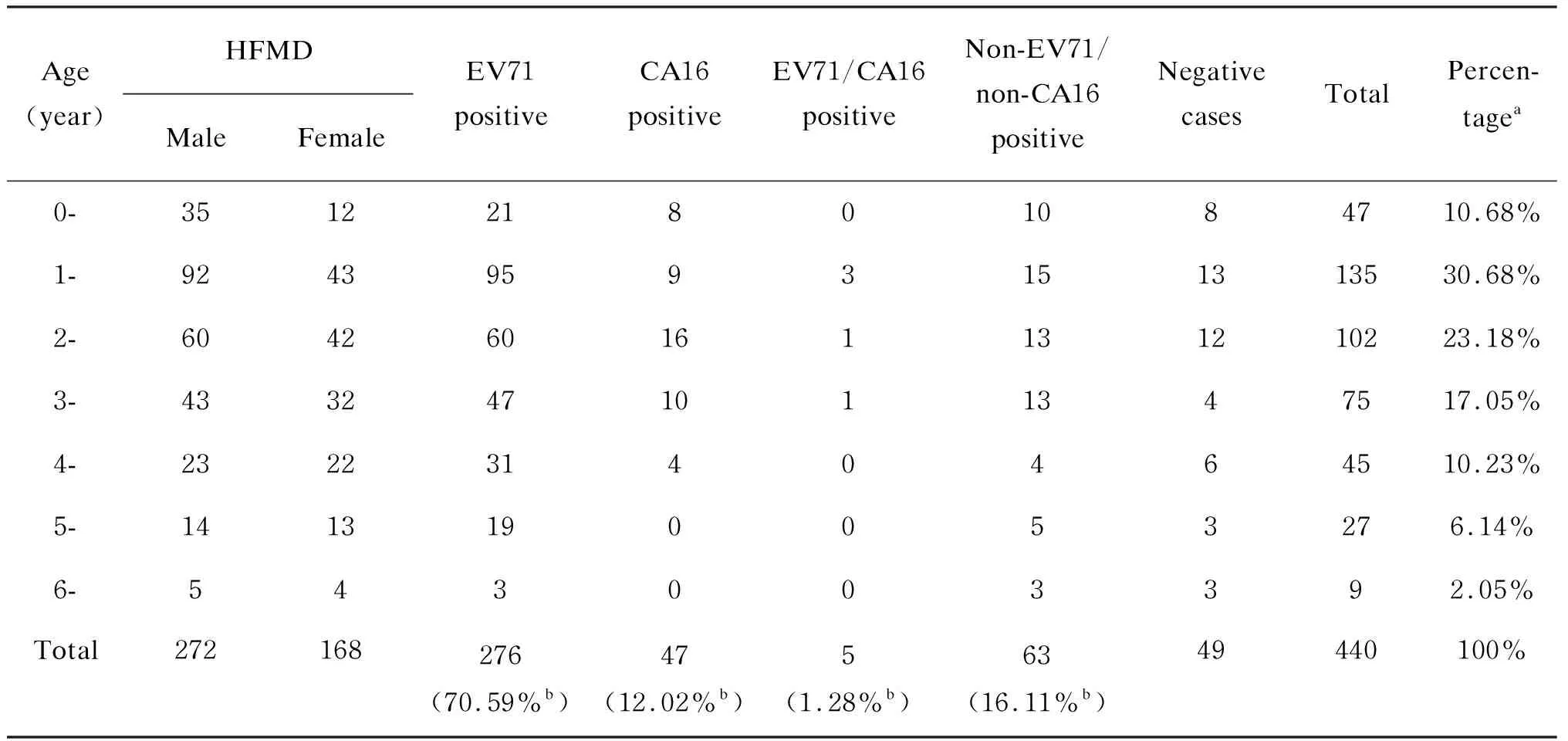
Age(year)HFMD MaleFemaleEV71 positive CA16 positiveEV71/CA16positive Non-EV71/non-CA16 positive Negative casesTotalPercen-tagea0-351221801084710.68%1-92439593151313530.68%2-604260161131210223.18%3-4332471011347517.05%4-23223140464510.23%5-1413190053276.14%6-543003392.05%Total272168276(70.59%b)47(12.02%b)5(1.28%b)63(16.11%b)49440100%
a, percentage of HFMD cases in different age groups; b, percentage of HFMD cases in different enterovirus infection groups.
2.2 病原检出的月份分布
将440例临床手足口病病例按月份统计,月份分布见图1。其中,3~5月64例,6~8月211例,9~11月92例,1~2月和12月合计73例。6、7月病例数达高峰,为166例,占全年收集病例的37.73%(166/440)。EV71为最主要病原体,5~8月出现EV71阳性病例检出率高峰,阳性病例占5~8月总病例数的69.43%(184/265),而1~2月和12月阳性病例数占同期总病例数的38.36%(28/73)。CA16阳性病例检出率仅次于EV71,5~8月CA16阳性病例检出率为11.70%(31/265),而1~2月和12月阳性病例检出率为13.70%(10/73)。1~5月在手足口病病例中未检测到CA6和CA10阳性病例,而12月CA6和CA10阳性病例达到高峰,分别占全年CA6和CA10阳性病例的87.50%(14/16)和36.36%(8/22)。
2.3 基于EV71 VP1全长基因序列的分子分型
选取16例,扩增标本中EV71的衣壳蛋白VP1全长基因(891个核苷酸,GenBank序列号为JF918563~918578),对其DNA序列及EV71各基因型和亚型代表株(表3)的序列进行亲缘系统发生树分析。结果显示,上海地区2010年16例的EV71与C4亚型代表株处于同一分支中,因此属C4基因亚型。人EV71 C4基因亚型又可分为2个进化分支:C4a 和C4b。本研究中EV71均属C4a亚型,与国内近年各地流行毒株的核苷酸同源性为94.9%~99.3%(图2)。
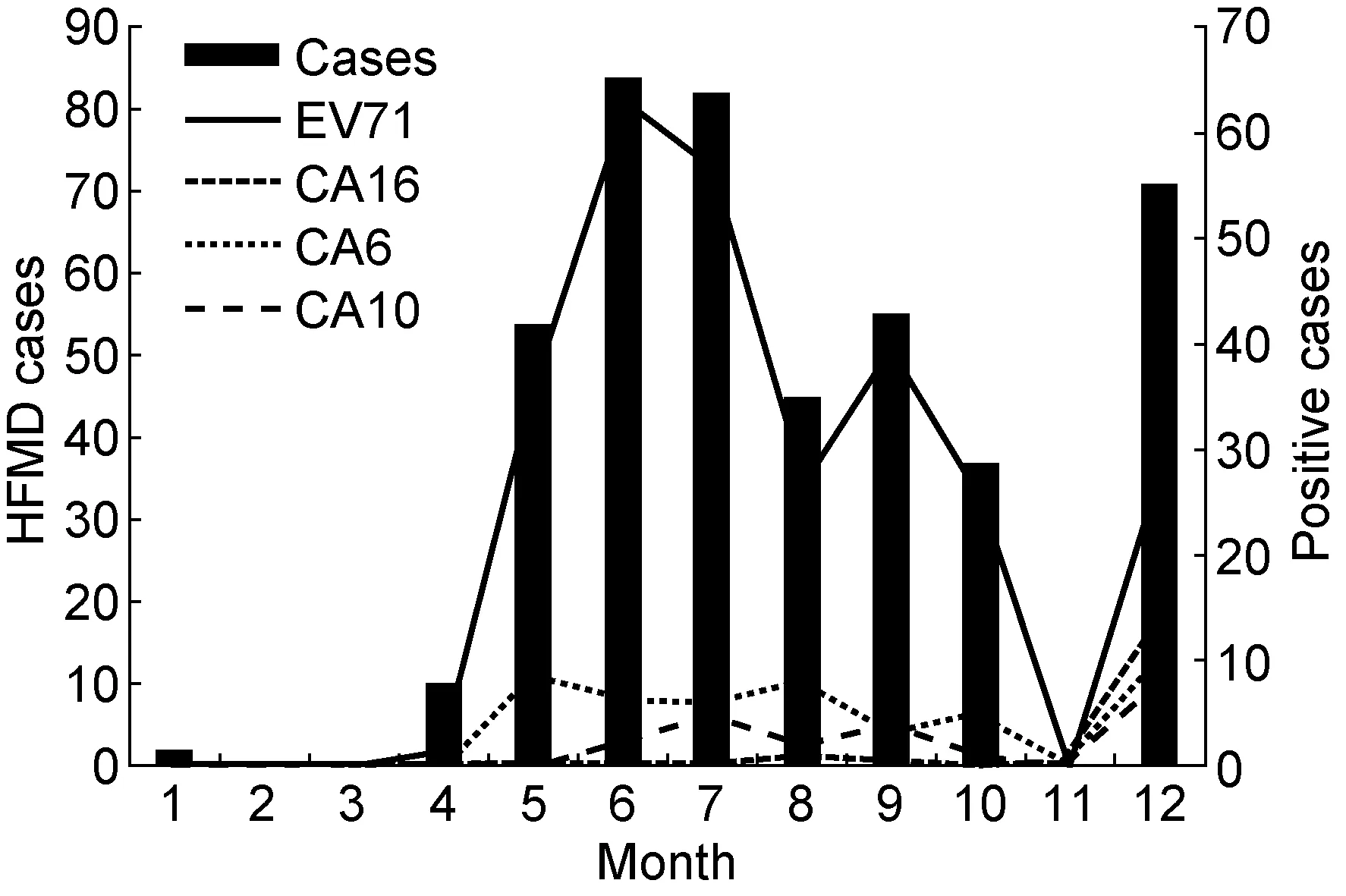
图12010年EV71、CA16、CA6和CA10阳性病例的月份分布
Fig.1MonthdistributionofpositivecasesinfectedwithEV71,CA16,CA6andCA10in2010
2.4 基于CA6和CA10 VP1序列的系统发生树
为进一步确认本研究中CA6和CA10的来源,选取GenBank中现有CA6和CA10毒株的VP1基因序列作为建立系统发生树的参考序列(表3)。

Phylogenetic tree depicting the clustering of selected EV71 isolates based on the 891 nucleotides of VP1 coding region. Sequences of this study are in bold.
图2EV71系统发生树
Fig.2PhylogenetictreeforEV71
选取11例的CA6 VP1基因 3′端核苷酸序列(GenBank序列号为JN316013~316023)和GenBank中31株CA6的VP1序列建立系统发生树,并以CA16病毒株XM/CA16/3560的核酸序列(GenBank序列号为HQ269389)为根序列。结果显示(图3),上海CA6序列与参考株序列一起形成3个主要基因簇:第1个基因簇包括Gdula毒株序列,它与其他CA6序列的同源性为75%~85%;第2个基因簇是来自中国云南的毒株108/YN/2008,它与其他CA6序列的同源性为75%左右;而1999~2008年从日本、芬兰、新加坡、挪威和中国台湾地区分离的病毒株与上海11例的CA6序列共同组成第3个基因簇,它们之间同源性高达90%以上。根据bootstrap值,又可将第3个基因簇分为2个亚簇。来自上海10例的CA6序列(“▲”标志)与导致2008年芬兰手足口病疫情的4株CA6代表株序列以及1株2008年新加坡分离株聚集为亚簇1,它们之间的核苷酸同源性达96%以上。而上海也有1例的CA6分离株(“●”标志)与来自日本、中国台湾地区、韩国、挪威等的25株CA6代表株序列形成亚簇2,其中与中国台湾地区2004~2006年的分离株同源性最高,达94%。
表3用于构建EV71、CA6和CA10系统发生树的核酸序列
Tab.3NucleicacidsequencesusedtoconstructphylogenetictreeforEV71,CA6andCA10
(续表3)
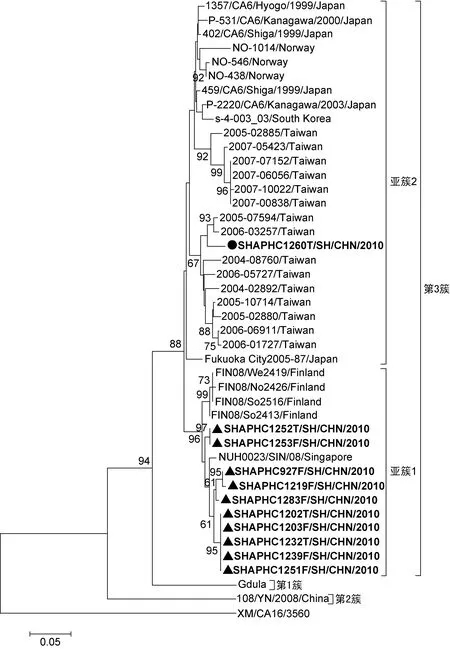
Phylogenetic tree was constructed based on 320 nucleotides from 3′ partial sequences of the CA6 VP1 capsid protein coding region. Sequences of this study are in bold.
图3CA6系统发生树
Fig.3PhylogenetictreeforCA6
同样,选取上海地区21例的CA10 VP1基因 3′端核苷酸序列(GenBank序列号为JN315992~31612)和GenBank中22株CA10的VP1序列建立系统发生树,以CA16病毒株XM/CA16/3560的核酸序列作为根序列(GenBank序列号为HQ269389)。系统发生树中有3个主要基因簇(图4),呈鲜明的地域分布特征。第1个基因簇是1株美国的CA10流行株Kowalik,与其他地区CA10的同源性只有70%~77%;第2个基因簇主要包括来自芬兰、德国、拉脱维亚等欧洲国家的7株CA10流行株序列和1株上海分离株序列(“●”标志),它们之间的同源性达92%~98%,与上海其他20株CA10(“▲”标志)的同源性只有80%。本研究中20株上海CA10毒株和国内近年来流行的CA10毒株共同组成了第3个基因簇,其中上海株与2009年3株山东CA10分离株(WD0002、WD0012、WD0048)和1株2010年云南分离株(16/YN/CHN/2010/CA10)同源性最高,达97%。但2009年以后国内流行株与日本2003年分离株的同源性只有85%左右,与新加坡株的同源性只有78%左右。
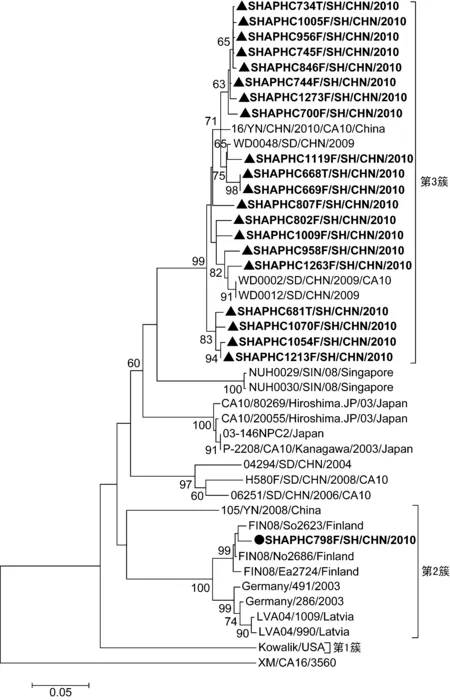
Phylogenetic tree was constructed based on 364 nt from 3′ partial nucleotides of the CA6 VP1 capsid protein coding region. Sequences of this study are in bold.
图4CA10系统发生树
Fig.4PhylogenetictreeforCA10
2.5 肠道病毒型别与手足口病重症的关系
440例临床手足口病病例中,16例为重症患者,6例死亡。16例重症患者中,15例感染EV71,1例感染CA16,无1例为CA6或CA10感染。6例死亡者均为EV71阳性。
3 讨论
本研究对2010年上海部分地区的440例临床手足口病病例进行核酸检测及测序,发现病原体主要为EV71和CA16,其次为CA6和CA10。2005年日本曾报道CA6和CA10的流行[6]。2008年新加坡手足口病暴发期间,检测到的主要流行病原体为EV71,其次为CA6和CA10,占所有手足口病病例的35.3%[1]。另外,2008年秋季芬兰暴发的以脱甲症为临床特征的手足口病疫情中,CA6和CA10是主要病原体[2]。如今,尽管EV71和CA16已被广泛认同是导致手足口病流行的主要肠道病毒,但对占有一定比例的非EV71非CA16肠道病毒的构成情况尚不清楚。因此,本研究在总体分析2010年来自上海部分地区的440例临床手足口病病例肠道病毒谱的基础上,对引起手足口病的非EV71非CA16肠道病毒的构成及其分子流行病学特征进行了初步探讨。
研究发现,440例临床手足口病病例中,感染EV71和CA16的病例占83%以上,但感染非EV71非CA16肠道病毒的也占16.11%(63/391),其中以CA10(5.63%,22/391)和CA6(4.09%,16/391)为主,偶见CA12、CA4、CA9、埃可病毒13和埃可病毒9。而在2009年4~12月引起北京地区手足口病的非EV71非CA16肠道病毒中,CA10为优势型别[7]。由此可见,非EV71非CA16肠道病毒的分布存在一定的地域特点。
分析CA6和CA10感染病例的月份分布,发现CA6和CA10占肠道病毒阳性病例的构成比随季节变化而变化。春季未检测出CA6和CA10阳性病例,但冬季CA6和CA10却分别占肠道病毒阳性病例的19.00%和10.96%。2005年日本CA6和CA10流行期在4~7月[6],2008年芬兰CA6和CA10流行期为秋季[2],而2010年上海CA6和CA10流行期主要为秋、冬季。据此推测,上海地区CA6和CA10在秋、冬季可能存在较强的传播性,在人群中可引起小规模流行。曾有文献报道,2005年日本手足口病流行期间,CA6和CA10传播性比EV71强,但毒力比EV71弱[6]。CA6和CA10在流行时间和毒力方面与EV71存在的差异可能与生物学特性不同有关,值得进一步研究。
EV71系统发生树结果显示,2010年上海部分地区流行的EV71属C4a基因亚型,与近年来中国其他省市流行的EV71毒株高度同源,提示上海地区流行株来源于国内流行株。1999年至今,中国各地多次暴发的手足口病疫情均由C4基因型引起,包括2008年中国安徽省阜阳市流行的手足口病[8]、2009年山东省菏泽市集中暴发的手足口病等[9],提示EV71 C4亚型在我国广泛分布和流行。
基于CA6 VP1基因序列的系统发生树显示,上海地区CA6序列和参考株序列一起形成了3个主要基因簇,其中第3个基因簇又分为2个亚簇。2008年芬兰分离的4株CA6代表株序列和本研究中上海病例的CA6(“▲”标志)序列聚集于亚簇1,同源性达96%以上,提示2010年上海流行的CA6毒株与2008年芬兰手足口病疫情的CA6毒株可能存在一定的进化关系。
基于CA10 VP1基因序列的系统发生树显示,近年来国内流行毒株主要聚集于第3个基因簇中,具有很高的同源性;其他东亚地区、国家之间的CA10进化有较明显的差异;而欧洲几个国家的毒株序列则聚集于另一基因簇。提示目前国际上CA10流行株具有高度的地域分布特征,欧亚大陆各自流行的毒株在分子进化上有一定差异。本研究中20例上海病例的CA10病毒序列与3株2009年山东代表株和1株2010年云南代表株同源性很高,说明上海地区流行的CA10毒株可能来源于国内同期的流行株。值得注意的是,上海有1例病例的CA10(“●”标志SHAPHC798F/SH/CHN/2010)序列与芬兰、德国和拉脱维亚的代表株序列聚集在一起,提示此病例感染的CA10可能与欧洲部分地区流行株有一定的关联。
结合临床资料分析发现,导致本研究中22例手足口病重症和死亡的主要病原体是EV71,仅1例重症为CA16感染;而CA6和CA10阳性病例的临床症状较轻,无重症或死亡发生,提示不同肠道病毒感染导致的手足口病临床转归可能不同。由于本研究涉及的非EV71非CA16感染病例较少,不同肠道病毒感染引起的手足口病临床特征仍需进一步探讨。
由于GenBank中收录的CA6和CA10序列较少,尚不能准确定位本研究中上海病例的CA6和CA10基因亚型,因此也无法进一步推测其亚型变化的流行趋势。鉴于本研究中CA6和CA10感染病例数随月份而增加的趋势,推断其在冬季感染人群的能力较强,传播较快,且近年来报道CA6和CA10流行的文献陆续出现,提醒人们需加强对CA6和CA10的监测工作,并深入研究其生物学特性和分子流行病学特征,为手足口病的预测、预警和防治工作提供科技支撑。
[1] Wu Y, Yeo A, Phoon MC, Tan EL, Poh CL, Quak SH, Chow VT. The largest outbreak of hand, foot and mouth disease in Singapore in 2008: The role of enterovirus 71 and coxsackievirus A strains [J]. Int J Infect Dis, 2010, 14(12): 1076-1081.
[2] Blomqvist S, Klemola P, Kaijalainen S, Paananen A, Simonen ML, Vuorinen T, Roivainen M. Co-circulation of coxsackieviruses A6 and A10 in hand, foot and mouth disease outbreak in Finland [J]. J Clin Virol, 2010, 48 (1): 49-54.
[3] Verstrepen WA, Kuhn S, Kockx MM, van de Vyvere ME, Mertens AH. Rapid detection of enterovirus RNA in cerebrospinal fluid specimens with a novel single-tube real-time reverse transcription-PCR assay [J]. J Clin Microbiol, 2001, 39(11): 4093-4096.
[4] 中华人民共和国卫生部. 手足口病预防控制指南(2008年版)[J]. 首都公共卫生, 2008, 2(4): 146-148.
[5] Nix WA, Oberste MS, Pallansch MA. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens [J]. J Clin Microbiol, 2006, 44(8): 2698-2704.
[6] Yamashita T, Ito M, Taniguchi A, Sakae K. Prevalence of coxsackievirus A5, A6, and A10 in patients with herpangina in Aichi Prefecture [J]. Jpn J Infect Dis, 2005, 58(6): 390-391.
[7] 王永全,吉彦莉,曲梅. 北京地区与手足口病相关的非EV71、非CoxA16型肠道病毒的分子特征分析 [J]. 国际病毒学杂志,2011,18(3):75-79.
[8] Ma SH, Liu JS, WANG JJ, Shi HJ, Yang HJ, Chen JY, Liu LD, Li QH. Genetic analysis of the VP1 region of human enterovirus 71 strains isolated in Fuyang, China, during 2008 [J]. Virol Sin, 2009, 24(3): 162-170. DOI:10.1007/s12250-009-3033-4.
[9] Zhang Y, Tan XJ, Wang HY, Yan DM, Zhu SL, Wang DY, Ji F, Wang XJ, Gao YJ, Chen L, An HQ, Li DX, Wang SW, Xu AQ, Wang ZJ, Xu WB. An outbreak of hand, foot, and mouth disease associated with subgenotype C4 of human enterovirus 71 in Shandong, China [J]. J Clin Virol, 2009, 44(4): 262-267. DOI:10.1016/j.jelechem.2004.01.008.
