埃博拉病毒科特迪瓦型核蛋白的原核表达及纯化*
2011-01-24王雪敏王皓婷邱亚峰史子学邵东华王水明刘学辉王志亮马志永
王雪敏,王皓婷,,邱亚峰,史子学,邵东华,王水明,刘学辉,王志亮,马志永
埃博拉病毒科特迪瓦型核蛋白的原核表达及纯化*
王雪敏2,王皓婷1,2,邱亚峰1,史子学1,邵东华1,王水明4,刘学辉4,王志亮3,马志永1
目的 通过原核表达获得埃博拉病毒科特迪瓦型的重组核蛋白,并将蛋白纯化。方法将合成的埃博拉病毒科特迪瓦型核蛋白基因亚克隆入原核表达质粒p ET-28(a)中,构建重组表达质粒p ET-28(a)-C-NP,并将重组质粒转化BL21(DE3)感受态细菌,以IPTG诱导蛋白表达,SDS-PAGE分析表达蛋白及表达量,并用利用 His-Band Ni+柱进行亲和层析纯化,Western blo t和蛋白序列分析鉴定表达蛋白。结果所构建的重组表达质粒p ET-28(a)-C-NP序列正确,SDS-PAGE检测到目的蛋白表达,表达蛋白正确。结论成功表达并纯化了埃博拉病毒科特迪瓦型核蛋白,为后续研究奠定了基础。
埃博拉病毒;NP蛋白;原核表达;蛋白纯化
1976年,在中非苏丹南部和扎伊尔北部的埃博拉河流域暴发了一场大规模的出血热,导致苏丹284人感染,其中151人死亡;在扎伊尔导致318人感染,其中280人死亡,致死率高达88%。这种致死率极高的疾病后被命名为埃博拉出血热(Ebola hemorrhagic fever)。埃博拉出血热是由埃博拉病毒(Ebola virus,EBOV)引起的烈性人兽共患传染病,是病死率极高的一种急性多器官出血性传染病。
EBOV属于丝状病毒科(Filoviridae),与马尔堡病毒(Marberg virus)共同构成丝状病毒属(Filovirus)。根据发现地点的不同EBOV共分为五种主要的亚型,即埃博拉病毒-扎伊尔型(EBOV-Z)、埃博拉病毒-苏丹型(EBOV-S)、埃博拉病毒-莱斯顿型(EBOV-R)和埃博拉病毒-科特迪瓦型(EBOVC)[1]、以及埃博拉病毒-本迪布焦型(EBOV-B)[2]。不同亚型的毒力各不相同,其对人类毒力的强弱顺序为:EBOV-Z>EBOV-S>EBOV-B>EBOV-C>EBOV-R[2-3]。其中扎伊尔型、苏丹型、本迪布焦型、科特迪瓦型对人类有致病性,莱斯顿型仅在非人灵长类中引发疾病和死亡,人类也可能感染这种病毒从而成为无症状的病毒携带者[4-5]。目前,我国尚没有埃博拉病毒感染或输入的报道,但是,2009年菲利宾发生猪感染莱斯顿型病毒并传染给人的疫情[6],我国需要高度重视,并应做好检测和防控的技术储备。
EBOV是单股负链非分节段的RNA病毒,基因组无感染性,可编码7种蛋白,即 3’-NP-VP35-VP40-GP-VP30-VP24-L-5’[7]。目 前,国 内 关 于EBOV感染检测技术的研究很少,仅见以病毒VP40单克隆抗体为基础的抗原捕获 EL ISA方法[8]。NP蛋白是病毒核衣壳蛋白,国外学者的研究表明,NP蛋白的碳末端具有很强的抗原性,可作为抗原用于埃博拉病毒抗体的检测[9-10]。为此,本实验在国内首次构建了 EBOV科特迪瓦型NP基因的原核表达质粒,并表达成功,利用 His-Band Ni+柱进行亲和层析纯化,获得了纯化蛋白,以期为建立以NP蛋白为抗原的 EBOV感染检测技术研究打下基础。
1 材料和方法
1.1 实验材料 大肠杆菌 DH 5α、BL 21(DE3)菌体、原核表达质粒p ET-28(a)、IPTG由本实验室保存。各种限制性内切酶及各种buffer等购自宝生物公司。T4连接酶、T4连接酶所用buffer购自Invitrogen公司。普通质粒小量提取试剂盒和DNA片段回收试剂盒购自博大泰克生物技术公司,His Bank Kits蛋白质纯化试剂盒购自Novagen公司,其他试剂均为国产分析纯。埃博拉病毒科特迪瓦型NP基因(GenBank No.FJ217162.1)由南京金思特科技有限公司合成。1.2 实验方法
1.2.1 基因克隆与原核表达载体的构建 科特迪瓦型NP基因在合成时已插入Bam HⅠ和 SalⅠ的酶切位点。合成基因克隆在pUC57-NP质粒中,经Bam HⅠ和SalⅠ双酶切出,利用小片段快速纯化回收试剂盒对酶切产物进行回收。将酶切产物亚克隆入p ET-28(a)载体,构建 p ET-28(a)-EBOV-CNP重组质粒。将构建好的重组质粒p ET-28(a)-EBOV-C-NP,转化感受态 E.coli DH5α,提取质粒,用Bam HⅠ和SalⅠ进行双酶切,双酶切产物用1%琼脂糖电泳进行分析鉴定。
1.2.2 重组质粒的测序及目的基因的诱导表达重组质粒送往上海桑尼公司及上海英俊生物公司进行序列测定。将鉴定正确的重组表达质粒转化感受态 E.coli BL 21(DE3),涂板挑克隆后,接种于5 mL LB(Kanr)培养基,37℃振荡培养过夜。次日按1∶100的比例转种,振荡培养3h后,加入终浓度为
1.0 mmol/L的 IPTG,在37℃下诱导表达6 h。取在37℃下 IPTG诱导表达6h的菌液,以10 000 r/min转速,4℃离心10 m in,离心后弃上清。沉淀用20m L裂解buffer重悬,于37℃振荡裂解1h。然后超声冰浴破菌。超声裂解后的菌体,以12 000 r/min转速,在4℃下离心10 min,分别收集沉淀和上清并制样,沉淀用 20m L含 6mol/L尿素的 1×Binding buffer重悬,4℃下放置过夜。用8%SDSPA GE分析重组蛋白的表达。
1.2.3 表达产物的纯化 将诱导后表达的蛋白用His-Band Ni+柱进行亲和层析纯化,8%SDS-PA GE检测纯化效果。
1.2.4 纯化产物的Western blot分析 将收集的纯化产物制样,采用Western blot方法鉴定是否为所需目的蛋白。检测抗体为抗兔抗EBOV扎伊尔型NP多克隆抗体,本研究室制备和鉴定。
1.2.5 纯化产物的序列测定 将纯化后的蛋白送往中国科学院上海生命科学研究院蛋白质组研究分析中心,采用肽碎片序列串联质谱(M S-M S)分析技术 ,使用 4800 Plus MALD ITOF/TOF Analyzer进行序列分析。
2 结 果
2.1 p ET-28(a)-EBOV-C-NP原核重组表达载体的构建和鉴定 科特迪瓦亚型病毒NP基因全长2200bp,亚克隆入p ET-28(a)载体,对重组质粒进行Bam HⅠ和SalⅠ的双酶切。酶切产物经1%琼脂糖凝胶电泳分析,在约2200 bp处可见特异性条带,与预期相符(见图1)。表明NP基因成功克隆到上述表达质粒,同时送将重组质粒送往上海桑尼公司及上海英俊生物公司进行序列测定,结果表明序列正确没有突变。2.2 NP重组蛋白的表达 将鉴定好的p ET-28(a)-EBOV-C-NP重组质粒转化大肠杆菌 BL 21(DE3),以终浓度 1 mmol/L的IPTG诱导6h,诱导前后样品用8%SDS-PAGE电泳鉴定后,其分子量约为106kD,与理论计算所得分子量83.3KD有一定偏差(图2)。
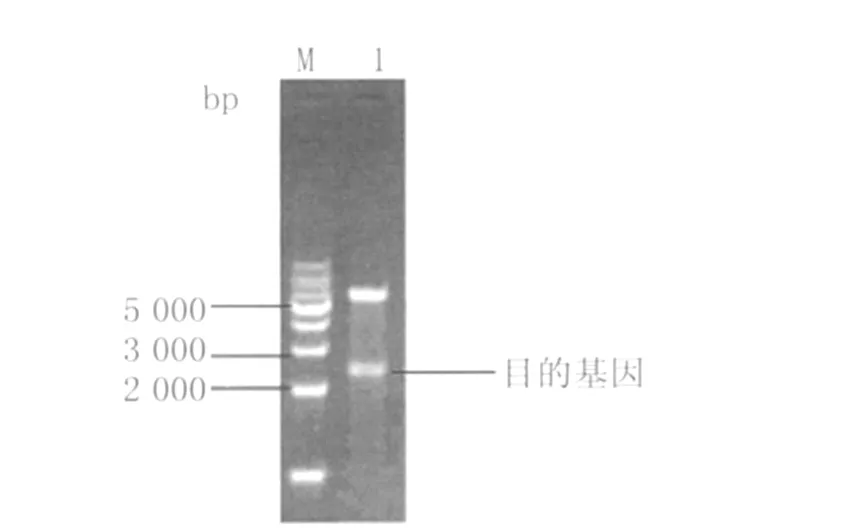
图1 重组质粒pET-28(a)-EBOV-C-NP双酶切鉴定Fig.1 Restricted enzymes digestion of pET-28(a)-NP plasm id M:1kb DNA maker;1:enzymes digestion of p ET-28(a)-EBOV-NP
图2 pET-28(a)-EBOV-NP诱导前后比较Fig.2 Expression of pET-28(a)-EBOV-NP M:Proteinmarker;1:Lysateof BL21 uninduced;2:Lysate of BL21(p ET-28(a))induced with IPTG;3:Lysate of BL21(p ET-28(a)-EBOV-C-NP)uninduced;4:Lysate of BL21(p ET-28(a)-EBOV-C-NP)induced with IPTG
将用1 mmol/L IPTG诱导前后的p ET-28(a)和p ET-28(a)-EBOV-C-NP分别超声,离心的上清和沉淀分别制样,8%SDS-PAGE检测表达情况。证明重组蛋白是以包含体的形式表达的(图3)。

图3 pET-28(a)-EBOV-NP蛋白表达形式的鉴定Fig.3 Analysis of expression of pET-28(a)-EBOV-NP M:Protein marker;1:Lysate of BL21 uninduced;2:Lysateof BL21(p ET-28(a))induced with IPTG;3:Lysate of BL21(p ET-28(a)-EBOV-C-NP)uninduced;4:Lysate of BL 21(p ET-28(a)-EBOV-CNP)induced with IPTG;5:supernatant of BL21(p ET-28(a)-EBOV-C-NP);6:pellet of(p ET-28(a)-EBOV-C-NP)
2.3 NP重组蛋白的纯化 将超声裂解后离心的沉淀用含6mol/L尿素的1×Binding buffer重悬过夜后,用 His-Band Ni+柱进行亲和层析纯化,8%SDS-PAGE检测纯化结果(图4)。
2.4 纯化产物的Western blot分析为了鉴定所表达的重组蛋白,对重组蛋白分别使用 His抗体和抗EBOV扎伊尔型的NP蛋白多克隆抗体进行Western blot分析,显色后出现特异性的蛋白条带,证实了EBOV科特迪瓦型NP重组蛋白获得了正确表达(图 5)。

图4 NP重组蛋白的纯化Fig.4 Purification of NP recombinant protein M:Protein marker;1:purification of NP recombinant protein

图5 NP重组蛋白的Western blot鉴定Fig.5 Identification of NP recombinant protein by Western blot 1:Lysate of BL21(p ET-28(a)-EBOV-C-NP)induced with IPTG;2:Purification of NP recombinant protein3:Lysate of BL21(p ET-28(a)-EBOV-C-NP)uninduced
2.5 纯化重组蛋白的序列测定 为了进一步验证NP重组蛋白,将纯化的重组蛋白采用肽碎片序列串联质谱分析技术进行氨基酸序列分析,所检测出的13个肽段序列经NCB IBLAST分析表明,纯化蛋白为埃博拉病毒科特迪瓦型核蛋白。
3 讨 论
埃博拉病毒有着极强的感染性,致死率极高,可达50%~90%[11]。对人类的生命健康安全危害很大。世界卫生组织已将埃博拉病毒列为对人类危害最严重的病毒之一。尤其在恐怖活动日益增多的当今社会,不排除EBOV被用作生化武器的可能。应该引起我们的高度重视,着手于早期防控工作[12]。
埃博拉病毒的NP、VP40和 GP蛋白是检测EBOV感染技术研发的主要候选蛋白。我国已有以病毒 VP40单克隆抗体为基础的抗原捕获EL ISA方法的报道[8]。NP蛋白为 EBOV的核衣壳蛋白质,其基因定位在基因组的3’末端,被一个前导序列所引导,编码区长大约2 217个碱基,编码一个含738个氨基酸的蛋白质[13]。NP具有很好的抗原性,国外已经建立了基于NP单克隆抗体的用于检测扎伊尔型、苏丹型、莱斯顿型病毒的抗原捕捉EL ISA方法[9]。由原核表达得到的重组NP蛋白具有良好的抗原性,并且没有感染性,可用于检测病毒特异性抗体[10]。
NP蛋白的保守性较高,抗原区域主要集中在361-464位氨基酸和630-738位氨基酸之间,可被4种亚型 EBOV的抗体所识别[9]。以扎伊尔型病毒重组NP为抗原制备的单克隆抗体,不仅可识别扎伊尔型病毒的NP蛋白,还可识别苏丹型和莱斯顿型病毒的NP蛋白,还可能与科特迪瓦型的NP反应[14]。我们实验室所制备的抗扎伊尔型病毒NP多克隆抗体同样能识别苏丹型、莱斯顿型和科特迪瓦型病毒的NP(未发表数据)。因此,制备重组NP蛋白能为埃博拉病毒检测和诊断提供重要的基础材料。
本研究发现原核表达的重组NP蛋白的分子量约为106kD,与理论计算所得分子量83.3kD有一定偏差(图2)。但是,Western blo t和蛋白序列质谱分析表明所表达的重组蛋白为目的蛋白。出现分子量大小偏差的原因可能为:在NP蛋白羧基端上的439-492位氨基酸和589-738位氨基酸两段区域为酸性区域,区域内存在的丝氨酸和苏氨酸可影响蛋白的迁移率,会对蛋白的正常迁移产生影响,使得SDS-PAGE鉴定所得分子量大于计算所得分子量。另外,NP蛋白可以和很多外源凝集素相互作用,以及翻译后修饰都是影响NP蛋白迁移率的原因[15]。
埃博拉病毒属于高危险病毒,需要在生物安全4级实验室操作。我国尚无埃博拉病毒,为此,我们根据 GenBank公布的NP基因序列,采用基因合成技术合成了 EBOV科特迪瓦型NP基因,解决了没有病毒基因的问题。通过构建原核表达质粒,并在大肠杆菌内进行了表达和纯化,表达蛋白可被特异性抗体所识别,具有良好的抗原性。现已研究证明,抗原捕获 EL ISA、竞争性 EL ISA等方法,既可检测埃博拉病毒抗原,也可检测特异性 IgM和 IgG抗体[16-17]。本实验制备的重组蛋白为埃博拉病毒的检测打下了良好的基础。
[1]Weidmann M,Mühlberger E,Hufert FT.Rapid detection p rotocol for filoviruses[J].JClin Virol,2004,30(1):94-99.
[2]Tow ner JS,Sealy TK,Khristova ML,et al.New ly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda[J].PLoS Pathog,2008,4(11):e1000212.
[3]杨涛,尹文.埃博拉病毒的研究概况[J].国外医学病毒学分册,2002,9(5):152-155.
[4]Fisher-Hoch SP,Brammer TL,Trappier SG,et al.Pathogenic potential of filoviruses:role of geographic origin of p rimate host and virus strain[J].J Infect Dis,1992,166(4):753-63.
[5]Hartman AL,Tow ner JS,Nichol ST.Ebola and marburg hemorrhagic fever[J].Clin Lab Med,2010,30(1):161-77.
[6]Barrette RW,Metwally SA,Row land JM,et al.Discovery of swine as a host for the Reston ebolavirus[J].Science,2009,325(5937):204-206.
[7]Ascenzi P,Bocedi A,Heptonstall J,et al.Ebolavirus and Marburgvirus:insight the Filoviridae family[J].Mol Aspects Med,2008,29(3):151-185.
[8]王淑杰,王喜军,胡森,等.抗埃博拉病毒VP40蛋白单克隆抗体的制备及在抗原捕捉EL ISA中的应用[J].中国预防兽医学报,2008,30(4):309-313.
[9]Saijo M,Niikura M,Ikegami T,et al.Laboratory diagnostic systems for Ebola and Marburg hemorrhagic fevers developed with recombinant proteins[J].Clin Vaccine Immunol,2006,13(4):444-451.
[10]李小波,相大鹏.埃博拉出血热及其实验室检测研究方法[J].中国人兽共患病学报,2009,25(9):899-901.
[11]Mason C.The strains of Ebola[J].CMAJ,2008,178(10):1266-1267.
[12]Geisbert TW,Jahrling PB.Towards a vaccine against Ebola virus[J].Expert Rev Vaccines,2003,2(6):777-789.
[13]高秋月,肖露平,李海燕,等.埃博拉病毒及其免疫研究进展[J].生物学教学,2009,34(7):7-9.
[14]Niikura M,Ikegami T,Saijo M,et al.Detection of Ebola viral antigen by enzyme-linked immunosorbent assay using a novel monoclonal antibody to nucleoprotein[J].J Clin Microbiol,2001,39(9):3267-3271.
[15]Shi W,Huang Y,Sutton-Smith M,et al.A filovirus-unique region of Ebola virus nucleoprotein confers aberrant migration and mediates its inco rporation into virions[J].J Virol,2008,82(13):6190-6199.
[16]Cyranoski D.Ebola outbreak has experts rooting for answ ers[J].Nature,2009,457(7228):364-365.
[17]Pourrut X,Kumulungui B,Wittmann T,et al.The natural history of Ebola virus in Africa[J].M icrobes Infect,2005,(7-8):1005-1014.
Prokaryotic expression and purification of nucleoprotein gene of Ebola virus Côte d’Ivoire type
WANG Xue-min,WANG Hao-ting,Q IU Ya-feng,SH IZi-xue,SHAO Dong-hua,WANG Shui-ming,L IU Xue-hui,WANG Zhi-liang,MA Zhi-yong
(Department of Veterinary Public Health,Shanghai Veterinary Research Institute,Chinese Academ y of A gricultural Sciences,Shanghai 200241,China)
To obtain recombinant protein of the nucleoprotein(NP)of Ebola virus Côte d’Ivoire type using p rokaryotic expression system,the synthesized NP gene was sub-cloned to generate p ET-28(a)-C-NP recombinant plasmid,which was then transformed into E.coli BL21(DE3)competent bacteria.The expression of NP recombinant protein was induced by IPTG and analyzed by SDS-PAGE.The expressed protein was purified using His-Band Ni+affinity chromatography and identified by Western blot and protein sequencing.The recombinant expression plasmid p ET-28(a)-C-NPwas obtained and the recombinant NP protein was expressed and purified.The obtained NP protein was confirmed by Western blot and protein sequencing.These results demonstrate that the NP recombinant protein was expressed and characterized.In conclusion,successfully expressed and purified Ebola virus nucleoprotein type Côte d’Ivoire aid the foundation for the follow-up study.
Ebola virus;NP protein;p rokaryotic expression;protein purification
R373.9
A
1002-2694(2011)07-0601-04
*公益性行业(农业)科研专项(200903037-06)和江苏出入境检验检疫局项目(2011KJ03)资助
马志永,Email:zhiyongma@shvri.ac.cn
1.中国农业科学院上海兽医研究所兽医公共卫生研究室,上海 200241;2.河北工程大学农学院,邯郸 056001;3.中国动物卫生与流行病学中心,青岛 266114 4.南京出入境检验检疫局
2010-11-08;
2011-02-19
