增强型绿色荧光蛋白基因与轮状病毒VP6基因融合表达载体的构建及表达
2011-01-24潘小霞张顺袁静文喻玲陈元鼎
潘小霞,张顺,袁静,文喻玲,陈元鼎
轮状病毒(rotavirus,RV)属于呼肠病毒科(Reoviridae)轮状病毒属,是引起婴幼儿急性胃肠炎的主要病原体,每年死于 RV 感染者多达 61 万余人[1]。RV 由三层蛋白组成:核心衣壳由各含12 个分子的 VP1 蛋白(转录酶)和 VP3 蛋白(鸟苷酸转移酶)及 120 个分子的 VP2 蛋白组成[2];中间层衣壳由 780 个分子的 VP6 蛋白组成,VP6是病毒的组(亚组)抗原蛋白;外层衣壳由两个具有中和抗原性的 VP4 和 VP7 蛋白组成,各含有180 个和 780 个分子。根据 VP6 蛋白抗原性差异,可将 RV 分为 A ~ G 等 7 个组,其中 A 组RV 是婴幼儿急性胃肠炎的主要病原体。根据编码框(open reading frame,ORF)核苷酸序列同源性差异,至少可以将 A 组 RV 的 VP6 分为 14 个不同的基因型[3]。虽然 VP6 蛋白不是病毒转录酶,但 VP6 蛋白的存在对病毒的转录必不可少。此外,VP6 蛋白在维持病毒形态、病毒进入细胞和组装过程中起物理受体的作用。病毒进入宿主细胞后,外壳蛋白的缺失和形成表层为 VP6 蛋白的两层病毒颗粒(double-layered particle,DLP)是转录产生mRNA 所必需的[4-5]。大量实验证明,VP4 和 VP7蛋白并非是免疫保护反应的唯一抗原,RV 中壳蛋白 VP6 也能刺激机体产生免疫保护反应。但这些试验都是在小鼠模型中完成的,如果能证实 VP6在人体内也具有安全有效的保护作用,那么研究并发展以 VP6 为基础的疫苗会具有很好的应用前景[6]。
绿色荧光蛋白(green fluorescence protein,GFP)是较好的活体分子标志物,易与目的基因形成融合蛋白且不影响自身目的基因产物的空间构象和功能。对多数宿主的生理无影响,不需依赖任何辅助因子或其他基质就能在紫外线下激发出性质稳定易检测的荧光。通过改造获得的增强型绿色荧光蛋白(enhanced green fluorescence protein,EGFP)是 GFP 的一个突变体,荧光强度更高,光漂白抗性更强。
本实验通过构建 RV VP6 蛋白基因与 EGFP蛋白基因融合表达载体并转染到恒河猴肾传代细胞 MA104 细胞中,EGFP 与目的基因 VP6 融合标记为绿色,在荧光显微镜下观察 VP6 基因的蛋白表达水平及其在细胞内的分布情况和表达量的变化,为探讨 VP6 基因在结构功能及免疫保护作用方面奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株、病毒和质粒 大肠杆菌DH5α、质粒载体 pBS(pBluescript K/S)、恒河猴肾传代细胞 MA104(用含 10% 的新生牛血清MEM 营养液培养)由本实验保存;真核表达质粒pEGFP-C1 购自日本 Clontech 公司;TB-Chen 株病毒由本实验室自 2 岁龄急性胃肠炎患者的大便样品中分离得到,由本实验室保存。
1.1.2 工具酶和生化试剂 LA Taq DNA 聚合酶、DNA 限制性核酸内切酶、T4 DNA 连接酶均购自日本 TaKaRa 公司;脂质体 Lipofectamine™ 2000购自美国 Invitrogen 公司;MEM 培养基购自美国Sigma 公司;引物合成及序列测定由上海生工生物工程技术服务有限公司完成。
1.1.3 主要仪器 Biofuge 15R 型低温冷冻离心机购自德国 Heraeus 公司;Nikon E600 型荧光显微镜、DXM1200 型数字照相机购自日本尼康公司;ImageMasterR VDS 型数字成像仪购自美国Pharmacia Biotech 公司。
1.2 方法
1.2.1 融合表达质粒的构建
1.2.1.1 引物设计 试验所用 TB-Chen 株病毒为 A 组 RV,其基因型为 G2-P[4]-I2-R2-C2-M2-A2-N2-T2-E2-H2/h2[7-9]。VP6 基因克隆自基因组中编码 VP6 的第 6 基因,该基因全长为 1356 bp,编码 397 个氨基酸,蛋白分子量约为 45 kD。基因全长核苷酸及编码氨基酸序列见 GenBank(Accession number:AY787645)。VP6 基因经基因重组克隆到质粒 pBS 上。根据 VP6 基因核苷酸序列设计并合成引物。上游引物为 5’ ATC CGCGGAGCTCCACCGCGGTGGC 3’,下游引物为5’ GTGGATCCTATTACGGGCCCGTACCGTCG 3’。上游引物和下游引物中分别引入限制性核苷酸内切酶位点 Sac (IGAGCTC)和 BamH (IGGATCC)。
1.2.1.2 TB-Chen VP6 基因的扩增 PCR 反应混合液体积为 100 µl,含有 30 ng 模板 DNA(携带 VP6 全基因的 pBS-VP6 质粒 DNA),60 pmol/L dNTPs,10 µl 10 × PCR 缓冲液,5 U Taq DNA 聚合酶,60 pmol/L 上游引物,60 pmol/L 下游引物。反应条件为 94 ℃ 预变性 3 min;94 ℃ 变性 40 s,56 ℃ 复性 40 s,72 ℃ 延伸 1 min,扩增 40 个循环;最后,72 ℃ 反应 10 min。取 5 µl PCR 扩增产物在 1.5% 的琼脂糖凝胶(含 0.5 µg/ml 溴乙锭)中电泳检测,回收目的扩增片段。
1.2.1.3 融合基因的连接和表达质粒的筛选 PCR 扩增的 VP6 基因片段及载体 pEGFP-C1质粒 DNA 分别用 Sac I 和 BamH I 双酶切后,目的基因片段和质粒载体片段在 T4 DNA 连接酶的作用下连接。连接产物转化至大肠杆菌 DH5α感受态细胞中。将转化产物涂布于含卡那霉素(30 mg/L)的 LB 平板培养。挑取单个菌落进行质粒扩增、碱裂解法制备重组质粒和酶切鉴定。重组质粒最后经核苷酸序列测定确定。
1.2.2 融合蛋白在 MA104 细胞中的表达 转染前一天,将 MA104 细胞接种到 12 孔细胞培养板中(5 × 104个/孔,内装有盖玻片)。转染时,盖玻片上的 MA104 细胞单层用不含抗生素的 PBS 洗液洗 3 次,加入不含抗生素和新生牛血清的 MEM生长培养基,每孔 800 µl;将 1.6 µg 质粒 DNA 稀释在 100 µl 不含抗生素和小牛血清的生长培养基中,轻轻混匀;将 4 µl 的脂质体 Lipofectamine™2000 稀释在 100 µl 的不含抗生素和新生牛血清的生长培养基中,轻轻混匀后在室温下孵育 5 min;将稀释的质粒 DNA 和脂质体 Lipofectamine™2000 混合,总体积为 200 µl,轻轻混匀,室温孵育 20 min,形成脂质体复合物。将脂质体复合物加到含细胞和培养基的孔中,每孔 200 µl,轻轻地前后摇动培养板,混匀,于 37 ℃, 5% CO2培养箱孵育 4 ~ 6 h 后,吸出吸附液,加入 1 ml 含抗生素和 10% 小牛血清的 MEM 培养液。转染后不同时间,在荧光显微镜下检测融合蛋白的表达结果。
2 结果
2.1 VP6 基因编码序列的 PCR 扩增
以携带 VP6 全基因的质粒 pBS-VP6 为模板扩增 VP6 基因后,在 1.5% 琼脂糖凝胶电泳中检测,在预期位置(1116 bp)检测到一扩增产物条带,大小正确(图 1)。
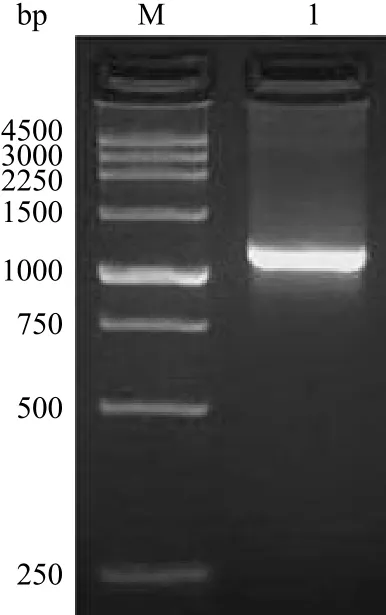
图 1 VP6 基因的 PCR 扩增Figure 1 PCR of VP6 gene
2.2 融合表达质粒 pEGFP-VP6 的构建
VP6 的 PCR 回收产物及载体 pEGFP-C1 质粒 DNA 经过 Sac I 和 BamH I 双酶切后,在 T4 DNA 连接酶的作用下连接,然后转化到 DH5α 感受态细胞。经碱裂解法提取重组质粒。重组质粒进行 Sac I/BamH I 酶切鉴定(图 2)。酶切鉴定后的pEGFP-VP6 进行双向核苷酸序列测定。结果表明,插入表达质粒 pEGFP-C1 上的 VP6 编码基因序列完整,方向正确,融合表达质粒 pEGFP-VP6 构建成功。
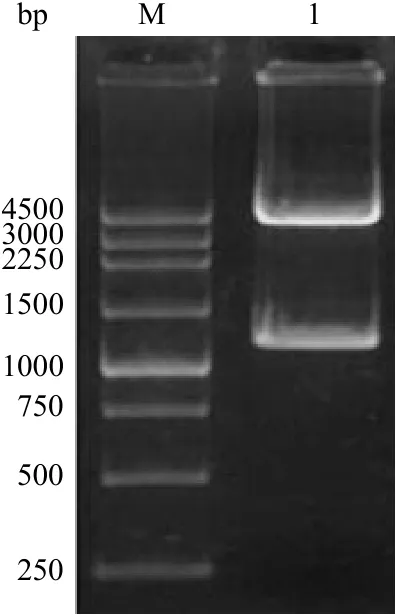
图 2 重组质粒 pEGFP-VP6 的酶切鉴定Figure 2 Identification of expression plasmid pEGFP-VP6
2.3 融合蛋白 EGFP-VP6 在 MA104 细胞中不同时间的表达
融合表达载体 pEGFP-VP6 及绿色荧光蛋白载体 pEGFP-C1 转染 MA104 细胞后,在荧光显微镜下观察,并以未转染的细胞做空白对照。结果显示,融合蛋白 EGFP-VP6 分布于细胞质中,呈较均匀的分布状态(图 3B),与 RV 感染细胞中合成的 VP6 蛋白在细胞质中形成毒质体(viroplasma)样结构有较大的差别[10]。细胞核中没有观察到融合蛋白。绿色荧光蛋白载体pEGFP-C1 的转染效率较高,荧光蛋白均匀分布于整个 MA104 细胞中(包括细胞核)(图 3C)。在转染 3 h 后,即可观察到细胞发出荧光,随着时间的延长,发出荧光的细胞不断增多,荧光强度增强,围绕细胞核向周围弥散扩散,在转染 21 h 后,蛋白表达稳定,转染 27 ~ 39 h 之间,荧光最多。72 h后,荧光淬灭,细胞形态消失(图 4)。未转染的对照细胞没有检测到荧光。
3 讨论
VP6 作为 RV 的组和亚组抗原蛋白在病毒株的分类鉴定上具有重要意义[11],作为疏水性蛋白的VP6 蛋白也具有较强的抗原反应性和免疫原性[12]。另外,在小鼠模型中用 VP6 蛋白或 VP6 蛋白编码 DNA 免疫能产生体内保护[4,12-14]。有佐剂的条件下,无论是口服、鼻腔免疫还是肠道免疫,VP6 蛋白疫苗都能有效降低或防止 RV 排出。同时 VP6蛋白也具有 CD4+T 细胞表位和交叉反应的细胞毒性 T 淋巴细胞(cytotoxic T lymphocyte,CTL)表位,以 VP6 蛋白作为疫苗抗原或疫苗基质可能会有较好的应用前景。
研究表明,在有佐剂 LT(R192G)条件下,使用麦芽糖结合 VP6 蛋白(MBP::VP6)鼻腔免疫小鼠,发现几乎所有的免疫小鼠都能免受 RV EDIM 株的攻击,排毒水平降低 > 98%,远远大于MBP::VP4 或 MBP::VP7 的保护作用[15]。Feng等[4]研究发现,VP6 蛋白特异性 IgA 单克隆抗体,如 7D9 可以使 SCID 小鼠免受 RV 感染,并能清除 RV 慢性感染。认为 VP6 蛋白的特异性单克隆抗体通过与 VP6 蛋白结合后引起 VP6 蛋白三聚体构象发生变化,处于核心的病毒 RNA 聚合酶活性降低,从而使病毒颗粒失去了转录活性,在病毒复制循环过程的一开始就阻止了病毒在细胞内的转录复制。
在小鼠体内,众多的实验表明,经 RV 的 VP6蛋白免疫动物后在动物体内确实能引起抗 RV 感染的作用,但目前对 VP6 蛋白的免疫保护机制还不是很清楚。VP6 蛋白诱导机体产生的 IgA 在跨细胞转运中可能和小肠上皮细胞中缺失外壳蛋白的 RV 颗粒相互作用进而在细胞内中和病毒[4],也可能是 VP6 抗体和 VP6 蛋白结合后阻断了 VP6蛋白与细胞上受体的相互作用,或诱导病毒颗粒发生构象变化,使病毒不能吸附到宿主细胞上。对于抗 VP6 抗体的具体保护机制仍有待进一步的研究。
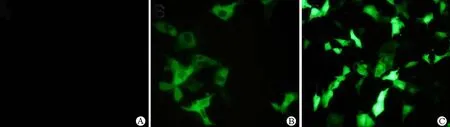
图 3 重组质粒 pEGFP-VP6 在 MA104 细胞中的表达(A:未转染的 MA104 细胞对照;B:融合表达载体 pEGFP-VP6 转染 MA104 细胞;C:绿色荧光蛋白载体质粒 pEGFP-C1 转染 MA104 细胞)Figure 3 The expression of recombinant plasmid pEGFP-VP6 in MA104 cells (A: The no-transfected cells; B: The cells transfected with plasmids pEGFP-VP6; C: The cells transfected with plasmids pEGFP-C1)

图 4 融合蛋白 EGFP-VP6 在 MA104 细胞中不同时间的表达情况(A:3 h;B:9 h;C:15 h;D:21 h;E:27 h;F:33 h;G:39 h;H:72 h)Figure 4 Analysis of fusion protein EGFP-VP6 expression in MA104 cells at 3 h (A), 9 h (B), 15 h (C), 21 h (D), 27 h (E), 33 h (F),39 h (G), 72 h (H) transfection with plasmid pEGFP-VP6
pEGFP-C1 是一个能表达增强型绿色荧光蛋白的质粒,由人工合成和优化且适于哺乳动物细胞的表达,主要用于判定转基因的效率和目的基因定位,以及目的基因表达与功能关系的研究。在本实验中,我们以携带 VP6 全基因的质粒 pBS-VP6 为模板扩增 VP6 基因,将扩增片段双酶切后连接到质粒 pEGFP-C1 中,构建重组表达载体 pEGFP-VP6,并用脂质体的方法转染到恒河猴肾细胞 MA104中。在转染 3 h 后,即可观察到细胞发出荧光,蛋白分布在胞质中,但并没有像 RV 感染细胞中合成的 VP6 蛋白可在细胞质中形成毒质体样结构[10]。该结果提示,由于没有其他 RV 成分的相互作用,与 EGFP 融合表达的 VP6 蛋白没有处于参与转录或组装过程中物理受体的状态。本研究通过绿色荧光蛋白的示踪技术,证实了 VP6 基因在真核细胞中的表达及分布状况,并为进一步研究 VP6 基因的功能及作用机制奠定了基础。
[1] Parashar UD, Gibson CJ, Bresse JS, et al. Rotavirus and severe childhood diarrhea. Emerg Infect Dis, 2006, 12(2):304-306.
[2] Estes MK, Cohen J. Rotavirus gene structure and function. Microbiol Rev, 1989, 53(4):410-449.
[3] Chen YD, Fan YC, Li CY. Classification and nomenclature for rotaviruses. Int J Virol, 2009, 16(4):115-120. (in Chinese)陈元鼎, 范耀春, 李传印. 轮状病毒分类与命名. 国际病毒学杂志,2009, 16(4):115-120.
[4] Feng N, Lawton JA, Gilbert J, et al. Inhibition of rotavirus replication by a non-neutralizing, rotavirus VP6-specific IgA mab. J Clin Invest,2002, 109(9):1203-1213.
[5] Ayala-Breton C, Arias M, Espinosa R, et al. Analysis of the kinetics of transcription and replication of the rotavirus genome by RNA interference. J Virol, 2009, 83(17):8819-8831.
[6] Pan XX, Zhang S, Chen YD. Advances in Study on the VP6 of Rotavirus. Chin J Vaccines and Immunization, 2011, 17(2):176-179.(in Chinese)潘小霞, 张顺, 陈元鼎. 轮状病毒VP6蛋白的免疫学研究进展. 中国疫苗和免疫, 2011, 17(2):176-179.
[7] Chen Y, Wen Y, Liu X, et al. Full genomic analysis of human rotavirus strain TB-Chen isolated in China. Virology, 2008, 375(2):361-373.
[8] Wen YL, Li CY, Fan YC, et al. NSP5/NSP6 of rotavirus strain TB-Chen and Preliminary genotyping analysis. Chin J Virol, 2009,25(5):354-358. (in Chinese)文喻玲, 李传印, 范耀春, 等. TB-Chen株轮状病毒NSP5/NSP6及基因型研究. 病毒学报, 2009, 25(5):354-358.
[9] Chen YD, Liu X, Xiong XY, et al. Cloning of full genome and genotyping of a group A human rotavirus. China Biotechnol, 2008,28(2):25-31. (in Chinese)陈元鼎, 刘晓, 熊新宇, 等. A组人轮状病毒全基因组克隆和基因型分析. 中国生物工程杂志, 2008, 28(2):25-31.
[10] Yin XX, Wen YL, Zhao QH, et al. Immunofluorescence assay of rotavirus VP6 protein. Chin J Biologicals, 2008, 21(5):434-437.(in Chinese)尹兴晓, 文喻玲, 赵庆欢, 等. 轮状病毒VP6蛋白的免疫荧光检测.中国生物制品学杂志, 2008, 21(5):434-437.
[11] Greenberg H, McAuliffe V, Valdesuso J, et al. Serological analysis of the subgroup protein of rotavirus using monoclonal antibodies. Infect Immun, 1983, 39(1):91-99.
[12] Yang K, Wang S, Chang KO, et al. Immune responses and protection obtained with rotavirus VP6 DNA vaccines given by intramuscular injection. Vaccine, 2001, 19(23-24):3285-3291.
[13] VanCott JL, Prada AE, McNeal MM, et al. Mice develop effective but delayed protective immune responses when immunized as neonates either intranasally with nonliving VP6/LT(R192G) or orally with live rhesus rotavirus vaccine candidates. J Virol, 2006, 80(10):4949-4961.
[14] Dennehy M, Bourn W, Steele D, et al. Evaluation of recombinant BCG expressing rotavirus VP6 as an anti-rotavirus vaccine. Vaccine,2007, 25(18):3646-3657.
[15] Choi AH, McNeal MM, Basu M, et al. Intranasal or oral immunization of inbred and outbred mice with murine or human rotavirus VP6 proteins protects against viral shedding after challenge with murine rotaviruses. Vaccine, 2002, 20(27-28):3310-3321.
