低温保存的GFP标记脂肪源性干细胞体外构建组织工程骨的研究
2011-01-24刘广鹏孙剑李宇琳周恒崔磊
刘广鹏,孙剑,李宇琳,周恒,崔磊
脂肪源性干细胞(adipose-derived stem cells,ASCs)是存在于脂肪组织中的一类成体干细胞,可以向中胚层多种细胞分化[1-2]。近年来的研究表明,因获取时对机体损伤小、培养扩增后数量充足、且自体细胞避免了免疫排斥反应等特点,ASCs 已经成为骨组织工程种子细胞的重要来源之一[3]。本实验室在运用组织工程技术修复大动物骨缺损的研究基础上,建立了一套完整的绿色荧光蛋白(green fluorescent protein,GFP)基因标记技术,可以直接追踪 GFP 标记的细胞在体内的分化与转归,为组织工程研究提供了一种简便、灵敏、可靠而又直观的细胞标记示踪方法[4]。本实验则针对低温保存是否会对 GFP 标记的 ASCs 接种支架材料后的体外生长特性及成骨能力产生影响进行了相关的研究,以期为验证低温保存后的 ASCs 作为组织工程骨种子细胞的可行性提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 GFP 逆转录病毒由本实验室自行构建[5];PT67 包装细胞为美国 Clotech 公司产品;G418 培养液为上海华舜生物工程有限公司产品;DMEM 低糖培养基为美国 Hyclone 公司产品;胎牛血清购自美国 Gibco 公司;I 型胶原酶、地塞米松、β-甘油磷酸钠、2-磷酸抗坏血酸、Hoechst 33258 荧光染料、二甲基亚砜(DMSO)、碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒均购自美国 Sigma 公司;骨钙蛋白(osteocalcin,OCN)含量检测试剂盒购自美国 Biomedical Technologies 公司。
1.1.2 试验动物 纯种 Beagle 犬 4 只,1 岁龄,雌雄不限,体重 15 ~ 18 kg,上海农学院提供。
1.2 方法
1.2.1 犬 ASCs 的分离和培养 1 岁龄 Beagle犬 4 只,雌雄不限,麻醉后无菌条件下取腹股沟皮下脂肪组织约 15 g。将脂肪组织充分剪碎后,以0.075% 的 I 型胶原酶 37 ℃ 振荡消化 25 min。1500 × g 离心 10 min,收集沉淀细胞,以 4 ×104/cm2密度接种于直径 100 mm 细胞培养皿中,加入含 10% 胎牛血清的低糖 DMEM 培养液,37 ℃、5% CO2、100% 湿度条件下常规培养。24 h后首次换液,以后每周换液 2 次。当细胞生长至70% ~ 80% 融合状态时,以 1:3 的比例消化传代(0.25% 胰蛋白酶 + 0.02% EDTA)。选用第 2 代(Passage 2,P2)细胞进行以下实验。
1.2.2 重组 GFP 逆转录病毒(GFP-RV)载体制备与细胞转染 重组 GFP-RV 构建过程见文献[5]。取生长状态良好的 PT67 包装细胞接种到35 mm 细胞培养皿中,加入含 10% 胎牛血清的DMEM 培养液,置于 37 ℃、5% CO2培养箱中培养 18 ~ 24 h。待细胞贴壁生长达 70% 融合时,弃去培养液,磷酸盐缓冲液(PBS)洗涤细胞 1 次,滴加含 Lipofectamin(20 μl)和质粒 DNA(4.9 μg)的无血清 DMEM 培养液 1 ml,轻轻混匀,置37 ℃、5% CO2培养箱中培养 24 h 后更换普通培养液。4 d 后,用含 400 mg/L 的 G418 培养液筛选。抗性克隆初步形成后,观察其绿色荧光的强度,将抗性克隆移出,继续用 G418 培养基筛选,扩增至全部形成抗性细胞克隆,以含 20% 胎牛血清的DMEM 培养液培养传代,收集含重组 GFP-RV 的PT67 细胞上清培养液,以 0.22 μm 无菌滤膜过滤,装入 50 ml 离心管内,于 4 ℃ 储存备用。
取生长至 80% 融合状态的 ASCs,以无血清DMEM 培养液洗涤 1 次,加入上述病毒液约10 ml/培养皿。同时加入 Polybrene(10 mg/L)以增强转染率。12 h 后改用 10% 胎牛血清的 DMEM培养液培养,待细胞接近完全融合状态时,加入含300 mg/L 的 G418 培养液筛选并扩增抗性克隆。
1.2.3 ASCs 低温冻存与复苏 消化收集 GFP转染的第 2 代 ASCs,加入 4 ℃ 预冷的冻存液(10% DMSO,40% FBS,50% 低糖 DMEM),调整细胞密度为 1.0 × 107/ml,转移到 2.0 ml 细胞冻存管中,4 ℃ 放置 30 min,–20 ℃ 放置 2 h,–70 ℃ 放置 24 h,然后转入液氮罐内。细胞在–196 ℃ 液氮中保存 4 周后取出,置入 37 ℃ 水浴箱,快速复苏,台盼蓝染色计算复苏细胞的存活率,并按下式计算复苏细胞的存活率:细胞存活率 = 台盼蓝拒染(透明)的细胞数/总细胞数 ×100%。
复苏细胞经 PBS 洗涤 3 次,去除冻存液成分,按 0.5 × 106/皿的密度接种培养皿,培养至 80% ~90% 融合时,消化收集细胞接种脱钙骨材料。
1.2.4 细胞接种 DBM 材料 选择孔隙率较为均匀的猪股骨来源的部分脱钙骨基质(本实验室制备),制成 5 mm × 5 mm × 5 mm 的立方体备用。消化收集细胞,调整密度为 1.0 × 106/ml,均匀地接种在 DBM 上,每块材料接种 40 μl 细胞悬液。培养箱内静置 4 h 后,加入成骨诱导培养液继续培养,每周换液 2 次。成骨诱导培养液成分为:低糖 DMEM 基础培养液,10% 胎牛血清,10 nmol地塞米松,10 mmol β-甘油磷酸钠,50 μmol 2-磷酸抗坏血酸。对照组为未经低温冻存复苏的 P2 代细胞。
1.2.5 激光共聚焦显微镜观察 ASCs 接种DBM 材料后每天在激光共聚焦显微镜下观察细胞在材料上的生长情况,连续 1 周。GFP 激发波长488 nm,发射波长 530 nm。
1.2.6 细胞在材料上的增殖与成骨检测 实验组与对照组的细胞材料复合物置于 24 孔培养板中成骨诱导培养,每隔 48 h 两组各取 4 份细胞材料复合物测定 DNA 含量(Hoechst 33258 荧光比色法)[3],根据标准曲线换算为细胞数量,观察细胞在材料上的增殖情况。同时采用磷酸对硝基苯酯二钠盐(p-nitrophenylphosphate disodium salt,PNP)比色法测定细胞内 ALP 的活性,并以 OCN 试剂盒检测细胞产生 OCN 的含量,实验方法参照试剂盒操作程序。
1.3 统计学分析
采用 SPSS10.01 统计软件包进行分析。每组共计 4 例样本,各检测时间点每组每例取4 孔细胞,重复 3 次。DNA 细胞数量、ALP 活性和 OCN含量的数据以±s 表示,组间比较采用配对t 检验,P < 0.05 认为差异有统计学意义。
2 结果
2.1 复苏细胞存活率
复苏细胞存活率为(91.42 ± 1.87)%(n = 4),表明低温冻存方法对犬 ASCs 的细胞活性无显著影响。
2.2 细胞材料复合物的激光共聚焦显微镜观察
低温保存复苏后的 ASCs 在 DBM 上呈多层排列,随培养时间延长分泌大量的细胞外基质,细胞融合成片,发出绿色荧光(图 1)。
2.3 细胞增殖检测
DNA 含量检测显示低温保存前后的 ASCs在 DBM 材料上增殖良好,12 d 后细胞数量达到峰值。实验组与对照组细胞的增殖趋势基本一致,表明低温保存对细胞的增殖活性无明显影响(图 2)。

图 1 低温保存复苏后的 ASCs 在 DBM 上随培养时间延长数量逐渐增多,细胞融合成片,发出绿色荧光(A:3 d;B:7 d)Figure 1 The laser confocal microscopy observation showed that the cryopreserved, GFP-labeled ASCs proliferated well on the DBM scaffold with time, excreting large amounts of extracellular matrix (A: 3 d; B: 7 d).
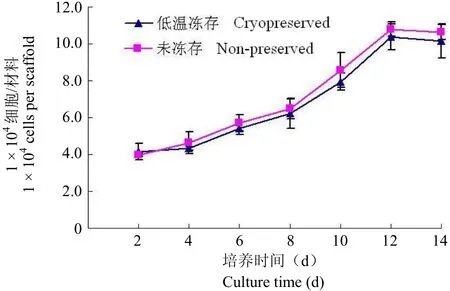
图 2 低温保存前后的 ASCs 的细胞生长曲线。细胞数量逐渐增加,第 12 天达到最高峰,随后保持在相对较高的水平。两组在各时间点比较,差异无显著性(n = 4,P > 0.05)Figure 2 The growth curves of the cryopreseved and non-preserved ASCs. Cell numbers from both groups increased steadily, and reached the plateau at day 12. No significant difference could be found at each time point checked (n = 4,P > 0.05).
2.4 ALP 活性测定
低温保存前后的 ASCs 在 DBM 上的 ALP表达活性均随培养时间延长而不断增加,分别从第1 天的 0.962 U/万细胞和 1.118 U/万细胞上升到培养 14 d 时的最高值 7.684 U/万细胞和 7.916 U/万细胞。两组细胞 ALP 活性的变化是平行的,在各检测时间点无显著性差异(图 3)。
2.5 OCN 含量测定
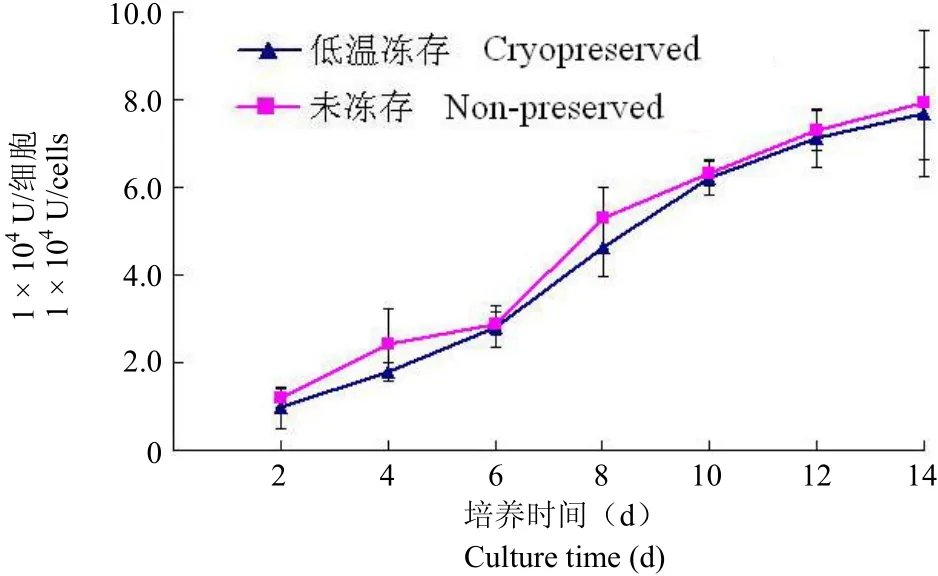
图 3 低温保存前后的 ASCs 随诱导时间的延长 ALP 活性递增(n = 4,P > 0.05)Figure 3 The measurement of ALP activity of the cryopreserved and non-preserved ASCs showed the steady increase in both groups (n = 4, P > 0.05).
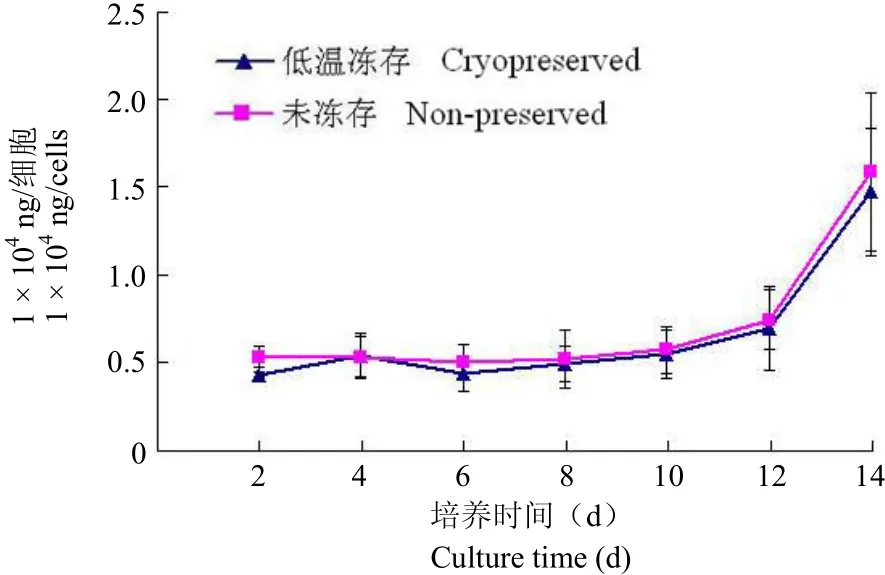
图 4 低温保存前后的 ASCs 经成骨诱导 12 d 后,OCN含量出现明显上升,两组的检测无明显差异(n = 4,P > 0.05)Figure 4 After 12 days of osteogenic induction, the OCN content was dramatically increased in the cryopreserved and non-preserved ASCs. No difference of the OCN content was found between these two groups (n = 4, P > 0.05).
实验组与对照组的细胞材料复合物分泌 OCN的量在前 12 天基本保持在比较恒定的水平,第12 天后进入较快增长期,两者的比较无明显差异,表明低温保存对细胞在 DBM 上合成分泌 OCN无明显影响(图 4)。
3 讨论
如何获得足量的种子细胞,解决种子细胞体外大规模扩增、冻存及建立细胞库等问题一直是组织工程研究的重要内容[6]。ASCs 来源于机体的脂肪组织,是继骨髓基质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)后在干细胞领域展开广泛研究的一类成体干细胞。ASCs 不仅与BM-MSCs 具有相似的干细胞表面标志,也具有向骨、软骨、脂肪、肌肉和神经等细胞分化的能力[1-2]。由于脂肪组织常被视为“多余”组织,且分布广泛,来源充足;并且抽吸脂肪组织对患者无额外创伤,患者易于接受,无心理顾虑。因此,ASCs 作为组织工程新的种子细胞来源,其应用具有良好的前景。
组织工程产品的保存是包括组织工程骨在内所有组织工程化组织产业化发展所面临的重要问题。随着细胞低温保存技术的发展,目前已可在体外长期保存多种细胞,例如胚胎干细胞、骨髓间充质干细胞及各种终末分化细胞等[6]。低温保存技术将有可能成为组织工程种子细胞的常规保存方法,从而真正解决种子细胞体外扩增时间长与临床患者无法长时间等待之间的矛盾。
但是,对于组织工程化组织和器官的构建,细胞在生物材料上的增殖、分化及合成分泌细胞外基质的功能对最终能否在体内形成相应的组织或器官并发挥其功能起着十分重要的作用。低温保存是否会影响 ASCs 在三维支架材料上的增殖、合成与分泌基质及组织工程骨的形成,相关的研究较少。故本实验对低温保存是否会影响 ASCs 在 DBM上的体外增殖及成骨潜能进行了研究。
GFP 是一种比较成熟的荧光蛋白,已广泛应用于细胞标记示踪[7]。本实验采用逆转录病毒转染法使编码 GFP 的基因序列整合到靶细胞染色体中,GFP 蛋白能够随细胞生长而稳定表达,从而为骨组织工程种子细胞标记提供了一种快速、简便、灵敏、可靠而直观的方法。本实验采用 GFP 标记技术观察到低温保存后的 ASCs 在 DBM 上生长良好,增殖旺盛,证实低温冻存不影响 ASCs 的 GFP 表达和在 DBM 上的增殖能力。
ASCs 成骨诱导分化为成骨细胞是构建组织工程骨的前提条件。ALP 是成骨过程中分泌的特异性蛋白质,其活性的高表达是成骨细胞早期分化的特异性标志[8]。OCN 与骨基质的羟基磷灰石有较高的亲和力,是成骨分化的终末期标志之一[9]。因此,本实验分别测定了 ALP 活性及 OCN 含量的表达分泌情况,以观察低温保存的 ASCs 在 DBM上的成骨分化能力。结果发现低温保存前后的ASCs 在 DBM 上的 ALP 活性与 OCN 表达量在测定期内不断增长,显示低温保存不影响 ASCs在 DBM 上的成骨分化。
综上所述,本实验证实低温保存不影响犬ASCs 稳定表达 GFP,对细胞在三维支架材料上的体外增殖及成骨能力也无明显影响,为验证低温保存后的 ASCs 作为组织工程骨种子细胞的可行性提供了实验依据。
[1] Zuk PA, Zhu M, Ashjian P, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell, 2002, 13(12):4279-4295.
[2] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng, 2001,7(2):209-228.
[3] Cui L, Liu B, Liu G, et al. Repair of cranial bone defects with adipose derived stem cells and coral scaffold in a canine model. Biomaterials,2007, 28(36):5477-5486.
[4] Yuan J, Liu DL, Zhou GD, et al. Use of GFP labelling to monitor tissue engineered bone formation in nude mice. Acad J Shanghai Second Med Univ, 2002, 24(4):235-237, 266. (in Chinese)袁捷, 刘德莉, 周广东, 等. 应用GFP标记技术示踪裸鼠体内组织工程化骨的形成. 上海第二医科大学学报, 2002, 24(4):235-237,266.
[5] Liu DL, Hu XJ, Wu JJ, et al. Construction of green fluorescent protein retroviral vector and its expression in various cell types. Chin J Cell Mol Immunol, 2002, 18(5):424-425, 438. (in Chinese)刘德莉, 胡晓洁, 吴娟娟, 等. 绿色荧光蛋白逆转录病毒载体的构建及其表达. 细胞与分子免疫学杂志, 2002, 18(5):424-425, 438.
[6] Liu GP, Shu CF, Yin S, et al. The effect of cryopreservation on the growth and osteogenesis capability of human bone marrow stromal cells cultured on demineralized bone matrix. Chin J Orthop Trauma,2006, 8(9):933-937. (in Chinese)刘广鹏, 舒朝锋, 尹烁, 等. 低温保存对人骨髓基质干细胞在脱钙骨上体外增殖及成骨能力的影响. 中华创伤骨科杂志, 2006,8(9):933-937.
[7] Sun J, Li YL, Wang HJ, et al. The in vitro growth character of GFP labeled adipose divided stromal cells in coral scaffords. J Tissue Eng Reconstr Surg, 2006, 2(6):316-317. (in Chinese)孙剑, 李宇琳, 王衡健, 等. 绿色荧光蛋白标记的犬脂肪干细胞体外复合珊瑚材料的生长特性. 组织工程与重建外科杂志, 2006,2(6):316-317.
[8] Dong J, Uemura T, Shirasaki Y, et al. Promotion of bone formation using highly pure porous β-TCP combined with bone marrow-derived osteoprogenitor cells. Biomaterials, 2002, 23(23):4493-4502.
[9] Liu G, Shu C, Cui L, et al. Tissue-engineered bone formation with cryopreserved human bone marrow mesenchymal stem cells.Cryobiolgoy, 2008, 56(3):209-215.
