拟南芥AtMYB61基因的克隆及表达载体构建
2011-01-23任永兵曹树青
王 云, 任永兵, 杨 硕, 韩 宇, 陶 杨, 曹树青
(合肥工业大学生物与食品工程学院,安徽合肥 230009)
0 引 言
随着一些抗逆基因的鉴定和抗逆机理不断深入研究,将外源抗逆基因导入植物的基因工程技术,在提高植物抗逆性方面具有更广泛的应用前景。但植物的抗逆应答是一系列相关基因连续表达调控的极其复杂的调控网络。在整个调控网络中,转录因子能调控多个相关基因的表达,所以增强转录因子的调控是提高植物抗逆性更有效的方法[1]。MYB转录因子是拟南芥中最大的基因家族[2]。该基因家族主要在植物的生长发育方面发挥重要作用,如植物次级代谢、信号传导、器官形成等方面[3]。另外,也有一部分参与了逆境胁迫介导的细胞应答[4-6]。大量研究证实,一些MYB转录因子的过量表达可以显著增加植物对逆境的耐受性[7,8]。
MYB61转录因子具有DNA结合结构域和转录调节结构域,其功能相当广泛,参与重金属、低磷和干旱等胁迫的信号调节,植物重金属胁迫与氧化胁迫是相关的[9]。AtMYB61基因在植物中过量表达,有利于进一步研究AtMYB61基因的抗逆分子机理。因此,本文利用RT-PCR克隆AtMYB61基因,并构建了 pCAMBIA2301-At-MYB61植物表达载体,为转基因改良植物抗逆性和进一步研究AtMYB61基因的抗逆分子机理奠定了基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料
哥伦比亚野生型拟南芥(Arabidopsis thaliana)植株,由美国拟南芥种质资源库提供,后由本实验室繁衍,贮存。
1.1.2 主要试剂
限制性内切酶 Eco91Ⅰ(BstEⅡ)为 Fermentas公司产品;TransTaq Polymerase High Fidelity(HiFi)为北京全式金产品;DNA凝胶纯化试剂盒、T4 DNA连接酶及氨苄青霉素(进口分装)为大连宝生物公司产品;First-Strand cDNA Synthesis Kit购自上海申能博彩生物科技公司;EZ-10 Spin Column Plasmid Mini-Preps Kit购自 BIO BASIC公司。其它试剂均为分析纯。
1.1.3 菌株和质粒
大肠杆菌 DH5α由本实验室保存,农杆菌C58为中国科学技术大学提供;pUCm-T载体和pCAMBIA2301载体均为本实验室保存。
1.2 方 法
1.2.1 拟南芥幼苗的培养
用0.1%的HgCl2溶液浸泡种子3 min,去掉HgCl2溶液,再用无菌水冲洗5次。然后将拟南芥种子点种于MS固体培养基上,置于4℃冰箱中春化2 d后,转置于光照强度为 100 μ mol/(m2·s)、22/18℃、16/8 h光周期条件下培养14 d。
1.2.2 常规分子克隆实验技术
电泳、DNA切胶回收、酶切、大肠杆菌和农杆菌感受态制备、转化、质粒提取等操作方法参见文献[10]。
1.2.3 拟南芥AtMYB61基因的克隆
采用Trizol法提取拟南芥幼苗总RNA。拟南芥cDNA合成以拟南芥幼苗总 RNA为模板,采用First-Strand cDNA Synthesis Kit使用说明合成cDNA。
拟南芥AtMYB61基因cDNA的PCR扩增所用引物是根据GenBank中 AtMY B61基因mRNA序列,用Primer Premier 5.0软件设计,并在上游和下游引物的 5′端分别加入 BglⅡ、BstEⅡ酚切位点和2个保护碱基。上游引物:
5′-GA AGAT CTA TGGGGAGACAT TCT TGCTG TT-3′;下 游引 物 :5′-CGGGTCACCCTAAAGGGACTGACCA-3′。 以cDNA为模板进行PCR扩增,反应条件为:95℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸90 s,共30个循环,72℃延伸10 min,4℃终止反应。PCR产物经1%琼脂糖凝胶电泳检测,并回收纯化。
拟南芥AtMYB61基因TA克隆与鉴定。将回收纯化的AtMYB61基因DNA,用T4 DNA链接酶与pUCm-T载体连接,再转化大肠杆菌DH5α感受态细胞,用含有100 μ g/mL 氨苄青霉素的LB固体培养基筛选阳性克隆。
挑取单菌落在装有1 mL的LB和1.5 mL的20 μ g/mL Amp离心管中37 ℃下培养 8~10 h。 取50 μ L 培养物,煮沸5 min,5 000 r/min,离心2 min后,取1~2 μ L上清进行PCR检测。菌落PCR验证后的菌液抽提质粒,用双酶切(BstEⅡ和BglⅡ)切下目的条带,电泳检测,并回收纯化。将经抽提质粒双酶切(BstEⅡ和BglⅡ)并做PCR鉴定后的阳性克隆菌落摇菌,菌液送至上海生物工程公司测序。
1.2.4 植物表达载体的构建
(1)植物表达载体 pCAMBIA2301和 At-MYB61基因的重组。提取 AtMYB61-pUCm-T载体,并用BstEⅡ和BglⅡ完全双酶切切下目的基因片段,电泳检测并回收纯化。pCMBIA2301载体用BstEⅡ完全酶切,电泳检测并回收目标载体片段,此载体片段再用BglⅡ部分酶切,检测并回收目标载体片段。将该载体片段与目的基因片段用T4 DNA连接酶连接。
(2)重组表达载体导入农杆菌。用电转化法将重组表达载体导入农杆菌感受态细胞中,电转化参数为:电压2 500 kV/cm;电容 25 F;电阻500 Ψ。电击3~5 ms后,取出电击杯,迅速加入800 μ L的 LB液体培养基,混匀并转移至1.5 mL的EP管中,在 28 ℃震荡培养 3 h;取 100 μ L菌液涂布于含 Gen(50 μ g/mL)和 Kan(50 μ g/mL)的LB平板中 28℃培养 24 h,即可长出阳性克隆。
(3)阳性pCAMBIA2301-AtMYB61克隆的菌落PCR与酶切鉴定。随机挑取单菌落,在装有1 mL的 LB和 1.5 mL的抗生素的离心管中28℃培养 12 h左右。取50 μ L培养物,煮沸5 min,5 000 r/min离心2 min,取 1~ 2 μ L 上清进行PCR扩增后电泳检测。选取菌落PCR验证后的菌液抽提质粒,并用BstEⅡ和BglⅡ双酶切后,电泳检测。
2 结果与分析
2.1 AtMYB61基因cDNA的PCR扩增
提取拟南芥幼苗总RNA,用高保真反转录酶反转录成cDNA,再用高保真DNA聚合酶扩增AtMYB61基因片段。实验中所获得的目的片段与预期大小一致,CDS+酶切位点1 114 bp,两端具有相应的酶切位点,如图1所示。
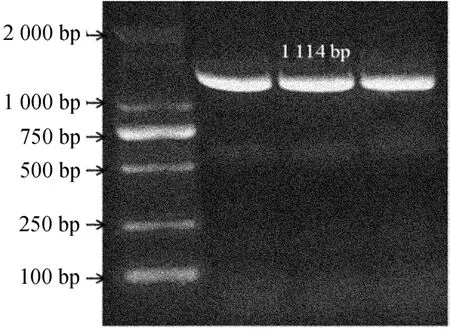
图1 AtMYB61基因cDNA克隆
2.2 AtMYB61基因TA克隆与鉴定
目的基因与pUCm-T载体连接并将连接产物纯化,用热击法导入大肠杆菌DH5α感受态细胞中,用含100 μ g/mL氨苄青霉素的 LB平板筛选阳性单克隆。AtMYB61基因 TA克隆菌落PCR和酶切鉴定如图2所示,实验结果表明,所挑选的几个单菌落均为含有重组质粒的阳性克隆,其大小1 101 bp,所用引物没有酶切位点。提取质粒,经双酶切(BstEⅡ和BglⅡ)后,电泳检测并回收。其酶切产物与扩增产物经对比后发现大小基本一致,如图2b所示,其大小为1 113 bp。选取已验证菌液送至上海生物工程公司测序。测序结果表明,扩增结果与数据库中的核苷酸序列完全一致,表明高保真聚合酶的扩增准确无误,基因克隆正确。经完全双酶切(Bst EⅡ和BglⅡ)获得的目的基因片段,可用于植物表达载体的构建和转基因。

图2 AtMYB61基因 TA克隆菌落PCR和酶切鉴定
2.3 重组T载体切下AtMYB61基因
选取AtMYB61-pUCm-T载体阳性克隆,摇菌培养,抽提质粒,用 BstEⅡ和BglⅡ完全双酶切切下目的基因片段,如图3所示。电泳检测并回收纯化,大小为1 113 bp。载体被切成了大小不等的几段,是由于目的基因的插入方向有2种造成的。酶切所得片段是带有酶切位点的黏性末端,可以和双酶切获得的表达载体片段直接连接。
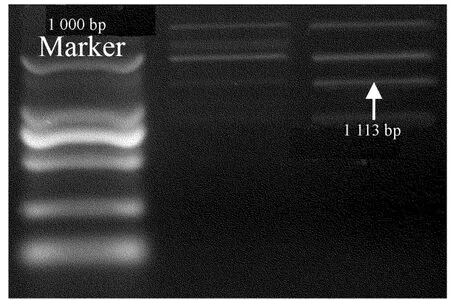
图3 重组T载体切下 AtMY B61基因
2.4 pCMBIA2301表达载体的酶切
2.4.1 pCMBIA2301载体的BstEⅡ完全酶切
用BstEⅡ将pCMBIA2301环状载体酶切成线状如图4所示,产物用1%琼脂糖凝胶电泳检测并纯化回收酶切产物。结果表明,pCMBIA2301载体被酶切成了单一的线状,大小为11 633 bp。
2.4.2 pCMBIA2301载体的BglⅡ部分酶切
BstEⅡ酶将pCMBIA2301载体切成线状切胶纯化回收后,回收产物用BglⅡ进行第2次酶切,由于pCMBIA2301载体上有2个BglⅡ酶切位点,因此必须用部分酶切来获得所需的载体片段。酶切时间和酶切体系须根据不同的酶和不同的酶切Buffer来调整,如图5所示。图 5中用10 000 bp做对照,a道表示酶切时间很短时还有一部分载体没被切开(11 633 bp),b、c和d道为最适酶切时间的酶切,可以很大限度地获得目的条带(9 579 bp)。

图4 pCMBIA2301载体BstEⅡ完全酶切
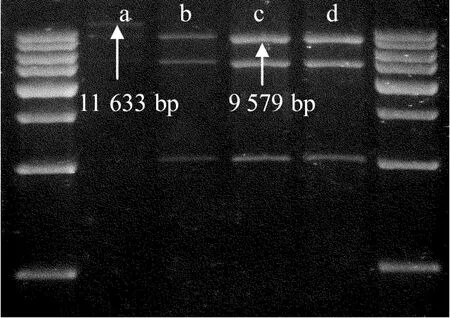
图5 线状pCMBIA2301的BglⅡ部分酶切
2.5 pCAMBIA2301-AtMYB61载体的构建
从AtMYB61-pUMc-T载体上切下的At-MYB61目的基因片段和在植物表达载体上切下的表达载体片段具有互补的黏性末端,如图6所示。

图6 pCAMBIA2301-AtM YB61载体的构建
按目的基因与载体的体积比约等于3∶1的比例用T4 DNA连接酶连接。纯化连接产物用电转化法将重组表达载体导入农杆菌感受态细胞中,经活化后涂布在含硫酸庆大霉素和卡那霉素的LB平板上,阳性菌落可在12~24 h后长出。
2.6 表达载体的菌落PCR与酶切鉴定
从转化平板上选取单菌落进行PCR验证,结果表明阳性克隆中含有 AtMY B61基因片段,如图7a所示。抽提已PCR验证菌液的质粒,并用BstEⅡ和BglⅡ双酶切鉴定,电泳检测,结果也表明阳性克隆中含有 AtMYB61基因片段,如图7b所示。从菌落PCR和酶切鉴定结果可知,载体构建成功,可以用于后期拟南芥植株的遗传转化。AtMYB61基因片段构建在CaMV 35S启动子后,可以在植物体中高效表达。

图7 重组表达载体菌落PCR和酶切鉴定
3 结束语
MYB转录因子广泛参与植物生长发育如细胞分化、器官的形成、植物形态建成的调控[11],以及次生代谢调控、激素合成和环境胁迫的应答[12],因此,MYB被认为是植物体内数量最多、功能最多样化的转录因子之一[13]。研究表明MYB61转录因子与重金属、低磷和干旱等胁迫的调节有关,但其 AtMYB61基因的抗逆分子机理有待进一步阐明。
本研究利用RT-PCR技术,以拟南芥中总RNA为模板成功克隆了AtMYB61基因。并且选用pCAMBIA2301载体,将 AtMY B61基因构建到CAMV35S启动子下游,使 AtMYB61基因大量表达,利用基因工程技术改良植物的抗逆性。总之,植物表达载体 pCAMBIA2301-AtMYB61的构建,不仅有利于改良植物抗逆性,而且有利于AtMYB61基因的抗逆分子机理的进一步研究。
[1]段红英,丁笑生.拟南芥 DREB2A基因的克隆及植物荧光表达载体的构建[J].华北农学报,2008,23(3):20-22.
[2]Riechmann J L,Ratcliffe O J.A genomic perspective on plant transcription factor[J].Current Opinions on Plant Biology,2000,3(5):423-434.
[3]Du H,Zhang L,Liu L,et al.Biochemical and molecular characterization of plant MYB transcription factor family[J].Biochemistry,2009,74(1):1-11.
[4]Vailleau F,Daniel X,Tronchet M,et al.A R2R3-MYB gene,AtMYB30,acts as a positive regulator of the hypersensitive cell death program in plants in response to pathogen attack[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(15):10179-10184.
[5]Abe H,U raoT,ItoT,etal.Arabuidopsis AtMY C2(bHLH)and AtMYB2(M YB)function as transcriptional activators in abscisic acid signaling[J].Plant Cell,2003,15(1):63-78.
[6]Nagaoka S,Takano T.Salt tolerance-related protein STO binds to a Myb transcription factor homologue and confers salt tolerance in Arabidopsis[J].Journal of Experimental Botony,2003,54(391):2231-2237.
[7]Vannini C,Locatelli F,Bracale M,et al.Overexpessin of the rice Osmyb4 gene increases chilling and freezing tolerance of A rabidopsis thaliana plants[J].Plant Journal,2004,37(1):115-127.
[8]Kazuhiro M,Soichi K,T aku D,et al.DcM YB1 acts as a transcriptional activator of the carrot phenylalanine ammonia-lyase gene(DcPAL1)in response to elicitor treatment,UV-Birradiation and the dilution effect[J].Plant M olecular Biology,2005,59(5):739-752.
[9]何佳平,张从合,陈金节,等.杂交油菜及其亲本对不同胁迫的响应[J].合肥工业大学学报:自然科学版,2010,33(8):1241-1244.
[10]Sambrook J,Russell D W.分子克隆实验指南[M].黄培堂,王嘉玺,朱厚础,等,译.第 3版.北京:科学出版社,2002:26-395.
[11]Newman L J,Perazza D E,Juda L,et al.Involvement of the R2R3-MYB,AtMYB61,in the ectopic lignifications and dark-photomorphogenic components of the det3 mutant phenotype[J].Plant Journal,2004,37(2):239-250.
[12]Higginson T,Li S F,Parish R W.AtMYB103 regulates tapetum and trichome development in Arabidopsis thaliana[J].Plant Journal,2003,35(2):177-192.
[13]杜 海,杨文杰,刘 蕾,等.大豆 MYB转录因子基因GmM YBJ6和GmM YBJ7的克隆及表达分析[J].作物学报,2008,34(7):1179-1187.
