化痰与活血基础方对非酒精性脂肪肝大鼠TNF-α、IL-6影响的实验研究
2011-01-23车念聪季巍巍法振鹏
袁 梦,车念聪,赵 晖,夏 蓉,季巍巍,法振鹏
(首都医科大学中医药学院,北京 100069)
非酒精性脂肪性肝病(non-alcohol fatty liver disease,NAFLD)是一种肝组织学改变与酒精性肝病(ALD)相类似但无过量饮酒史的临床病理综合征,由遗传-环境-代谢应激相关因素所致。其发病机制尚不明确,较为流行的是Day et al[1]提出的“二次打击”学说,初次打击主要为胰岛素抵抗(insulin resistance,IR)促使肝脏甘油三酯(triglyeride,TG)蓄积,导致肝细胞对内外源性损害因子的敏感性增强。而炎症因子产生,游离脂肪酸(free fatty acids,FFA)增多,肝细胞内 TG氧化增多,肝细胞能量储备不足,内毒素、铁蓄积等因素则通过诱发氧化应激导致脂质过氧化损伤,对肝脏进行第二次打击。除非能及时阻止炎症坏死循环,否则将进展为肝纤维化和肝硬化[2、3]。NAFLD在中医学中多以痰瘀互结作为基本病机[4],痰和瘀是其发病的关键要素。根据这一理论,本课题组选用化痰基础方二陈汤及活血基础方桃红四物汤对NAFLD模型大鼠进行治疗。前期的研究表明,上述两方在不同阶段对IR抵抗有一定程度的改善作用[5],而其具体作用机制尚不明确。为进一步探讨NAFLD发病机理,以及二陈汤和桃红四物汤的作用靶点,本实验定性及定量地对肝组织中肿瘤坏死因子-α(tumor necrosis factor,TNF-α)及白介素-6(interleukin6,IL-6)的表达进行观察和测定,为临床防治NAFLD提供客观依据。
1 材料及方法
1.1 材料
SD大鼠72只,SPF级,初始体质量180g±10g,北京维通利华实验动物科学技术有限公司;高脂饲料配方:10%猪油+2%胆固醇+0.5%胆酸钠+5%蛋黄粉+普通饲料至100g:北京科澳协力饲料加工有限公司;中药饮片为北京同仁堂药业股份有限公司;罗格列酮为葛兰素史克公司产品;二甲双胍为中美上海施贵宝公司;四氯化碳溶液为北京化学试剂公司;兔抗TNF-α、IL-6抗体为北京博奥森生物技术有限公司;兔超敏二步法免疫组化检测试剂为北京中杉金桥生物技术有限公司;大鼠TNF-a、IL-6酶联免疫检测试剂盒,ENDOGEN(美国)公司;紫外分光光度计:UV-1700,日本岛津;低温离心机:Biofuge15R,Heraeus sepatech德国;电子分析天平:JA-1003,上海精科天平厂;电动玻璃匀浆机:DY89-1,宁波新芝生物科技股份有限公司;恒温水浴锅为天津市中环实验电炉有限公司;涡旋混匀器:WH-861,北京科尔德科贸有限公司;Labofuge 400R低温离心机为德国 Heraeus;酶标仪:Multiskan MK3型,芬兰 Thermo BioAnalysis Company。
1.2 方剂制备及给药量
二陈汤和桃红四物汤剂量参考上海科学技术出版社1998年第6版《方剂学》。二陈汤:橘红15 g,半夏15 g,茯苓9 g,甘草5 g;桃红四物汤:川芎6 g,赤芍 6g,当归 9g,红花 9g,熟地 9g,桃仁 12g。各方按处方比例购置药材,传统方法煎煮中药。蒸馏水溶解罗格列酮片剂及二甲双胍片剂,制备罗格列酮0.30mg/ml、二甲双胍30mg/ml溶液。西药对照组按罗格列酮1.5mg/kg·d联合二甲双胍150mg/kg·d的给药量,治疗组按二陈汤7.5g/(kg·d)、桃红四物汤8.5g/(kg·d)的量给动物灌服(相当于人体正常用量的10倍),正常组和模型组以1ml/100g体重的标准灌服蒸馏水,每天1次至实验结束。
1.3 动物模型复制
同批次健康成年雄性SD大鼠72只,SPF级,初始体重180g±10g,适应性喂养5d后,按体重区组分层随机分为空白对照组12只,模型组、西药对照组、二陈汤组、桃红四物汤组各15只。参考文献[6]进行模型复制:模型组和3个药物组以高脂饲料饲养,从第5周起按0.2 mL/100g体重的标准给予40%四氯化碳豆油溶液,从大鼠背部后侧皮下注射每周2次,共3周。空白对照组始终喂以普通饲料。饲养期间,模型组死亡2只大鼠。从造模开始,二陈汤组和桃红四物汤组即分别灌服二陈汤、桃红四物汤,西药对照组灌服罗格列酮与二甲双胍混合溶液,模型组和空白对照组灌服蒸馏水。
1.4 动物采样及样本处理
第8周末动物饲养结束,大鼠断头采血处死,迅速取出肝脏,观察肝脏颜色质地特征,取1cm×3cm肝组织以10%甲醛固定,脱水、石蜡包埋固定、切片、HE染色,光镜下观察肝脏病理学改变,剩余肝组织-80℃冻存。
1.5 病理切片处理
1.5.1 免疫组织化学染色 石蜡切片常规脱蜡、复水,TNF-α采用微波修复法,IL-6采用胰酶修复法进行抗原修复,3%过氧化氢溶液浸染切片10min阻断生物酶,PBS缓冲液清洗后入一抗(1∶100稀释),4℃冰箱过夜。取出后室温复温后加入聚合物辅助剂(试剂1)37℃孵育30min,PBS冲洗,入辣根酶标记抗兔IgG多聚体 37℃孵育60min,1∶20 DAB显色剂显色5min,苏木素复染细胞核,常规脱水固定,中性树胶封片。
1.5.2 图像处理 TNF-α及IL-6阳性细胞均为胞浆或胞核呈棕黄色或深棕黄色颗粒,在NIKON Eclipse 80i生物显微镜下以高倍镜(×40)观察,选取染色均匀的3-5个视野的阳性表达细胞,应用NIS-Elements Basic Research图像采集分析系统统计每个视野下阳性颗粒的表达面积(Area)和积分光密度(SumDensity),以反映 TNF-α和 IL-6在肝组织中的分布强度。
1.6 酶联反应法测定TNF-α、IL-6含量
肝组织称重后在冰浴(4℃)中制成10%的组织匀浆,4000r/min离心10min取上清,生理盐水稀释成5%的组织匀浆用于检测,严格按照说明书建立标准曲线进行样本测定和结果计算。
1.7 统计方法
数据利用SPSS16.0统计软件进行单因素方差分析,并进行LSD组间比较,计量资料用均数±标准差表示,以P<0.05为差异有统计学意义。
2 结果
2.1 二陈汤、桃红四物汤对大鼠肝组织病理改变的影响
图1~5显示,40倍光镜下观察肝组织HE染色切片,正常组大鼠肝小叶结构正常,肝细胞索排列整齐,以中央静脉为中心呈放射状排列,肝细胞无变性、坏死,可及肝窦充血。模型组大鼠肝小叶结构紊乱,肝细胞呈脂肪变性显著,视野满布中到小泡性脂肪变性,可及大泡脂肪空泡,呈局灶分布伴空泡融合,病变以中央静脉周围严重,脂肪变性肝细胞肿胀,胞核被脂肪空泡推挤发生偏移、变形,细胞核深染,可见到肝窦充血、炎细胞浸润,各组药物影响肝细胞脂质沉积、脂肪变性的侧重不同。桃红四物汤使肝脏脂质沉积更局限于中央静脉周围,同时可以减少肝细胞脂肪变性的面积;二陈汤可降低肝细胞脂肪变性的密度及脂肪空泡的体积,西药也可降低脂肪变性的密度。
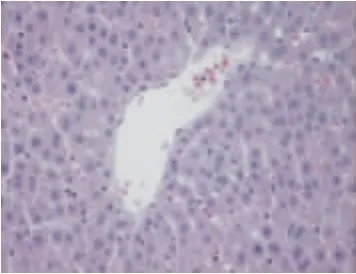
图1 正常组大鼠肝组织(HE×40)

图2 模型组大鼠肝组织(HE×40)
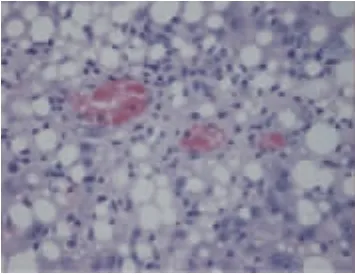
图3 西药组大鼠肝组织(HE×40)
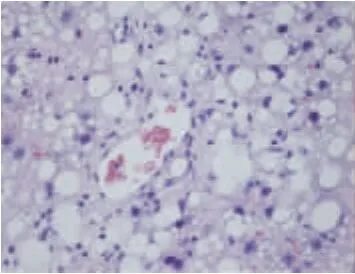
图4 二陈汤组大鼠肝组织(HE×40)
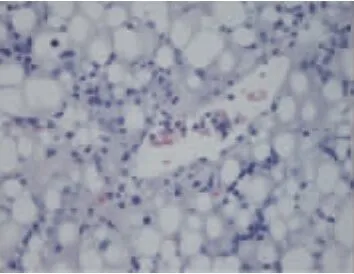
图5 桃红四物汤组大鼠肝组织(HE×40)
2.2 二陈汤、桃红四物汤对大鼠肝组织TNF-α、IL-6表达的影响
2.2.1 二陈汤、桃红四物汤对大鼠肝组织TNF-α表达的影响 图6表1显示,正常肝组织内TNF-α阳性表达极少,仅在汇管区周围偶见单个阳性表达细胞;模型组大鼠肝组织内TNF-α明显增多(P<0.01),肝细胞肿胀变形,阳性表达细胞在汇管区及大血管周围分布明显增多;二陈汤组、桃红四物汤组大鼠阳性表达细胞数量与模型组比较显著减少(P<0.01),对照组与模型组相比无统计学差异。
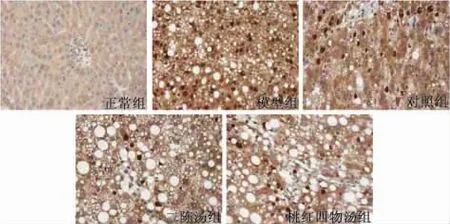
图6 不同组大鼠肝组织TNF-α表达的比较(SF二步法×40)
表1 不同组大鼠肝组织TNF-α表达的比较
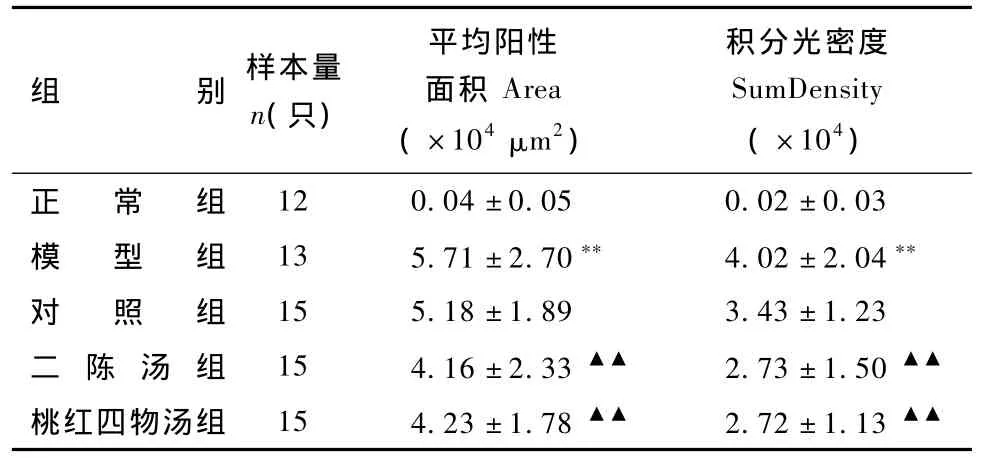
表1 不同组大鼠肝组织TNF-α表达的比较
注:与正常组比较:**P<0.01;与模型组比较:▲▲P<0.01
组别 样本量n(只)平均阳性面积Area(×104μm2)积分光密度SumDensity(×104)正 常 组12 0.04±0.05 0.02±0.03模 型 组 13 5.71 ±2.70** 4.02±2.04**对 照 组 15 5.18±1.89 3.43±1.23二 陈 汤 组 15 4.16±2.33▲▲ 2.73±1.50▲▲桃红四物汤组 15 4.23±1.78▲▲ 2.72±1.13▲▲
2.2.2 二陈汤、桃红四物汤对大鼠肝组织IL-6表达的影响 图7表2显示,正常肝组织内IL-6阳性表达极少,仅在汇管区周围偶见单个阳性表达细胞;模型组大鼠肝组织内IL-6阳性表达区域明显增多(P<0.01),肝细胞肿胀变形,阳性表达细胞在汇管区及大血管周围分布明显增多;对照组、二陈汤组、桃红四物汤组大鼠肝组织阳性表达细胞数量与模型组相比较明显减少(P<0.01)。
2.3 二陈汤、桃红四物汤对大鼠肝组织 TNF-α、IL-6含量的影响
表3显示,与正常组比较,模型组大鼠肝组织TNF-α、IL-6含量明显升高(P<0.05);与模型组相比,二陈汤组大鼠肝组织 IL-6含量明显下降(P<0.05),TNF-α含量无明显下降;桃红四物汤组大鼠肝组织TNF-α、IL-6含量无明显下降;西药对照组大鼠肝组织TNF-α含量明显下降(P<0.05),IL-6含量无明显下降。
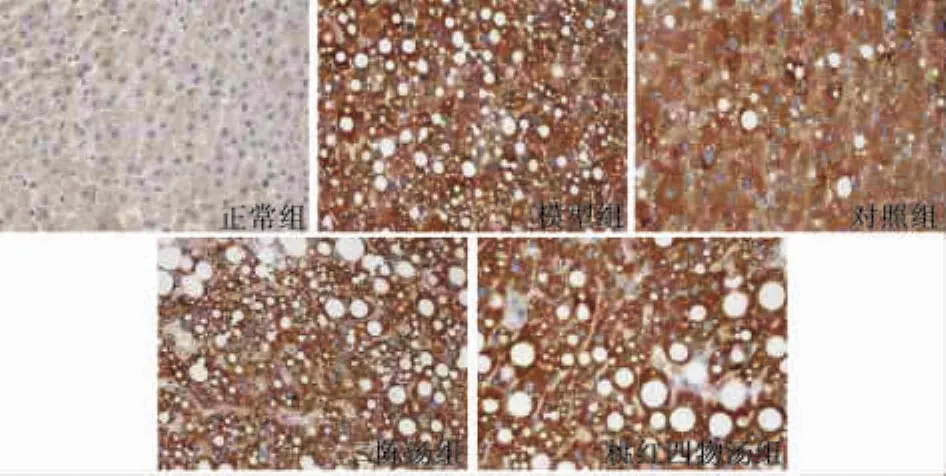
图7 不同组大鼠肝组织IL-6表达的比较(SF二步法×40)
表2 不同组大鼠肝组织IL-6表达的比较
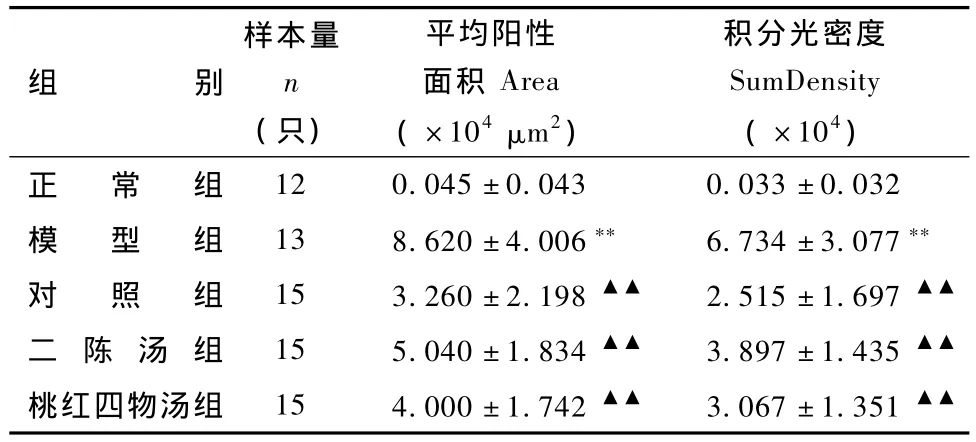
表2 不同组大鼠肝组织IL-6表达的比较
注:与正常组比较:**P<0.01;与模型组比较:▲▲P<0.01
组别样本量n(只)平均阳性面积Area(×104μm2)积分光密度SumDensity(×104)正 常 组12 0.045±0.043 0.033±0.032模 型 组 13 8.620 ±4.006** 6.734 ±3.077**对 照 组 15 3.260±2.198▲▲ 2.515±1.697▲▲二 陈 汤 组 15 5.040±1.834▲▲ 3.897±1.435▲▲桃红四物汤组 15 4.000±1.742▲▲ 3.067±1.351▲▲
表3 不同组大鼠肝组织TNF–α、IL-6含量的比较
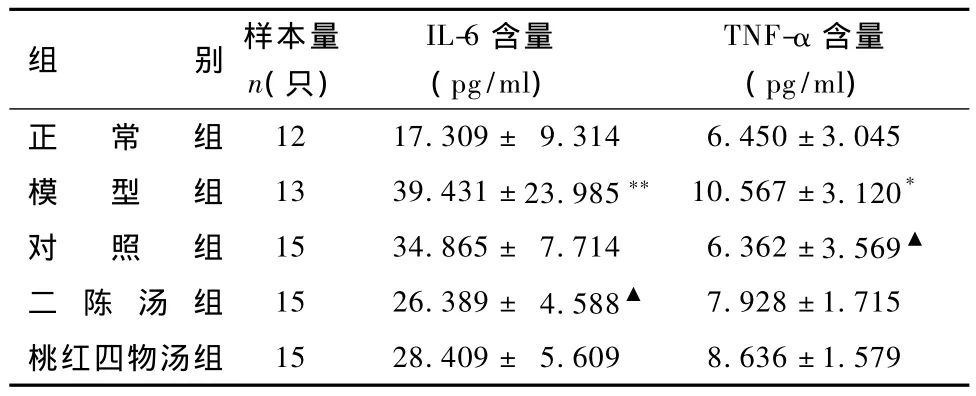
表3 不同组大鼠肝组织TNF–α、IL-6含量的比较
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05
组别 样本量n(只)IL-6含量(pg/ml)TNF-α 含量(pg/ml)正 常 组12 17.309± 9.314 6.450±3.045模 型 组 13 39.431±23.985** 10.567±3.120*对 照 组 15 34.865± 7.714 6.362±3.569▲二 陈 汤 组 15 26.389±4.588▲ 7.928±1.715桃红四物汤组15 28.409± 5.609 8.636±1.579
3 讨论
3.1 TNF-α、IL-6与 NAFLD 的关系
研究证实,IR是NAFLD的基本特征,其可以直接或间接促进肝脂肪变性、肝细胞损伤、炎症和纤维化的发生。TNF-α、IL-6是已知的细胞因子中与NAFLD的发生发展关系最为密切的介质之一。临床研究发现,患者血清 TNF-α、IL-6水平与胰岛素抵抗指数(H0MA-IR)均呈显著性正相关,与是否合并代谢综合征呈显著性相关[7],证明 TNF-α、IL-6通过诱导IR对NAFLD疾病本身的发生与发展起重要作用。TNF-α是肿瘤坏死因子家族中的重要一员,其通过肝细胞上TNF-α受体影响肝细胞脂肪代谢,降低胰岛素受体络氨酸激酶的活性,从而加重IR并与NAFLD的发生密切相关[8]。TNF-α既能直接损伤肝细胞,与肝细胞膜上的受体结合,诱导肝细胞死亡,又能增加肝内活性氧(ROS)产生,通过诱发炎症介质激活中性粒细胞等产生间接作用,加重肝细胞炎症、损伤。致炎因子IL-6是多种细胞如单核吞噬细胞、血管内皮细胞、成纤维细胞和激活的 T淋巴细胞等对IL-1和TNF-α反应的产物,IL-6主要作用于肝细胞和B淋巴细胞,刺激肝细胞合成纤维蛋白原等几种血清蛋白,是活化的B淋巴细胞分化晚期的主要刺激因子。有研究显示,胰岛素依赖的AKT 的激活,明显被 IL-6 抑制[9]。
本实验发现,四氯化碳联合高脂饲料复制的NASH大鼠肝组织发生明显的脂肪样变性及炎症反应,肝细胞排列紊乱,肝细胞肿胀变形,胞浆内可见脂肪大泡,胞核固缩、偏移,中心静脉区及汇管区有明显的炎性细胞浸润,肝组织内 TNF-α、IL-6表达和含量明显增多,与文献报道相一致,证明二者参与NAFLD的形成与发展,其具体机制可能与IR的形成、炎症反应及肝细胞损伤有关。
3.2 二陈汤与桃红四物汤对NAFLD的影响
前期实验发现,二陈汤与桃红四物汤能够改善NAFLD大鼠的 IR 状态,降低 ALT、AST、TBA、TBIL等指标。通过上述方药对NAFLD大鼠治疗作用的进一步研究发现,二陈汤与桃红四物汤能够抑制肝组织内过度表达的 TNF-α、IL-6,从而干预IR的形成,调整糖脂代谢紊乱,影响“第一次打击”过程,同时又能减轻肝组织氧化应激反应,起到保护肝细胞功能和改善肝损伤的作用,对“第二次打击”进行干预。两方比较,二陈汤的作用效果优于桃红四物汤。
二陈汤首见于《太平惠民和剂局方》,治“痰饮为患,或呕吐恶心,或头眩心悸,或中脘不快,或发为寒热,或因食生冷,脾胃不和”。其组成为半夏、橘红、茯苓、炙甘草4药共奏燥湿化痰、健脾渗湿、行气祛痰之效。后世医家多以本方为治疗痰饮的主方,对痰饮引起的诸多病证常以本方为基础化裁运用。桃红四物汤由四物汤加桃仁红花组成,为治疗血行瘀滞之良方。方中桃仁、红花通利脉道,消血中瘀滞,熟地长于滋阴养血,川芎为“血中气药”,能行气而活血;当归补血活血,赤芍活血祛瘀,甘草调和诸药,全方合为养血活血化瘀之方,王清任之血府逐瘀汤、膈下逐瘀汤等皆由桃红四物汤化裁而来。选用上述化痰与活血之基础方,意在以方测法,探讨化痰法与活血法对NAFLD大鼠的作用效果与作用靶点,进一步以法测证,揭示NAFLD的病机关键。根据实验结果得知,化痰之基础方二陈汤作用较桃红四物汤更为确切,以此推断以肝组织炎症表现为特征的NASH阶段,中医辨证应为痰瘀互结,以痰为主。
3.3 化痰法治疗NAFLD有其阶段性
根据NAFLD痰瘀互结的理论,临床上应以化痰祛瘀为法选方用药。而中医的治疗优势在于辨证论治,即同病异治,针对脂肪肝发展的不同阶段调整治法用药,因此化痰祛瘀法的应用也应有其侧重。学习文献和运用现有中医理论分析,NASH阶段的患者表现为痰湿内停、湿热蕴结,此时用药应以祛湿化痰为主。本实验也证实,处在NASH阶段大鼠对化痰基础方二陈汤的治疗更加敏感,反证了该阶段的病理基础以痰饮为主,为NAFLD中期治疗应以祛湿化痰为主提供了理论依据。NASH得不到控制,病情就会向肝纤维化发展,患者表现也多以口黏、纳差乏力、脘腹痞满、肝区胀闷疼痛、肝脾肿大变硬、舌质瘀暗或见瘀点瘀斑、舌下脉络瘀滞、脉细涩等瘀血内停证为主,此时治疗应施以化痰散结活血通络之法。正所谓“痰为瘀之渐,瘀为痰之变”,这也解释了为何本实验观察发现活血基础方桃红四物汤对细胞因子的调节作用不如二陈汤的机理。若探究化痰法与活血法应用的具体时间点,还需进一步的实验探讨。
[1]Day CP,James OF.Steatohepatitis:a tale of two“hits”[J].Gastroenterology,1998,114:842-845.
[2]范建高.非酒精性脂肪肝的病因和发病机制[J].胃肠病杂志,2003,8:363-365.
[3]曾民德.脂肪肝发病机制及其“二次打击”假设[J].中华消化杂志,2002,22:167-168.
[4]黄静娟,刘树军,车念聪.论痰瘀理论对非酒精性脂肪肝辨证与治疗的指导作用[J].中华中医药杂志,2006,21(12):765-767.
[5]胡志阗.二陈汤和桃红四物汤对非酒精性脂肪性肝病胰岛素抵抗影响的动态实验研究[J].北京中医药,2009,28(4):305-307.
[6]刘树军,黄静娟,车念聪.活血化痰基础方对大鼠非酒精性脂肪肝模型 CYP2E1活性的影响[J].中西医结合肝病杂志,2008,18(2):109-111.
[7]谢伶俐,周力,李丽滨,等.TNF-α和I L-6在非酒精性脂肪性肝病患者血清中的水平及意义[J].世界华人消化杂志2010,18(14):1492-1496.
[8]Hotamisligil GS, ShargillNS, Spiegelm an BM .Adipose expression of tumor necrosis factor-alpha:direct role in obesitylinked insulin resistance[J].Science 1993;259:87-91.
[9]Senn JJ,Klover PJ,Nowak IA et al.Interleukin-6 induces cellular insulin resistance in hepatocytes[J].Diabetes,2002,51:3391-3399.
