抗纤益心方对扩张型心肌病大鼠心肌基质金属蛋白酶-3及其抑制剂-3表达的影响*
2011-01-23王振涛韩丽华杨凤鸣
王振涛,韩丽华,杨凤鸣,惠 玲
(1.河南省中医院,河南 郑州 450011;2.南阳市中医院,河南 南阳 473007)
扩张型心肌病的心室重构是该病发展的重要病理环节。心肌细胞和细胞外基质(Extracellular matrixc,ECM)的变化是心室重构的结构基础。心肌细胞外基质时刻处于一个动态的合成-降解过程中,一旦动态平衡被打破,胶原网络发生重建,必将导致心室重构[1]。其中基质金属蛋白酶(matrixmetallo-Proteinases,MMP)与基质金属蛋白酶组织抑制因子(tissueinhibitorsofmetal-loproteinase,TIMP)的调节对心肌细胞外基质起重要的作用[2]。本研究观察抗纤益心方对扩张型心肌病大鼠心肌ECM的影响,并通过观察扩张型心肌病大鼠心肌基质金属蛋白酶-3(Matrix metalloproteinase-3,MMP-3)及其抑制因子-3(Tissueinhibitorsof metalloproteinase-3,TIMP-3)表达水平的变化并探讨其机制。
1 材料与方法
1.1 材料
1.1.1 用药
抗纤益心方干浸膏由党参、黄芪、云苓、白术、丹参、川芎、红花、赤芍、泽兰、益母草组成,由河南省中医院制剂室提供,每克干浸膏相当于生药4g;呋喃唑酮片由福建省三明天泰制药有限公司生产,批号20050204;卡托普利片由常州制药厂生产,批号200502242;戊巴比妥钠为中国医药(集团)上海化学试剂公司生产,批号F20021216。
1.1.2 试剂
MMP-3多克隆抗体购自北京博奥森生物技术有限公司,bs-0413R;TIMP-3多克隆抗体购自北京博奥森生物技术有限公司,bs-0417R;兔两步法二抗:北京中杉金桥生物技术有限公司,PV-6001;DAB显色试剂盒:北京中杉金桥生物技术有限公司,ZLI-9032。
1.1.3 器材 JY-1001型精密电子天平(上海民桥电子仪器厂);石蜡切片机(德国莱卡公司,型号SM-2000R);光学显微镜(日本 OLYMPUS公司);摄影显微镜(德国莱卡公司);Image-Pro Plus 6.0(IPP)图像处理分析系统(美国Media Cybernetics公司)。
1.2 动物造模及分组
选取体重为 61.9g±7.0g的 Wistar雄性大鼠(郑州大学动物中心提供,合格证号510116。把动物按5∶1随机分为模型组和正常对照组。参照文献方法[3],模型组在饮水中加呋喃唑酮(按1kg水加700mg呋喃唑酮配置)喂养8周。正常组动物常规饲养,不进行药物干预。
1.3 治疗方法
造模8周后开始药物干预,每天1次给药。模型组动物每日管饲与治疗组同等容积的生理盐水;抗纤益心方小剂量组(中药小剂量组)动物每日管饲抗纤益心方4.7g/(kg·d);抗纤益心方大剂量组(中药大剂量组)动物每日管饲抗纤益心方18.8g/(kg·d);卡托普利对照组动物每日管饲卡托普利10.125mg/(kg·d);卡托普利与抗纤益心方大剂量合用组(中西药联用组)动物同时管饲卡托普利及抗纤益心方大剂量。灌药同时所有扩张型心肌病造模大鼠同时继续饮用呋喃唑酮水溶液。药物干预8周后处死动物。正常组动物每日管饲与治疗组同等容积的生理盐水。
1.4 心肌取材
药物干预8周后麻醉动物,迅速打开胸腔取出心脏,滤纸吸干水分,剪去左、右心房及右心室,然后从心尖处沿冠状面切取左心室心肌组织,放入10%中性缓冲福尔马林液中固定,石蜡包埋,制备厚4μm组织切片。
1.5 免疫组化染色方法
MMP-3、TIMP-3阳性表达检测均采用免疫组化法。二甲苯脱蜡(Ⅰ、Ⅱ、Ⅲ)各15min,降浓度梯度100%乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇脱二甲苯各5min,水洗2min,蒸馏水冲洗2min×3次,PBS漂洗2min×3次,微波抗原修复,高火加热至枸橼酸缓冲液沸腾后改低火加热15min,自然冷却后PBS漂洗2min×3次,滴加50ul 3%H2O2,孵育10min,灭活组织内源性抗原,PBS漂洗2min×3次,滴加50ul MMP-3或TIMP-3抗体(1∶100稀释),4℃过夜,次日湿盒恢复至室温,PBS漂洗2min×3次,滴加 50ul二抗 PV-6001,37℃ 孵育30min,PBS 漂洗2min×3次,DAB显色8min,自来水冲洗终止反应,乙醇升梯度70%、80%、90%、95%、100%,脱水各 5min,二甲苯(Ⅰ、Ⅱ、Ⅲ)透明各 15min,中性树胶封片。
1.6 指标检测方法
MMP-3、TIMP-3平均光密度值(OD)的测定:光镜下,每只大鼠观察6张切片,每张切片在图像分析系统上随机选取相等的5个高倍视野(×400)测定OD值,每张片子测量后取平均值。
1.7 统计学方法
2 结果
图1、2显示,光镜下各组 MMP-3和 TIMP-3的阳性染色呈棕黄色或棕褐色,阳性区域主要分布于心肌间质。

图1 左室心肌组织MMP-3免疫组化染色照片(×400)
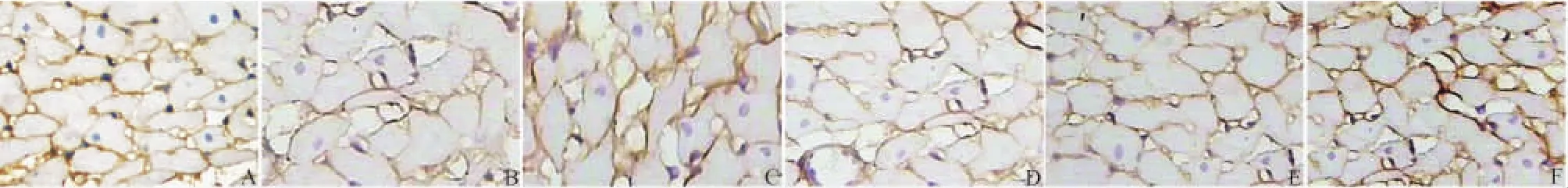
图2 左室心肌组织TIMP-3免疫组化染色照片(×400)
2.1 各组MMP-3比较
与模型组比较,中药大剂量组、中药小剂量组、卡托普利组、中西药联用组 MMP-3阳性表达减少(P<0.05),其中以中西药联用组作用最强。
2.2 各组TIMP-3比较
与模型组比较,中药大剂量组、中药小剂量组、卡托普利组、中西药联用组TIMP-3阳性表达增加(P<0.05),其中仍以中西药联用组作用最强。
3 讨论
心室重构是扩张型心肌病发生、发展的基本病理环节,而ECM重构(间质成纤维细胞的增生及其合成的心肌胶原含量的增加)是心室重构的重要组成部分。心肌细胞间质时刻处于一个动态的合成-降解过程中,一旦动态平衡被打破,胶原网络发生重建,必将导致心室重构[1]。
MMPS的异常参与了许多心血管疾病的发病过程,MMPS的表达和活性过度增强或 MMPS/TIMPS比例失调导致正常的心肌胶原蛋白过度降解,并被缺乏连接结构的纤维性间质取代,使心肌胶原重构,引起心腔扩大、室壁变薄导致心功能恶化[4]。MMP-3是MMPS中的1种,除了能降解胶原,还能降解基底膜成分,广泛存在于多种组织和细胞中,其独特的功能是能够激活其他种类的 MMPS[5],从而启动胶原增殖反应。TIMP-3是TIMPs家族中的重要成员,具有与其他TIMPs成员不同的特性,它只存在于细胞外基质中,是一种结合于细胞外基质的非可溶性蛋白[6]。DCM心肌中存在 MMP/TIMP的平衡及活性受到破坏,必然导致基质胶原代谢紊乱,心肌细胞外胶原积聚,最终导致心脏重构[7]。
表各组MMP-3、TIMP-3 OD值结果比较

表各组MMP-3、TIMP-3 OD值结果比较
注:与正常组比较:*P<0.05;与模型组比较:△P<0.05
别 n MMP-3 OD值 TIMP-3 OD 值 常 组 6 0.1670±0.0107△ 0.9052±0.068 型 组 6 0.2480±0.0116* 0.5183±0.036组正6△模9*卡托普利组 6 0.1812±0.0106△ 0.7540±0.0409*△中药大剂量组 5 0.1758±0.0075*△ 0.7482±0.0386*△中药小剂量组 6 0.2067±0.0100*△ 0.6137±0.0624*△中西药联用组 6 0.1751±0.0122△ 0.8581±0.0537△
本研究测定实验性扩张型心肌病大鼠MMP-3及TIMP-3阳性表达发现,抗纤益心方大剂量有同对照西药卡托普利相同的降低MMP-3和升高TIMP-3的作用,且抗纤益心方大剂量与卡托普利合用组作用更明显,表明两药合用可能对抑制心肌纤维化有协同作用。而小剂量抗纤益心方对扩张型心肌病大鼠MMP-3和TIMP-3的作用与大剂量抗纤益心方的作用比较也有差异,表明抗纤益心方抑制扩张型心肌病大鼠心肌纤维化的作用随其剂量的增加而增强。
[1]Spinale FG,Coker ML,Bond BR,et al.Myocardial matrix degradation and metaloproteinase activation in the failing heart:a potential therapeutic target[J].Cardiovasc Res,2000,46(2):225-238.
[2]王丽萍,杨方.基质金属蛋白酶及其抑制因子与心肌纤维化[J].中国动脉硬化杂志,2005,4(13):517-519.
[3]黄荣杰,刘唐威,伍伟锋,等.呋喃唑酮制备大鼠扩张型心肌病模型[J].中国病理生理杂志,2003,23(10):2147-2150.
[4]覃远汉,刘唐威,伍伟锋,等.MMP-3、TIMP-1在病毒性心肌炎中的表达及其与心肌胶原的关系[J].广西医科大学学报,2005,22(2):182-185.
[5]Thomas CV,Coker ML,Zellner JL,et al.Increased matrix metalloproteinase activity and selective up regulation in LV myocardium from patients with end-stage dilated car diomyopathy[J].Circulation,1998,97(17):1708-1715.
[6]吕国丽,文剑明.金属蛋白酶组织抑制因子-3的结构、表达调控和生物学功能[J].国外医学·生理、病理科学与临床分册,2003,2(1):53-56.
[7]WoodiwissAJ,TsotetsiOJ,SprottS,etal.Reduction in myocardial collagen crosslinking parallels left ventricular dilation in rat models of systolic chamber dysfunction[J].Circulation,2001,103:155-160.
