小鼠NMNAT1基因的过表达和RNAi重组慢病毒的构建包装和检测
2011-01-23杨子超张惊宇
赵 虹,杨子超,张惊宇
小鼠NMNAT1基因的过表达和RNAi重组慢病毒的构建包装和检测
赵 虹,杨子超,张惊宇
(哈尔滨医科大学附属第四医院神经内科,黑龙江哈尔滨150001)
目的:针对小鼠烟酰胺单核苷酸腺苷酰转移酶1(NMNAT1)基因构建质粒并进行慢病毒包装,同时检测其表达水平和干扰效率,为进一步探讨该基因的功能提供研究工具和实验基础。方法:根据NMNAT1基因信息,用慢病毒载体pLenti6构建三种重组质粒,分别包含NMNAT1 cDNA全长、一个针对NMNAT1的小干扰序列和一个用于干扰对照的阴性序列。把这些质粒包装进慢病毒载体,并检测病毒滴度,再用慢病毒感染Hela细胞检测NMNAT1表达量和RNA干扰效率。结果:测序结果证明目的序列正确地插入到载体内。通过qPCR方法鉴定慢病毒包装成功,病毒滴度均为2×108TU/ml以上。表达NMNAT1的重组慢病毒感染Hela细胞,该细胞能够高水平表达NMNAT1蛋白,而携带RNAi序列的慢病毒能够显著抑制其表达,干扰效率在70%以上。结论:针对NMNAT1的过表达和RNAi重组慢病毒制备成功,为进一步研究NMNAT1基因的功能和用慢病毒进行基因治疗提供了良好的研究工具。
慢病毒属;重组,遗传;质粒;遗传载体;烟酰胺单核苷酸腺苷酰转移酶1;RNA干扰;基因过表达
[JZhejiang Univ(Medical Sci),2011,40(6):622-629.]
烟酰胺单核苷酸腺苷酰转移酶NMNAT蛋白(nicotinamide mononucleotide adenylyl transferase)是一类功能尚不完全明确的酶类。该类蛋白质在中枢神经系统和外周神经系统中大量表达,近年发现与神经系统退行性疾病相关[1-3]。NMNAT1蛋白能够感受外界压力如过度的活性刺激和损伤刺激,保护神经元的完整性,显示出神经保护作用[4-5]。但迄今为止,有关NMNAT1功能研究特别是在神经发育中的研究报道还很少见。而且利用慢病毒载体表达NMNAT1基因和对其进行RNA干扰尚未见报道。本研究首次利用自主设计的RNAi序列,构建并包装了针对NMNAT1的过表达和RNA干扰(RNA interference,RNAi)重组慢病毒载体。本研究建立了有效的NMNAT1研究工具,便于利用慢病毒探讨NMNAT1的在神经发育中的功能和利用NMNAT1进行基因治疗。
1 材料和方法
1.1 材料 Hela细胞为本实验室保存。人胚肾293T细胞购自中国科学院细胞库。慢病毒质粒pLenti6购自Invitrogen公司;质粒抽提试剂盒购自 Qiagen公司;转染试剂 LipofectamineTM2000购自Invitrogen公司;慢病毒包装混合质粒 pLP1、pLP2和包膜质粒 pLP/VSVG购自Invitrogen公司。小干扰序列和引物由上海生工公司合成。低分子量蛋白Marker、蛋白质提取试剂盒等购自赛百盛。检测用抗体NMNAT1抗体和GAPDH抗体购自CST公司,辣根过氧化物酶标记羊抗鼠多抗购自中杉公司。
1.2 方法
1.2.1 针对小鼠 NMNAT1的过表达和 RNAi慢病毒载体的构建 根据NMNAT1(NM_022787)的基因信息,从本实验室已经构建的pcDNA3.1-NMNAT1质粒中,用双酶切法把NMNAT1的cDNA片段转接入pLenti6载体,即得到可表达NMNAT1的质粒。在RNA干扰实验中,根据NMNAT1的mRNA序列设计一条RNAi序列和一条阴性(scramble)对照序列,并均通过BLAST验证。RNAi序列信息如下①scramble:TTCTCCGAACGTGTCACGT;②siRNA:ACGAGTGGATCACCAATGA。根据上述两条序列设计四条互补的单链DNA,设计好的序列送上海生工公司合成。
将合成好的单链DNA进行稀释和退火,对空载体pLenti6用HpaⅠ和XhoⅠ进行双酶切;将退火后稀释产物和回收好的双酶切载体进行连接反应;再将连接产物经过PCR鉴定后送上海生工公司测序,确定序列正确后,使用Qiagen质粒抽提试剂盒抽提得到不含内毒素的质粒,然后将其包装进慢病毒载体。
1.2.2 慢病毒的包装 参照Invitrogen公司的操作手册进行慢病毒的包装。培养293T细胞株作为包装细胞,在脂质体介导下将2μg pLenti6重组质粒与10μg慢病毒包装质粒混合物转染293T细胞。转染36 h和48 h后收集上清液,将含有慢病毒颗粒的上清离心,并用孔径为0.45μm的PVDF滤膜过滤。过滤后的溶液用超速离心的方法进行浓缩,将待测的各病毒储藏液按梯度稀释分组后转染293T细胞,结合qPCR测定病毒滴度。
1.2.3 慢病毒载体的有效性验证 培养Hela细胞至汇合度为90% ~95%时,进行慢病毒感染实验。分为4组:A组为空白对照组;B组为过表达慢病毒感染组;C组为过表达慢病毒感染后再感染阴性对照慢病毒组;D组为过表达慢病毒感染后再感染干扰慢病毒组。慢病毒感染细胞后培养96 h收集细胞的RNA和总蛋白,采用qPCR和Western Blot分别检测mRNA和蛋白质表达量。
1.2.4 RNA提取和 qPCR 按 Invitrogen公司的RNA-Trizol试剂盒操作指南提取 RNA。qPCR检测过程如下所述:取抽提的RNA 1μg,Oligo d(T)16.5 μg,加 DEPC 处理水至 15 μl,65℃变性5 min,迅速置冰上冷却。PCR反应体系如下:10× PCR 缓冲液2.5μl,MgCl2溶液3 μl,dNTP 混 合 液 3 μl,Taq 聚 合 酶 3 U,SyberGreen终浓度0.25×,20μmol/L的引物0.5 μl,cDNA 或 DNA 1 μl,加水至总体积为25 μl。反应条件如下:94℃,4 min;35个 PCR循环:94℃,10 s;57℃,15 s;72℃,20 s;86.5℃,5 s;为了建立PCR产物的熔解曲线,扩增反应结束后继续从72℃缓慢加热到99℃,每5 s升高1℃后绘制标准曲线。反应终产物仍然可以通过凝胶电泳的方法检测PCR扩增产物的条带大小和丰度。qPCR所用引物序列:
NMNAT1:forward,5'-CGCGGTGCAAATA GCTTAC-3',
NMNAT1:reverse,5'-TATCTTTCGCCCCT TCCTG-3',
actin:forward,5'-CCCCAATGTATCCGTTG TG-3',
actin:reverse,5'-CTCAGTGTAGCCCAGG ATGC-3'。
1.2.5 蛋白免疫印迹法(Western Blot) 细胞经病毒感染后吸去培养基,用PBS洗一遍,然后将1×的SDS凝胶样品缓冲液(50 mmol/L Tris-HCl pH 6.8,100 mmol/L 巯基乙醇,2%SDS,0.1%溴酚兰,10%甘油)加入细胞培养皿中,冰上裂解5 min,收集样品放于1.5 ml离心管中,100℃变性10 min,用SDS-PAGE凝胶进行蛋白电泳再经转膜、封闭、抗体孵育,接着用ECL(enhanced chemicoilluminenscenecs)底物在暗室中曝光胶片,最后扫描胶片保存得到数据。扫描照片用软件Image-Quant 5.0进行分析,以光密度值表示各组的蛋白相对表达量,其中空白细胞组的光密度值作为对照,其它实验组与其进行校正。
1.3 统计学分析 本研究采用SPSS 11.5软件先进行单因素方差分析,当结果有差异时再用LSD法进行两两比较分析。P<0.05被认为差异具有显著意义。
2 结果
2.1 慢病毒质粒载体的鉴定结果 连接转化后的阳性菌落提取质粒DNA,采用相应的鉴定引物进行PCR扩增,过表达和RNAi的片段分别为981 bp和342 bp,电泳条带显示慢病毒载体构建成功(图1)。pLenti6-NMNAT1、pLenti6-NMNAT1-shRNA和pLenti6-NMNAT1-Scr-shRNA三种慢病毒质粒载体测序结果表明,重组慢病毒质粒载体的插入序列与设计序列一致,没有碱基缺失或替换等,同样证明慢病毒质粒构建成功。
2.2 慢病毒的生产和鉴定结果 pLenti6载体中带有 GFP标记基因,重组慢病毒质粒pLenti6-NMNAT1、pLenti6-NMNAT1-shRNA 和pLenti6-NMNAT1-Scr-shRNA分别与慢病毒包装质粒混合物共转染293T细胞24 h后绿色荧光强度高,细胞生长良好,表明病毒包装成功。病毒液过滤和超速离心机浓缩后测定病毒滴度为2×108TU/ml,这一滴度符合后续感染Hela细胞系或者原代神经元的实验要求。定量滴度检测通过qPCR方法完成,实验采用10倍梯度稀释法进行,滴度=IU×计量孔相对于第一孔的稀释倍数/第一孔加入病毒体积(IU=最后一孔可以通过qPCR方法检测到NMNAT1基因表达的细胞数,实验中设为1)。qPCR的结果见图2和表1。NMNAT1的扩增Ct值见图2A,扩增曲线见图 2B;图2C和图2D分别为NMNAT1和内参基因Actin的熔解曲线。因为熔解曲线均为单一峰,无非特异荧光,故根据图2A所得Ct值可准确定量。通过以上方法测定显示,纯化得到的病毒滴度大于2×108TU/ml。采用荧光计数的方法,可以检测得到RNA干扰慢病毒的滴度大于2×108TU/ml,病毒感染293T细胞的梯度稀释荧光图片如图3所示。
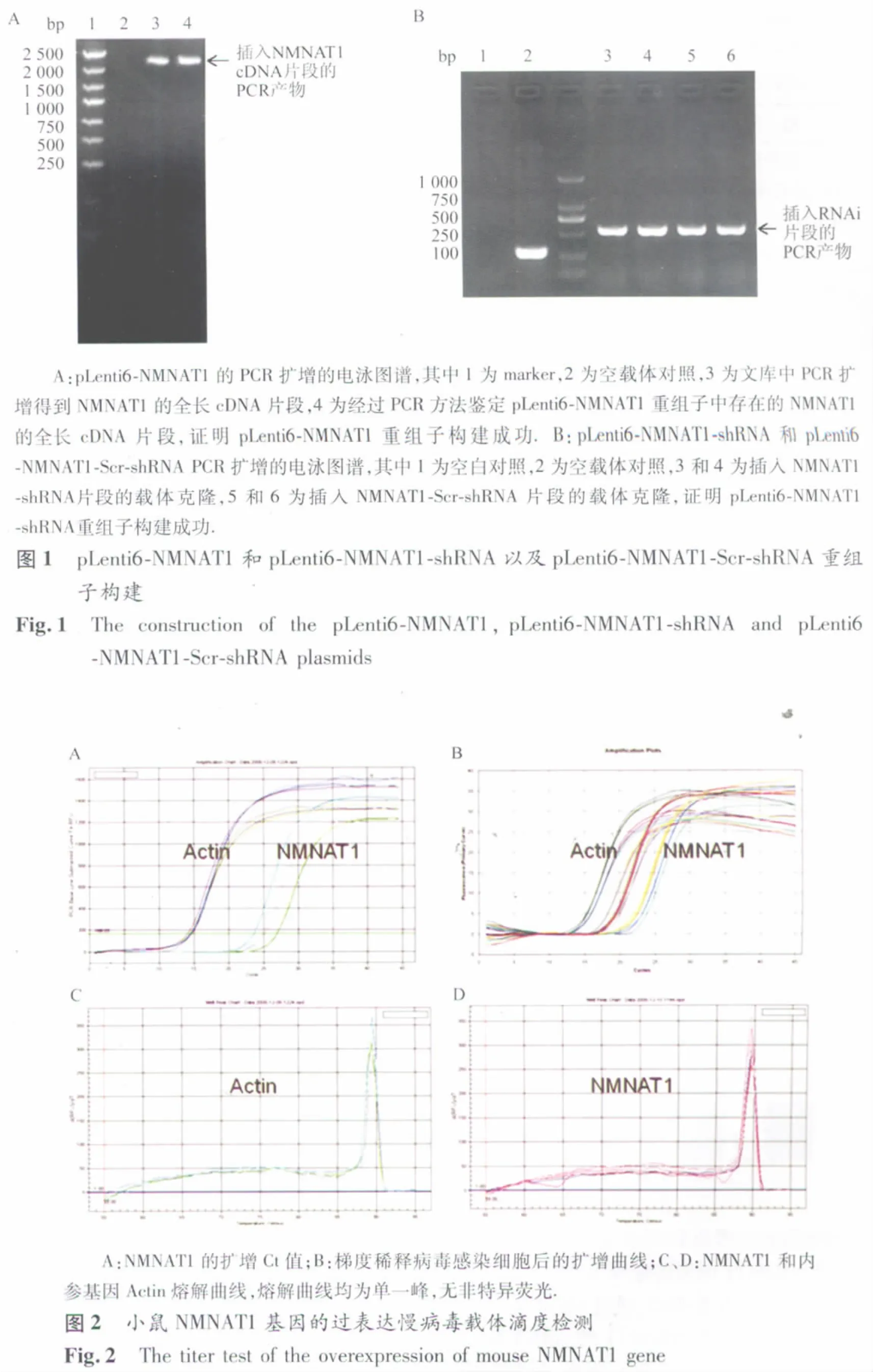
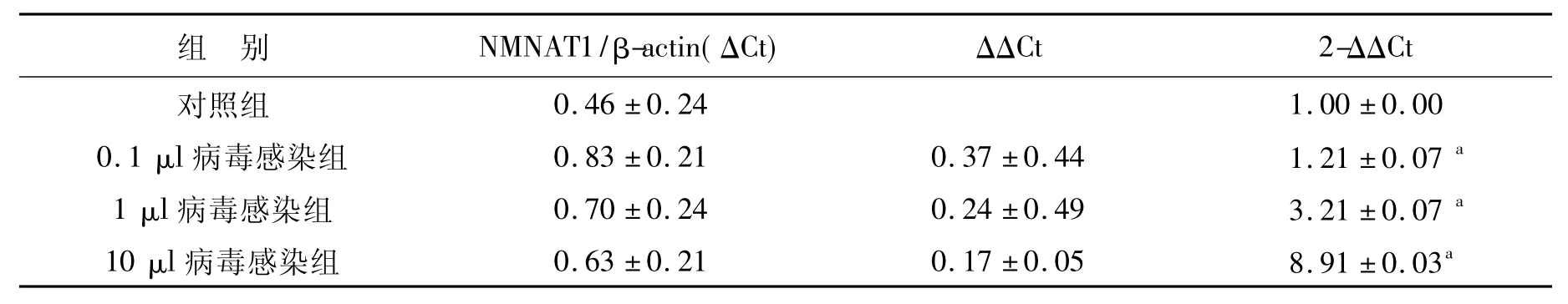
表1 梯度稀释病毒感染293T细胞后qPCR检测NMNAT1 mRNA表达的结果Table 1 The NMNAT1 mRNA level in 293T cells treated with step dilutions of lentiviral vectors detected by qPCR
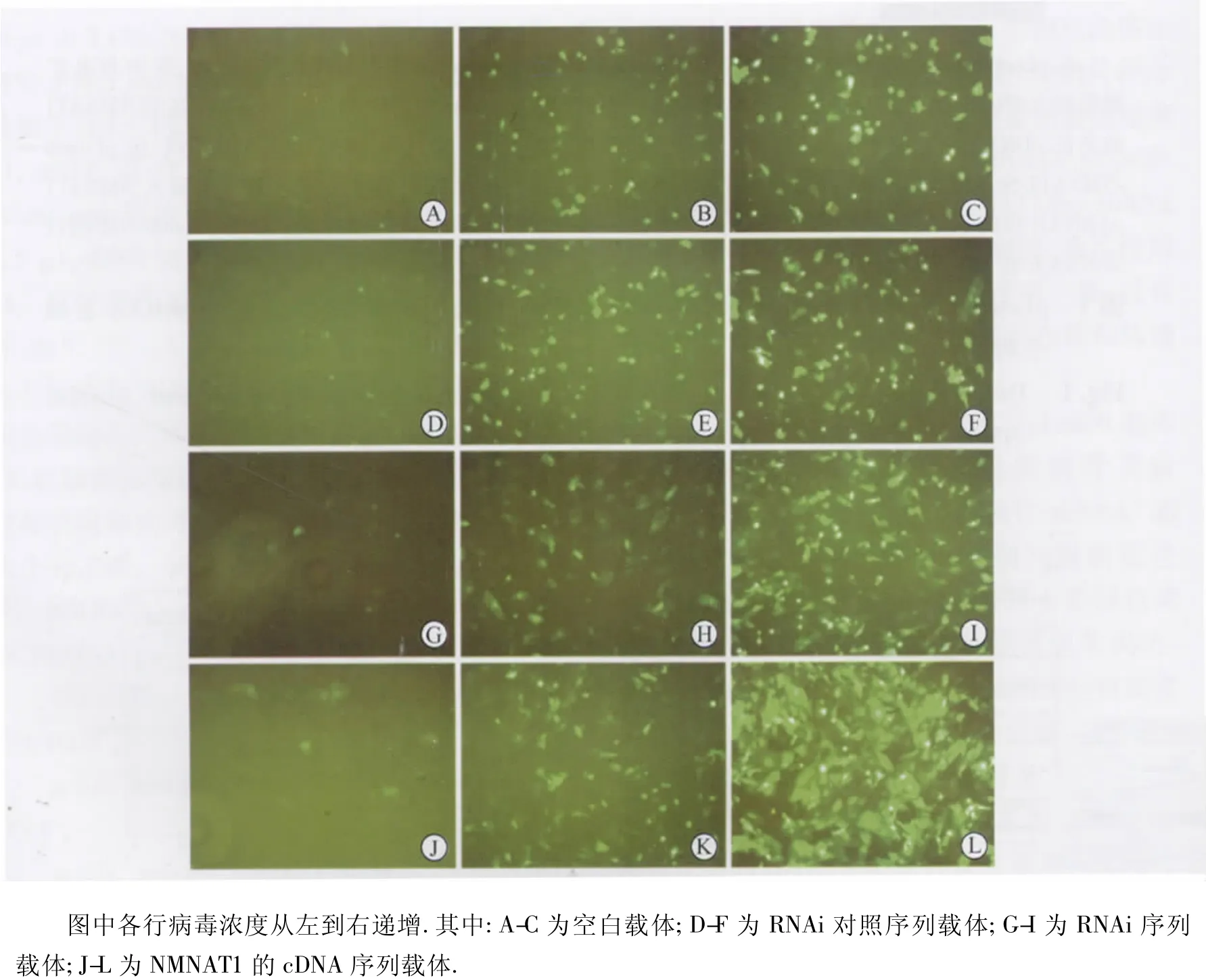
图3 小鼠NMNAT1基因的RNA干扰慢病毒载体滴度检测:荧光图片显示梯度稀释结果Fig.3 The titer test of lentiviral vectors:the fluorescence figures of reporter gene GFP after gradient dilution of viruses
2.3 慢病毒载体感染Hela细胞 Hela细胞在感染携带NMNAT1的慢病毒96 h以后,分别收取细胞的总RNA和总蛋白,通过qPCR方法和Western Blot方法检测NMNAT1的mRNA和蛋白表达水平。实验结果见图4、图5、表2和表3。实验结果显示,不加病毒的正常细胞组和对照病毒载体感染组不表达NMNAT1基因,而NMNAT1慢病毒感染96 h的 Hela细胞组NMNAT1表达水平明显增高,表明NMNAT1慢病毒载体感染可以使Hela细胞显著表达NMNAT1的mRNA(图4和表2)和蛋白质(图5和表3)。在上述基础上,再用RNA干扰慢病毒感染,96 h后继续检测NMNAT1基因的表达水平,结果显示其表达水平下降,说明干扰成功(图4、5)。RNAi组蛋白表达明显低于过表达组和对照组(P<0.05),干扰效率在70%以上。
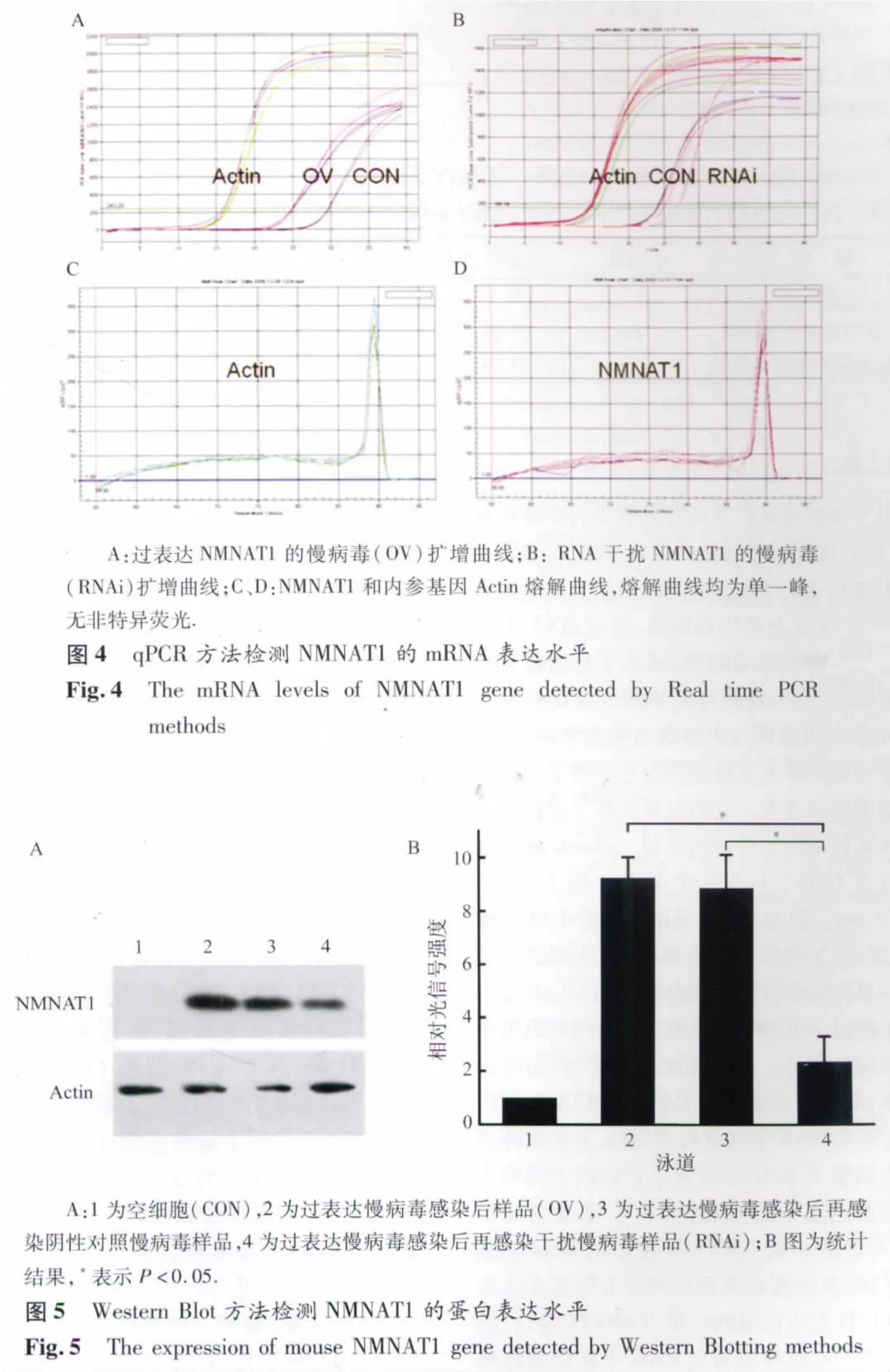

表2 病毒感染Hela细胞后qPCR检测NMNAT1 mRNA的结果Table 2 The NMNAT1 mRNA level in Hela cells treated with lentiviral vectors detected by qPCR
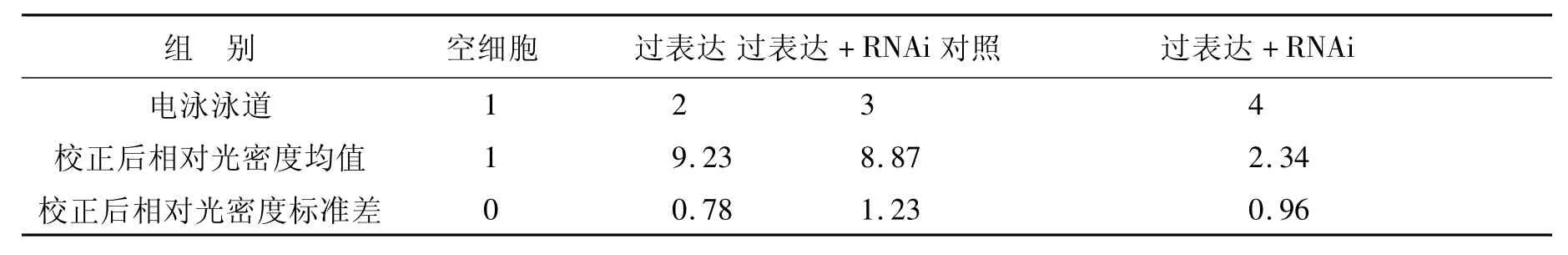
表3 Western Blot方法检测Hela细胞中NMNAT1表达的结果Table 3 The NMNAT1 level in Hela cells treated with lentiviral vectors detected by Western Blot
3 讨论
由于神经系统以及神经元转染的特殊性和难度,我们选用了慢病毒的经典方法,构建了小鼠NMNAT1基因的过表达和RNA干扰慢病毒载体,并包装成为慢病毒颗粒,通过RNA水平和蛋白质水平的双重检测,确认了基因研究工具的有效性[6-7]。慢病毒载体的主要优点是它能将外源基因整合入非分裂细胞的基因组内,对停止分裂的神经元转基因治疗提供了一个可行的基因传递系统。它的出现弥补了逆转录病毒载体在转基因治疗中的不足。pLenti慢病毒系统只含有HIV-1共9个基因中的3个,即gag、pol、rev。因为 HIV-1基因组成分中60%被去除,因此,父代病毒无法复制,载体本身只是将目标基因转移到靶细胞内的工具[8-9],其安全性甚至超过了目前临床试验正在使用的致癌性逆转录病毒载体。我们在此基础上,利用慢病毒载体pLenti6系统制备了小鼠NMNAT1基因的过表达和RNA干扰慢病毒颗粒,并在体外真核表达细胞系Hela中检测了它们的上调和下调基因表达水平的有效性[10-11]。实验结果可见,在不表达小鼠NMNAT1基因的Hela细胞中,我们制备的慢病毒颗粒可以有效地表达出完整全长且大小正确的小鼠NMNAT1蛋白,而这种表达同时也可以被其RNA干扰慢病毒的感染所抑制,从多方面证明了工具的有效性。
RNA干扰是指双链RNA引起的mRNA水平互补序列基因表达的关闭,即序列特异性转录后基因沉默,是生物体进化过程中抵御外来基因和病毒感染的保守机制[12-13]。RNA干扰技术不仅被广泛地应用于基因功能研究,而且在基因治疗中显示出极大的潜力。慢病毒转染神经元以后一般整合到基因组的目的基因拷贝数在3~10个左右,更高的整合效率会引起毒性和整合异常。因此,利用慢病毒系统如此低的转染浓度也可以达到有效的过表达和敲减目的基因的效应,说明了我们制备的上调和下调工具可以用于进一步的基因功能研究。已有的针对NMNAT1基因功能的研究中,一般采用功能缺失型突变体的方法或者采用Wlds重组蛋白(由 Ufd2a,即 U-box-type E4 ubiquitin ligase UFD2a蛋白质的N-末端70氨基酸和全长的NMNAT1酶,从5'-UTR起有18个氨基酸与Ufd2a相连)的方式进行[1-5]。我们的实验中采用了RNA干扰的方法来有效降低单个神经元内的NMNAT1蛋白的表达水平,基于如下原因:首先,采用化学合成siRNA或者慢病毒系统介导的RNAi技术进行神经元系统的RNA干扰实验技术经过过去5~7年的发展,已经相对成熟和完善,有利于功能研究和进一步基因治疗的可行性探索;其次,RNAi技术为药物研究提供了强大的工具,使得近年来这一新兴生物学技术的发展及其在基因治疗和药物开发研究中具有广泛的应用前景,避开了传统针对NMNAT1蛋白的研究策略和方法,确立了一个相对独立的研究思路和实验体系。在已有关于NMNAT1基因在轴突退化和神经系统退行性疾病机制的研究基础上,针对NMNAT1基因功能本身进行基础性的工作和研究,从而获得NMNAT1蛋白在神经系统退行性疾病发病过程中的更多参与途径和可能的干预手段。RNA干扰工具无疑为我们在基础研究和机制探索过程中提供了有效的研究手段和方法,相应的慢病毒技术有效解决了传递系统的瓶颈问题,结合二者优点获得的研究工具为我们进一步的工作奠定了基础。
[1] JIA H,YAN T,FENG Y,et al.Identification of a critical site in Wld(s):essential for Nmnat enzyme activity and axon-protective function [J].Neurosci Lett,2007,413:46-51.
[2] LASERH,CONFORTIL,MORREALEG,et al.The slow Wallerian degeneration protein,WldS,binds directly to VCP/p97 and partially redistributes it within the nucleus[J].Mol Biol Cell,2006,17:1075-1084.
[3] SUZUKI K,KOIKE T.Resveratrol abolishes resistance to axonal degeneration in slow Wallerian degeneration(WldS)mice:activation of SIRT2,an NAD-dependent tubulin deacetylase[J].Biochem Biophys Res Commun,2007,359:665-671.
[4] ZHAI Q,WANG J,KIM A,et al.Involvement of the ubiquitin-proteasome system in the early stages of wallerian degeneration [J].Neuron,2003,39:217-225.
[5] LUO L,O'LEARY D D.Axon retraction and degeneration in development and disease [J].Annu Rev Neurosci,2005,28:127-156.
[6] OSTEN P,DITTGEN T,LICZNERSKI P.lentivirusbased genetic manipulations in neurons in vivo[M].In:KITTLER JT,MOSS SJ,editors.The Dynamic Synapse:Molecular Methods in Ionotropic Receptor Biology.Boca Raton(FL):CRC Press,2006,Chapter 13.
[7] BUKRINSKY M I S,HAGGERTY M P,DEMPSEY N,et al.A nuclear localization signal within HIV-1 matrix protein that governs infection of non-dividing cells[J].Nature,1993,365:666-669.
[8] GOLDSTONE D C,YAP M W,ROBERTSON L E,et al.Structural and functional analysis of prehistoric lentiviruses uncovers an ancient molecular interface[J].Cell Host Microbe,2010,8(3):248-259.
[9] CULLEN B R.Enhancing and confirming the specificity of RNAi experiments [J].Nat Methods,2006,3(9):677-681.
[10] SU Y R,WANGJ,WU JJ,et al.Overexpression of lentivirus-mediated glial cell line-derived neurotrophic factor in bone marrow stromal cells and its neuroprotection for the PC12 cells damaged by lactacystin [J].Neurosci Bull,2007,23(2):67-74.
[11] PRATT K G,ZHU P,WATARI H,et al.A novel role for{gamma}-secretase:selective regulation of spontaneous neurotransmitter release from hippocampal neurons [J].J Neurosci,2011,31(3):899-906.
[12] ELBASHIR S M,HARBORTH J,LENDECKEL W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,411(6836):428-429.
[13] SONG E,LEE S K,WANG J,et al.RNA interference targeting Fas protects mice from fulminant hepatitis[J].Nat Med,2003,9(3):347-351.
Construction of recombinant lentiviral vectors for mouse NMNAT1 gene expression and its interference RNA
ZHAO Hong,YANG Zi-chao,ZHANG Jing-yu
(Department of Neurology,The Fourth Hospital,Harbin Medical University,Harbin 150001,China)
Objective:To construct two recombinant lentiviral vetcors carring mouse NMNAT1 gene and RNAi targeting NMNAT1.Methods:According to GenBank,the full-length cDNA sequence of mouse NMNAT1,an interfering sequence targeting NANAT1 and a negative sequence were designed,synthesized and inserted into plasmid pLenti6 lentiviral vector.The viral stock was prepared by cotransfection of plasmids and the packaging plasmid mix to 293T cells.The virus titer was tested by qPCR methods.After infection of Hela cells with these lentiviruses,the expression of NMNAT1 was detected by qPCR and Western blot.Results:All the recombinant plasmids were confirmed by sequencing.The titer of virus was over 2 ×108TU/mL.Hela cells infected with lentiviral vector carryingfull length NMNAT1 gene successfully expressed high-level NMNAT1.The expression of NMNAT1 reduced to less than 30%after delivery of lentiviral vector carrying RNAi sequence.Conclusions:The lentiviral vectors carrying full length NMNAT1 gene and RNAi sequence targeting NANAT1 have been successfully constructed.
Lentivirus;Recombination,genetic;Plasmides;Genetic vectors;NMNAT1;RNA interference;Gene overexpression
R 319
A
1008-9292(2011)06-0622-08
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2011.06.009
2011-06-20
2011-09-09
黑龙江省自然科学基金资助项目(D200980).
赵 虹(1966-),女,博士,研究方向:脑血管病.
张惊宇(1979-),女,博士,研究方向:脑血管病;E-mail:yang.dh@163.com
[责任编辑 张荣连]
