铋掺杂磁性光催化剂的制备及其光催化活性
2011-01-15盛鑫鑫贺艳坤
周 魁,孙 倩,严 织,盛鑫鑫,贺艳坤
(武汉工业学院化学与环境工程学院,湖北武汉430023)
铋掺杂磁性光催化剂的制备及其光催化活性
周 魁,孙 倩,严 织,盛鑫鑫,贺艳坤
(武汉工业学院化学与环境工程学院,湖北武汉430023)
以Fe3O4/SiO2复合微球为基体,采用溶胶—凝胶法制备了Bi掺杂的磁性TiO2复合光催化剂,并用SEM、FT—IR和VSM等测试手段对催化剂进行了表征。以活性艳红K-2BP为目标降解物评价其光催化活性。结果表明,制备的复合光催化剂易于磁性固液分离,K-2BP溶液初始浓度为20 mg/L,pH值为2,光催化剂的添加量为0.5 g/L,Bi摩尔分数为0.6%的光催化剂时的催化活性最高,光催化反应5 h后K-2BP的降解率达到88.38%。
磁性材料;光催化剂;TiO2;活性染料
纳米TiO2作为光催化剂已经广泛地用于降解有机物及废水处理[1-2]。但纯TiO2的光催化效率不高,因此人们常常用非金属、金属离子掺杂、表面增敏和半导体复合等方法对TiO2进行改性以提高其光催化活性和催化效率[3-5]。但纳米TiO2活性组分易流失而且难回收,不利于光催化剂的重复使用,而将磁性组分Fe3O4引入光催化剂,可以解决这个难题。
然而有研究发现,一方面磁性TiO2前躯体在高温焙烧的过程中磁性组分Fe3O4会转变为 a-Fe3O4,但a-Fe3O4是弱磁性物质,从而使光催化剂的磁性降低[6];另一方面由于Ti4+半径与Fe3+半径相近,焙烧时Fe3+将替代Ti4+进入TiO2晶体中,当Fe3+进入TiO2晶体中的量较多时,电子与空穴复合的几率增大,TiO2实际的光电转换效率降低,从而造成光催化能力下降[7]。
在TiO2和Fe3O4之间引入一层SiO2,不仅可以在一定程度上保护Fe3O4在高温焙烧下由于晶相的变化导致磁性下降,也可阻止由于Fe3+和TiO2的不利结合,导致光催化性能的降低[8]。
本文以自制的Fe3O4/SiO2复合微球为基体,采用溶胶—凝胶法制备了不同掺Bi量的磁性TiO2复合光催化剂,选择活性艳红K-2BP为目标降解物来研究各种复合光催化剂的性能,测定了反应条件(如溶液的pH值、光催化剂的添加量、溶液的初始浓度等)以及掺Bi量对其降解率的影响。
1 实验部分
1.1 实验试剂和仪器
硝酸铋、无水乙醇,选自天津市科密欧化学试剂有限公司;钛酸正丁酯(TTOB),选自天津市巴斯夫化工有限公司;活性艳红K-2BP,选自江苏申新染料化工股份有限公司;水为自制的超纯水。上述试剂均为分析纯。
用S-3000N型扫描电子显微镜,日本Hitachi公司;HH-15型振荡样品磁力计 (VSM),南京大学仪器厂;Avater-330FT-IR红外光谱仪,美国Nicolet公司。
1.2 Bi掺杂复合光催化剂的制备
称取0.2 g Fe3O4/SiO2复合微球,与3 mL钛酸正丁酯、25 mL无水乙醇混合于三颈瓶中,超声分散20 min后,在40℃水浴强烈搅拌,缓慢滴加2 mL不同配比的硝酸铋溶液、0.2 mL浓盐酸和25 mL无水乙醇的混合溶液。继续保持强力搅拌至形成凝胶。将所得凝胶转入旋转蒸发器中,蒸去乙醇,60℃干燥12 h,然后放入马弗炉中550℃煅烧3 h,研磨后即制得不同Bi3+掺杂量的磁性TiO2复合光催化剂。
1.3 光催化剂活性的测定
将配制好的初始浓度为20 mg/L的100 mL活性艳红K-2BP溶液与0.05 g复合光催化剂混合,避光搅拌30 min以建立吸附—脱附平衡。采用500 W汞灯距离反应溶液15 cm处进行照射,每隔30 min进行磁力沉降,取上层清液,在λ=536 nm处测定上层清液吸光度。计算活性艳红K-2BP的降解率(D)。
2 结果与讨论
2.1 复合光催化剂的表征
2.1.1 SEM 分析
图1为Fe3O4/SiO2复合微球和复合光催化剂的SEM照片。由图1a可见,Fe3O4/SiO2复合粒子球形度较好,大小均匀,粒径分布较窄,约为100 nm,中间部分颜色较深而边缘相对明亮,可间接表明Fe3O4与SiO2成功复合。由图1b可见,复合光催化剂粒径分布在150—200 nm之间,较小的粒径使制备的光催化剂拥有较大的比表面积,粒子活性中心就越多,光生电子和空穴就越多,有利于提高其催化性能。

图1 Fe3O4/SiO2复合微球和复合光催化剂的SEM照片
2.1.2 FT—IR 分析
图2是Fe3O4/SiO2(a)、光催化剂 (b)和Fe3O4(c)的红外谱图。c谱线中587 cm-1处的吸收峰是Fe3O4的特征吸收峰,表明制备的纳米粒子为Fe3O4;a谱线中1090 cm-1处的强吸收峰为 Si—O—Si不对称伸缩振动峰,805 cm-1处的峰为对称伸缩振动峰,而480 cm-1处的峰为其弯曲振动峰,表明复合微球中形成了SiO2;b谱线中,Fe3O4以及SiO2在400—600 cm-1的特征吸收峰基本被TiO2中Ti—O的伸缩振动峰掩盖,表明 TiO2已成功将Fe3O4/SiO2复合微球包覆。
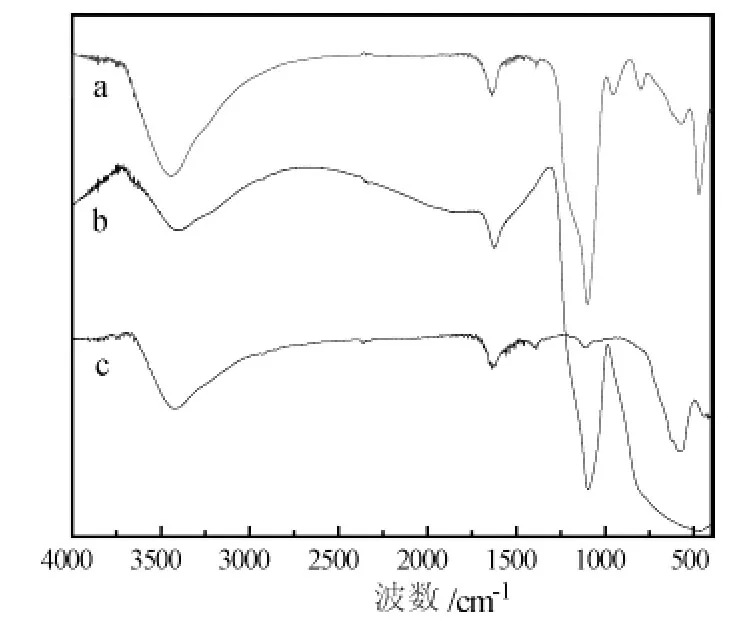
图2 Fe3O4/SiO2(a)、光催化剂 (b)和Fe3O4(c)的红外谱图
2.1.3 VSM 分析
图3是 Fe3O4(a)、Fe3O4/SiO2(b)和光催化剂(c)的磁滞回线。由图3可知,三种样品的饱和磁化强度 Ms分别为 66.92 emu/g、31.98 emu/g、8.49 emu/g,三条磁滞回线都通过零点,剩磁和矫顽力均近似为零,说明以Fe3O4纳米粒子为核制备的样品有很好的超顺磁性,而b、c两种样品的Ms有所下降,这是因为在Fe3O4纳米粒子的表面包覆了一层SiO2和TiO2后,复合粒子单位质量的粉体内磁性物质含量减少,因而其饱和磁化强度有所下降,但仍然具有较好的超顺磁性,光催化剂在外加磁场条件下能有效地与废水实现分离。

图3 Fe3O4(a)、Fe3O4/SiO2(b)和光催化剂(c)的磁滞回线
2.2 掺杂Bi的磁性TiO2复合光催化剂的光催化性能
2.2.1 溶液pH对光催化性能的影响
活性艳红K-2BP溶液的初始浓度为20 mg/L,0.05 g掺 Bi量为 0.6%复合光催化剂添加到100 mL溶液中,调节体系的 pH 值分别为2,4,6,8,10,12,紫外光催化降解5 h后进行磁力沉降,取样测定其吸光度。从图4可见,复合光催化剂对活性艳红K-2BP的光催化效率受pH的影响很大。随着pH的值接近中性,光降解效率明显呈减小的趋势,在强酸和强碱的水溶液中K-2BP的降解率较高,在pH=2时,其降解率达到最大。所以我们选择pH=2来考察各因素对光催化性能的影响。
2.2.2 光催化剂的添加量对光催化性能的影响
活性艳红K-2BP初始浓度为20 mg/L,各组实验溶液的pH=2,掺Bi量为0.6%的光催化剂的不同添加量下光催化降解率的影响如图5所示。图5表明,随着光催化剂的添加量的增加,K-2BP降解率增加,当投加量超过0.5 g/L后,降解率反而略有降低。这是由于光催化剂的添加量过小,光辐射能量得不到充分利用,光生空穴少,因而反应活性中心不足,使降解率难于提高;光催化剂的浓度过高,溶液中的固体颗粒会对紫外光起到屏蔽作用,影响了对紫外光的吸收,导致降解率下降。只有光催化剂投加量适当,才能在其表面激发出较多的光生空穴,提高光催化降解反应速率。本实验中,复合光催化剂的最佳添加量为0.5 g/L。

图5 光催化剂的添加量对光催化性能的影响
2.2.3 染料溶液初始浓度对光催化性能的影响
掺Bi量为0.6%的光催化剂添加量为0.5 g/L,各组实验溶液的pH=2,不同活性艳红K-2BP初始浓度对光催化降解率的影响如图6所示。由图6可知,在研究的K-2BP溶液初始浓度范围内,随着初始浓度的增大,降解率逐渐下降。因为染液浓度升高,影响了溶液对紫外光的吸收,从而减少了磁性光催化剂对光辐射能量的利用,故而降解率下降;然而初始浓度为20 mg/L时,降解率的下降趋势与初始浓度为10 mg/L时相比变化不大,故而确定活性艳红K-2BP的最佳初始浓度为20 mg/L。

图6 染料溶液初始浓度对光催化性能的影响
2.2.4 Bi3+掺杂量对光催化性能的影响
不同掺Bi量的磁性TiO2复合光催化剂对K-2BP溶液的降解率与时间的关系如图7所示。可以看出,与的空白催化剂相比,掺Bi量为0.3%、0.6%、1.2%的光催化剂的催化效率均增大;随着Bi掺入量的增加,光催化剂的催化效率也增加,当掺Bi量为0.6%时,催化活性最高,光催化5 h后染料降解率达到88.38%;掺Bi量继续增加到1.2%时,其催化活性降低,甚至低于未掺Bi的空白催化剂。

图7 Bi3+掺杂量对光催化性能的影响
掺杂的Bi3+进入TiO2晶格内部替代了Ti4+引起了晶格畸变,并积累了一定的晶格应力,为了补偿这种应力,TiO2晶格表面的氧原子容易逃离晶格而起到空穴捕获作用,减小了光生电子-空穴的复合几率,因而表现出更好的光催化活性;当掺杂量超过0.6%时,TiO2晶格内部空间已趋饱和,过量的Bi不再进入晶格内部而是结合了逃离的氧原子以Bi2O3的形式覆盖在TiO2表面,减少了活性中心,也阻碍了TiO2对光的吸收,从而降低光催化效率。
3 结论
采用溶胶—凝胶法,以自制的Fe3O4/SiO2复合微球为基体制备了Bi掺杂的磁性TiO2复合光催化剂,复合光催化剂不仅对活性染料废水的处理既有很好的光催化活性,而且具有超顺磁性,为光催化剂的分离回收和重复使用提供了可能。
Bi掺杂的复合光催化剂的光催化活性在掺杂后得到明显提高,当掺Bi为0.6%时,制备的磁性TiO2复合光催化剂拥有最佳光催化活性。在最适条件下,即光催化剂的投加量为0.5 g/L,K-2BP溶液的初始浓度为20 mg/L,pH约为2,紫外光照射5 h后K-2BP的降解率能达到88.38%。
[1] Somjate P,Virote B.Preparation and characterization of amine-functionalized SiO2/TiO2films for formaldehyde degradation[J].Applied Surface Science.2009,255(23):9311–9315.
[2] Li F F,Sun S M,Jiang Y S,et al.Photodegradation of an azo dye using immobilized nanoparticles of TiO2supported by natural porous mineral[J].Journal of Hazardous Materials.2008,152(3):1037–1044.
[3] Ho W,Yu J C,Lee S C.Low-temperature hydrothermal synthesis of S-doped TiO2with visible light photocatalytic activity[J].J Solid State Chem,2006,179(4):1171-1176.
[4] 袁昌来,董发勤.银镨复合掺杂二氧化钛纳米材料的光催化活性[J].硅酸盐学报,2007,35(6):736-741.
[5] Rodríguez Avendaño R·G,De Los Reyes J·A,Viveros T,et al.Synthesis and characterization of mesoporous materials:Silica– zirconia and silica – titania[J].Catalysis Today.2009,148(1-2):12 – 18.
[6] Donia B,Rose A.Implications of heat treatment on the properties of a magnetic iron oxide–titanium dioxide photocatalyst[J].Materials Science and Engineering.2002,94(1):71-78.
[7] 金名惠,吴自清,唐和清.TiO2/SiO2/Fe3O4的制备及其对溴氨酸降解的光催化活性[J].华中科技大学学报(自然科学版)2006,34(10):108-110.
[8] 李鸿,朱宝林,郑修成,等.包覆型磁性二氧化钛的制备及其光催化性能的研究[J].分子催化 2006,20(5):429-434.
Preparation and photocatalytic activity of Bi-doped magnetic TiO2photocatalysts
ZHOU Kui,SUN Qian,YAN Zhi,SHENG Xin-xin,HE Yan-kun
(School of Chemical and Environmental Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
The magnetic TiO2photocatalyst doped with Bi were prepared by sol-gel process using Fe3O4/SiO2composite micros pheres as supporter.The photocatalyst samples were characterized by SEM,FT-IR and VSM respectively.The photocatal ytic activity of the catalyst was evaluated by degradation of reactive brilliant red K-2BP.The results showed that the composite photocatalyst could be separated from the solution easily.The decolorizing rate reached the maximum of 88.38% by illumination after 5 h when the original concentration of K-2BP was 20 mg/L,pH value of solution was 2,additive amount of photocatalyst was 0.5 g/L,and the molar ratio of Bi to TiO2was 0.6%.
magnetite;photocatalyst;TiO2;reactive dye
O 643.36
A
1009-4881(2011)04-0028-04
10.3969/j.issn.1009-4881.2011.04.008
2011-05-23.
周魁(1985-),男,硕士研究生,E-mail:kevin21kui@126.com.
湖北省自然科学基金项目(2005ABA025);武汉工业学院研究生教育创新基金项目(2010CX018).
