高效液相色谱串联质谱法分析烟草中15种农药残留
2011-01-15严会会胡斌刘惠民马海鸣王丽杰石杰
严会会,胡斌,刘惠民,马海鸣,王丽杰,石杰*
1.郑州大学化学系,郑州高新技术产业开发区科学大道100号450001
2.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号450001
烟草中农药残留量的控制是保证烟草制品吸食安全的重要手段,近年来倍受人们关注。有机磷类农药具有高效、易降解等特点,其种类繁多,广泛应用于各种农作物中,在全世界已有70多年的使用历史[1]。有机磷农药残留量的分析方法主要有气相色谱法(GC)[2-4]、气相色谱-质谱法(GC-MS)[5-7]和高效液相色谱-质谱法(LCMS/MS)[8-10]。2003年,美国农业部农业研究服务中心的Anastassiades等[11]开发了QuEChERS(Quick,Easy,Cheap,Effective,Rugged and Safe)方法,用来实现农药多残留物的高通量分析。其前处理主要采用乙腈提取,分散固相萃取净化,操作快速、环保、简便、价格低廉,主要应用于果蔬和谷物中农药多残留物的检测[12-15]。目前,应用该方法分析烟草中农药多残留的报道较少[16]。黄琪等[17]用该方法结合LC-MS/MS分析了烟草中的15种有机磷类农药的残留。“吡蚜酮”、“磺吸磷”等15种有机磷类和杂环类农药的结构和性质差异较大,其在烟草中的残留分析目前国内尚未见报道。为此,应用QuECh-ERS前处理方法,建立了同时快速分析烟草中“吡蚜酮”、“磺吸磷”等15种有机磷类和杂环类农药残留的LC-MS/MS方法,以扩充我国烟草中农药残留分析对象的数量,并为批量烟草样品中多种农药残留的快速分析提供方法参考。
1 材料与方法
1.1 材料、试剂与仪器
空白烟叶样品,即无农药残留烟叶样品,由国际烟草科学研究合作中心(Cooperation Centre for Scientific Research Relative to Tobacco,CORESTA)和英国FAPAS分析实验室能力验证(Food Analysis Performance Assessment Scheme)共同提供。
甲醇(色谱纯,美国J.T.Baker公司);乙腈(色谱纯,美国ROE公司);氯化钠(AR,天津市恒兴化学试剂制造有限公司);无水硫酸镁(AR,天津凯通化学试剂有限公司),于600℃马弗炉中烘烤5 h,储存于干燥器内备用;PSA吸附剂(primary secondary amine,N-丙基乙二胺键合固相吸附剂)(Dikma Technologies)。
农药标准品分别购自美国Sigma,Chem Service和德国Dr Ehrenstorfer GmbH公司。
Agilent 1200高效液相色谱系统(美国安捷伦公司);API4000三重四极杆串联质谱仪、Analyst1.4.2数据采集处理系统(美国应用生物系统公司);Milli-Q50超纯水仪(美国Millipore公司);CP2245电子天平(感量0.0001 g,德国Sartorius公司);Sigma 1-15PK高速离心机(德国Sigma公司);0.45 μm有机相针式过滤器(上海安谱科学仪器有限公司);1.5 mL和50 mL离心管(美国安捷伦公司)。
1.2 样品处理与分析
准确称取2.0 g烟末至50 mL离心管中,加入10 mL水静置10 min,然后加入10 mL乙腈,手持振荡1 min,再加入4 g无水硫酸镁和1 g氯化钠,立即手持振荡2 min,于4 000 r/min离心10 min。离心后,移取上清液乙腈层1 mL于1.5 mL离心管中,加入150 mg无水硫酸镁和25 mg PSA,手持振荡2 min,于6 000 r/min离心2 min,取上清液200 μL并用流动相稀释至1 mL,经0.45 μm有机相滤膜过滤后进行LC-MS/MS分析。分析条件为:
色谱条件:Waters Atlantis dC18色谱柱(2.1 mm×150 mm i.d.3 μm,美国Waters公司);柱温:25℃;流速:0.2 mL/min;进样量:10 μL;流动相A:水;流动相B:乙腈;流动相洗脱梯度:5%B(体积分数)于1 min内线性升至95%,于9 min内线性降至70%,于2 min内降至5%B并保持6 min;质谱条件:离子源:电喷雾离子源(ESI);扫描模式:正离子扫描;监测模式:多反应监测(MRM);电喷雾电压(Ion Spray Voltage,IS):5500 V;雾化气压力(GS1,N2):0.413 MPa;辅助加热气压力(GS2,N2):0.345 MPa;驻留时间(Dwell Time):50 ms;离子源温度(TEM):500℃。15种农药的质谱检测条件见表1。
2 结果与讨论
2.1 质谱条件的优化
该方法所检测的吡蚜酮等15种农药的极性均较大,易于离子化,适合ESI离子源。选择Q1全扫描,结果显示在正离子扫描模式下,所有化合物的响应值明显优于负离子扫描模式,且具有较高的灵敏度。一般化合物都选择2个离子对,其中干扰少、响应较高的离子对作为定量离子对,另一离子对作为辅助定性离子对,如表1所示。
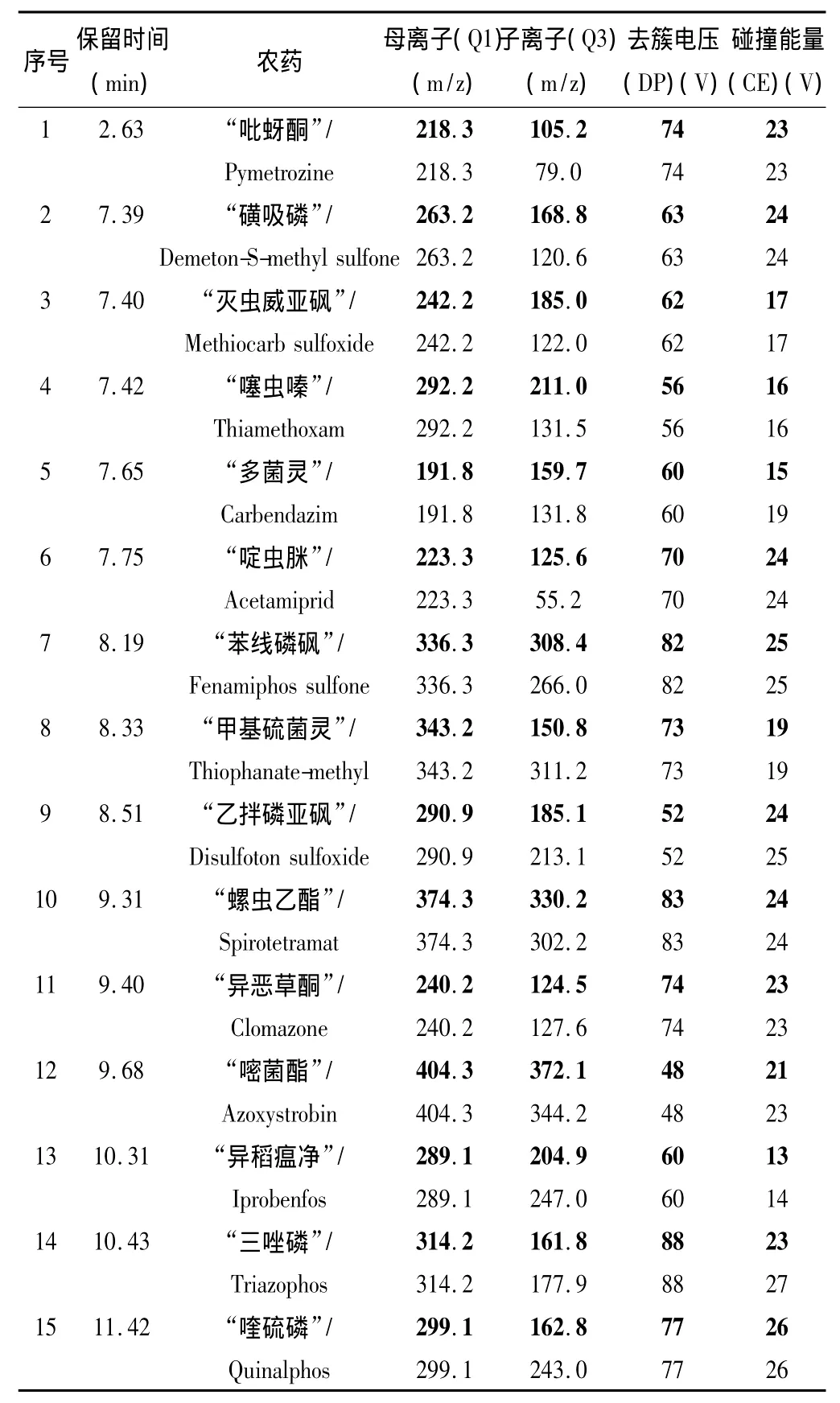
表1 15种农药的质谱检测条件①
2.2 液相色谱条件的优化
流动相组成是MS/MS响应信号的重要影响因素。为选择适宜的流动相,考察了甲醇/水体系、乙腈/水体系及不同的流动相洗脱程序。采用乙腈/水体系和甲醇/水体系时分析物的信号强度和出峰情况相似,由于样品前处理采用乙腈作萃取溶剂,所以选择乙腈/水体系作为流动相。为提高复杂样品的色谱分离和质谱鉴定效率,对流动相洗脱梯度进行了优化,最终采用的流动相梯度洗脱程序见1.2,优化后的MRM离子色谱图见图1。
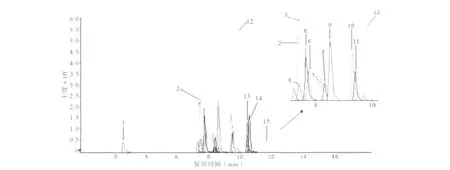
图1 加标水平为1.0 μg/g的空白烟叶样品的总离子流图
2.3 提取方法的选择
QuEChERS法最初是用于蔬菜和水果的前处理,而复烤后的烟叶与蔬菜水果的最大区别是含水率低,复烤后烟叶的含水率在11.2%左右,而新鲜水果和蔬菜的含水率大都在80%左右。所以在操作前,必须补足水分使含水率达到75%以上。比较在加入乙腈提取前,不加水浸润和分别向2.0 g烟叶样品中加水2,4,6,8,10,15和20 mL浸润等8种情况,结果见表2。

表2 不同加水量样品的回收率(%)
由表2可知,先加水浸润烟末,农药更容易游离出来。当对2.0 g烟叶样品的加水量为8和10 mL时,15种农药的回收率均在正常范围内,因此,本实验采用加水量10 mL。
2.4 基质标准工作曲线与方法的检出限
为了降低基质效应带来的离子抑制或增强作用对定量分析产生的影响,采用空白样品提取液配制一系列基质标准工作溶液进行LC-MS/MS分析,采用外标法定量,即用各农药所对应的峰面积(y)对其相应浓度(x,ng/mL)进行线性回归分析,绘制标准曲线(见表3)。
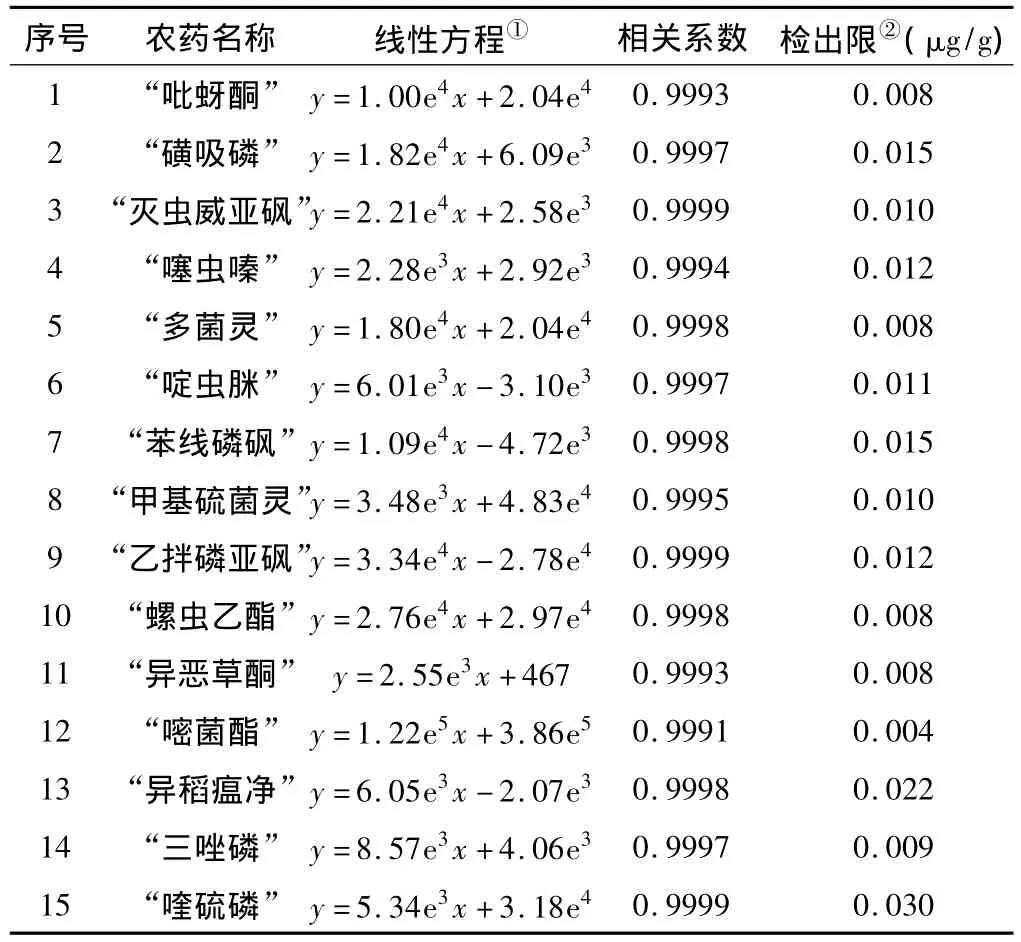
表3 15种农药的线性方程和检测限
由表3可知,15种农药在1~100 ng/mL范围内线性良好(R2≥0.9991),检出限为0.004~0.030 μg/g,可以满足定量分析的需要。
2.5 方法的回收率与精密度
分别在2.0 g空白烟叶样品中添加3个水平的15种农药的混合标准溶液,使各农药含量分别为0.10,0.25和0.50 μg/g。室温放置1 h后,按照1.2的前处理步骤进行回收率实验。每个添加浓度平行重复5次操作,测定精密度,结果见表4。
由表4可知,15种农药在0.10~0.50 μg/g添加浓度范围内,加标回收率为70.43%~117.81%,RSD为1.16%~13.89%。方法的准确度和精密度均符合农药多残留分析的要求。
2.6 4种烟叶样品的分析
测定了由FAPAS(Food Analysis Performance Assessment Scheme)所提供的4种烟叶样品中的15种农药残留量。结果表明,4种烟叶样品中均检测出“多菌灵”、“吡蚜酮”、“啶虫脒”、“异恶草酮和噻虫嗪”等5种农药,其平均含量分别为0.30,0.0016,0.48,0.11和1.43 μg/g,其余农药未检出。检出的各农药含量均低于CORESTA(Cooperation Centre for Scientific Research Relative to Tobacco)于2008年发布的指导性残留限量[18]。
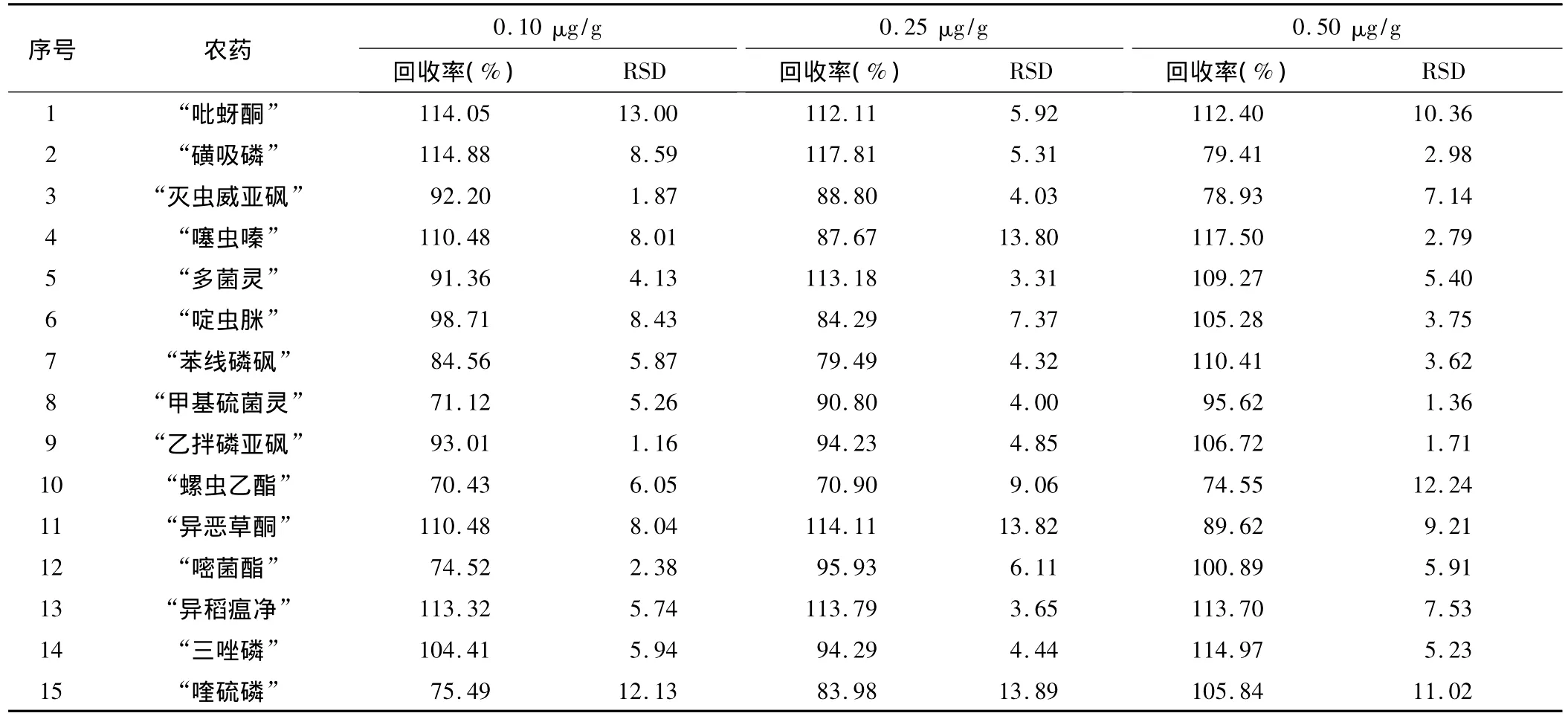
表4 15种农药在不同浓度下的精密度和回收率
3 结论
采用乙腈提取、PSA吸附剂净化和LC-MS/MS方法对烟草中的吡蚜酮、磺吸磷等15种有机磷类和杂环类农药残留进行了快速检测分析。15种农药在0.10~0.50 μg/g添加浓度范围内,回收率为70.43%~117.81%,RSD为1.16%~13.89%。该方法准确度较高、重复性较好,扩充了我国烟草中农药多残留分析的研究对象,适用于批量烟草样品的快速分析。
[1] 马瑾,潘根兴,万洪富,等.有机磷农药的残留、毒性及前景展望[J].生态环境,2003,12(2):213-215.
[2] Ballesteros E,Parrado M J.Continuous solid-phase extraction and gas chromatographic determination of organophosphorus pesticides in natural and drinking waters[J].J Chromatogr A,2004,1029(1-2):267-273.
[3] Shen X,Cai J B,Gao Y,et al.Determination of organophosphorus pesticides in soil by MMSPD-GC-NPD and confirmation by GC-MS[J].Chromatographia,2006,64(1):71-77.
[4] 王凌,徐晓琴,殷月芬,等.GC-FPD双柱法测定海水中的痕量有机磷[J].现代科学仪器,2007,2:75-77.
[5] Chen H,Chen R,Feng R,et al.Simultaneous analysis of carbamate and organophosphorus pesticides in water by single-drop microextraction coupled with GC-MS[J].Chromatographia,2009,70(1-2):165-172.
[6] Pitarch E,Serrano R,López F J,et al.Rapid multiresidue determination of organochlorine and organophosphorus compounds in human serum by solid-phase extraction and gas chromatography coupled to tandem mass spectrometry[J].Anal Bioanal Chem,2003,376(2):189-197.
[7] Lambropoulou D A,Albanis T A.Headspace solid-phase microextraction in combination with gas chromatography-mass spectrometry for the rapidscreening of organophosphorus insecticide residues in strawberries and cherries[J].J Chromatogr A,2003,993(1-2):197-203.
[8] García-Valcárcel A I,Tadeo J L.A combination of ultrasonic assisted extraction with LC-MS/MS for the determination of organophosphorus pesticides in sludge[J].Anal Chim Acta,2009,641(1-2):117-123.
[9] 刘莹雯,丁时超,杜文,等.高效液相色谱-串联质谱法测定烟草中有机磷农药的残留量[J].色谱,2006,24(2):174-176.
[10] Jansson C,Pihlström T,Österdahl B G,et al.A new multi-residue method for analysis of pesticide residues in fruit and vegetables using liquid chromatography with tandem mass spectrometric detection[J].J Chromatogr A,2004,1023(1):93-104.
[11] Anastassiades M,Lehotay S J,Štajnbaher D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and“dispersive solid-phase extraction”for the determination of pesticide residues in produce[J].J AOAC Int,2003,86(2):412-431.
[12] Lehotay S J,de Kok A,Hiemstra M,et al.Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables usinggas and liquid chromatography and mass spectrometric detection[J].J AOAC Int,2005,88(2):595-614.
[13] Nguyen T D,Yu J E,Lee D M,et al.A multiresidue method for the determination of107pesticides in cabbage and radish using QuEChERS sample preparation method and gas chromatography mass spectrometry[J].Food Chem,2008,110(1):207-213.
[14] 董静,潘玉香,朱莉萍,等.果蔬中54种农药残留的QuEChERS/GC-MS快速分析[J].分析测试学报,2008,27(1):66-69.
[15] Díez C,Traag W A,Zommer P,et al.Comparison of an acetonitrile extraction/partitioning and“dispersive solid-phase extraction”method with classical multi-residue methods for the extraction of herbicide residues in barley samples[J].J Chromatogr A,2006,1131(1-2):11-23.
[16] 石杰,刘婷,刘惠民,等.液相色谱串联质谱法测定烟草中有机磷和氨基甲酸酯类农药残留量[J].化学通报,2010(1):63-70.
[17] 黄琪,刘惠民,屈凌波,等.高效液相色谱串联质谱法测定烟草中有机磷农药残留量[J].烟草科技,2008(10):34-38.
[18] Mueller L,Krzemien M.The concept and implementation of agrochemical guidance residue levels[S]//CORESTA agrochemical residual group.CORESTA Cuide No.1.2003.
