链霉菌11371原生质体的制备与再生
2011-01-12陈飞关艳丽吴红艳桓明辉郭玲玲于广峰修翠娟
陈飞,关艳丽,吴红艳,桓明辉,郭玲玲,于广峰,修翠娟
(辽宁省微生物科学研究院,辽宁朝阳122000)
链霉菌11371是辽宁省微生物科学研究院在广西梧州地区土壤中分离得到的1株放线菌,其产生的Tetramycin对苹果腐烂病、苹果斑点落叶病、水稻稻瘟病等有良好的防治效果。为提高Tetramycin的产量,需进行原生质体和分子生物学等技术研究,原生质体的制备与再生是研究的前提和基础。但是不同微生物的细胞壁组成各不相同,所以制备其原生质体的最佳条件也存在着很大差异。本实验通过研究摸索制备原生质体的菌丝菌龄、酶浓度、酶解温度等条件,获得制备原生质体的最佳条件,初步确定了链霉菌11371制备与再生的最佳条件,为链霉菌11371以原生质体为材料的各种研究提供操作平台。
1 材料与方法
1.1 材料
1.1.1 试验菌株不吸水链霉菌梧州新亚种(Streptomyces ahygroscopicus wuzhouensis subsp,以下简称链霉菌11371)。
1.1.2 培养基高氏一号液体培养基、高氏一号固体培养基、高氏一号再生培养基、菌丝生长液体培养基、菌丝生长固液体培养基等[1]。R2YE培养基:KH2PO40.25 g/L,蔗糖103 g/L,MgCl2·6H2O 10.12 g/L,葡萄糖10 g/L,蛋白胨0.1 g/L,酵母膏5.0 g/L,酪蛋白氨基酸0.1 g/L,微量元素溶液2.0mL,TES10mL,琼脂粉18g/L。灭菌后按顺序加入单独灭菌的以下溶液:0.5%KH2PO410 mL/L,2.5 mol/L CaCl2·2H2O 8.0 mL/L,1.0 mol/L NaOH 7.0 mL/L。
1.1.3 试剂P-Buffer、溶菌酶、Tris、EDTA、微量元素溶液、蔗糖等。
1.2 方法
1.2.1 链霉菌11371菌丝体培养取新鲜的斜面孢子接种于30 mL/250 mL三角瓶(带有玻璃珠)的菌丝生长培养液中,28℃恒温摇床培养。
1.2.2 原生质体的制备将菌液倒入离心管中,5 000 r/min离心10 min,收集菌丝体。加入5 mL 10.3%蔗糖洗涤2次,弃上清液。加入5 mL溶菌酶溶液,用吸管混合均匀。置于一定温度的水浴中保温,每隔15 min用吸管吹吸几次,使形成的原生质体从菌丝上脱落下来,取样镜检。将酶解后的菌液用4层擦镜纸过滤于一新无菌离心管中,以滤去未被酶解的菌丝片段,3 000 r/min离心10 min,温和沉淀原生质体。小心弃去上清液,手指轻轻敲打管壁,使原生质体分散在残留的PBuffer中成奶状悬浮液。加入5 mL P-Buffer洗涤沉淀2次,将原生质体沉淀悬浮于1 mL P-Buffer中。立即使用或冷冻保存。
1.2.3 原生质体制备条件的摸索①溶菌酶浓度对原生质体形成的影响[2-3]:将溶菌酶配制成2.0、2.5、3.0、3.5、4.0 mg/mL的不同浓度,用无菌的微孔滤膜(孔径0.22 μm)过滤除菌,置于37℃恒温水浴中酶解,并分别在显微镜下计数,记录不同条件下原生质体形成的数量。确定原生质体形成与溶菌酶浓度的关系;②酶解温度对原生质体形成的影响:将以最适溶菌酶浓度配制成的酶解液与11371的菌丝体混合,分别于31、34、37、40、43℃恒温水浴酶解,并分别在显微镜下计数,记录不同条件下原生质体形成的数量。确定原生质体形成与酶解温度的关系;③酶解时间对原生质体形成的影响:将酶解液与11371的菌丝体混合,置于37℃恒温水浴中分别作用30、60、90、120、150 min。并分别在显微镜下计数,记录不同条件下原生质体形成的数量。确定原生质体形成与酶解时间的关系;④菌丝培养时间对原生质体形成的影响[4]:在11371菌丝的培养过程中,分别取培养36、39、42、45、48 h的11371菌丝体,用上述方法酶解,并分别在显微镜下计数,记录不同条件下原生质体形成的数量。确定原生质体形成与菌丝培养时间的关系;⑤甘氨酸浓度对原生质体形成的影响[5]:按照上述11371菌株菌丝培养的方法,分别在菌丝生长培养液中加入0%、0.5%、0.7%、1.0%、1.2%、1.5%、2.0%、2.5%的甘氨酸,在28℃恒温摇床培养42 h后制备原生质体,并分别在显微镜下计数,记录不同条件下原生质体形成的数量。确定原生质体形成与甘氨酸浓度的关系。
1.2.4 原生质体的再生[6-7]取原生质体悬液在P-Buffer中稀释至10-1、10-2、10-3、10-4、10-5;同时在无菌水中稀释至10-1、10-2、10-3、10-4、10-5。取0.1 mL经P-Buffer和无菌水稀释的原生质体悬液涂布在干燥的最佳再生R2YE平板上,每个稀释样品涂布3个平板。28℃倒置培养5~7 d,统计原生质体再生的菌落数。
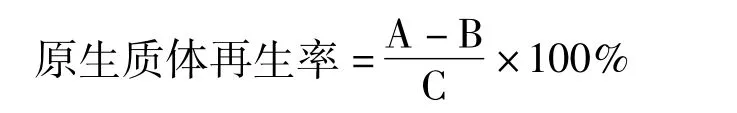
A:P-Buffer稀释后的再生菌落数
B:无菌水稀释后的再生菌落数
C:镜检计数的原生质体数×稀释倍数×0.1 1.2.5原生质体再生条件的摸索[7]再生培养基对原生质体再生的影响:取0.1 mL原生质体稀释液分别涂布在高氏一号、高氏一号再生、R2YE、菌丝生长培养基等再生培养基上,于28℃下恒温培养。观察链霉菌11371原生质体的再生情况。
2 结果与分析
2.1 溶菌酶浓度对原生质体形成的影响
在一定范围内,随着酶量的增加,原生质体化加速。但酶浓度过高对原生质体有毒害,随着酶量增加,杂酶浓度也随之增加,影响原生质体的活性。而且酶浓度过高易使菌体凝聚,难于原生质体化,并且细胞脱壁太彻底,也会使原生质体再生率降低。而过低的酶量又会影响原生质体生成量。试验结果表明,随着酶浓度的加大原生质体形成的数量也不断增加,但当酶浓度达到3 mg/mL时,即使增加酶浓度,原生质体形成的数量也没有明显的增加。同时又由于作用时间太长,不利于原生质体再生,因此,选溶菌酶浓度3 mg/mL作为链霉菌11371原生质体制备和再生的最佳浓度。结果见图1。
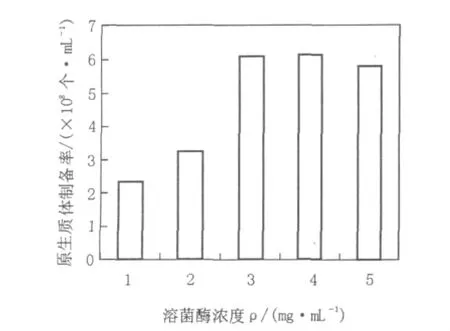
图1 溶菌酶浓度对链霉菌11371原生质体制备率的影响Fig.1 The effect of lysozyme concentration on the rate of preparation of protoplasts
2.2 酶解温度对原生质体形成的影响
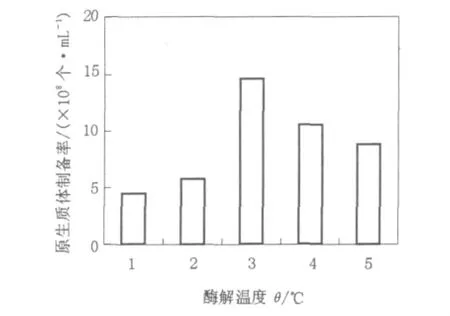
图2 酶解温度对链霉菌11371原生质体制备率的影响Fig.2 The effect of enzymolysis temperature on the rate of preparation of protoplasts
温度对酶解作用有双重影响,一方面随着温度升高,酶解反应速度加快,但温度过高酶易钝化,还可能会影响原生质体本身的DNA或酶系统的活性;另一方面,温度过低,酶解时间延长,从而增加了对形成的原生质体的毒害作用,两者都会影响原生质体的再生率。从图2中可以看出,链霉菌11371在31~43℃温度范围内,形成原生质体的数量明显不同。考虑到温度过高对原生质体再生不利,因此选用37℃为链霉菌11371原生质体制备的最佳酶解温度。
2.3 酶解时间对原生质体形成的影响
酶解时间对原生质体的制备同样具有双重影响,一方面酶解时间的延长可能会增加原生质体的形成数量;但是,另一方面酶解时间的延长会对已形成的原生质体造成毒害作用,原生质体在继续酶解的过程中有可能会丧失其基本的恢复功能,影响再生率。结果如图3所示,随着酶解时间的增加,原生质体形成的数量也不断增加,但当酶解时间达到90 min和120 min时,原生质体的形成数量达到最大值,随后酶解时间的继续延长,原生质体的形成数量反而有下降的趋势。因此,考虑到时间过长对原生质体的再生有影响,选用90 min为原生质体制备的最佳酶解时间。
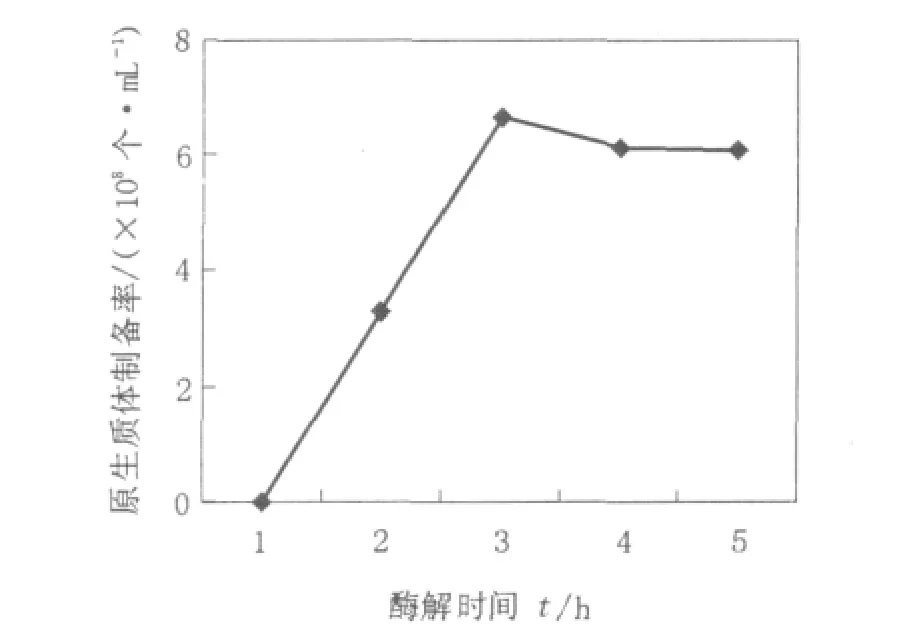
图3 酶解时间对链霉菌11371原生质体制备率的影响Fig.3 The effect of enzymolysis time on the rate of preparation of protoplasts
2.4 菌丝培养时间对原生质体形成的影响
处于不同生长时期的菌丝体,经酶解后一般都可形成原生质体,但活性差异较大。处于稳定期和衰老期的菌丝体,由于菌丝体老化,生理活性降低,以此时期制备的原生质体大小差异明显,再生能力较差。而对数生长期(包括对数前、中期)的菌丝体各部分生理差异小,菌丝活力高,利于原生质体形成,制备的原生质体内含物及细胞器缺损少,修复能力强,再生效果好。因此,要选用处于对数生长期的菌丝体制备原生质体。但处于不同对数生长时期的菌丝体对原生质体的制备和再生也存在一定程度的影响,为了得到较优条件,本试验考察了对数生长期内不同培养时间对原生质体制备的影响。结果如图4所示,不同培养时间的链霉菌11371形成原生质体的数量不同,即随着菌丝培养时间的延长,原生质体的形成数量明显增多,培养时间为39~42 h时原生质体的形成数量基本呈最大值,随后便开始下降。因此选用42 h为原生质体制备的菌丝最佳培养时间。
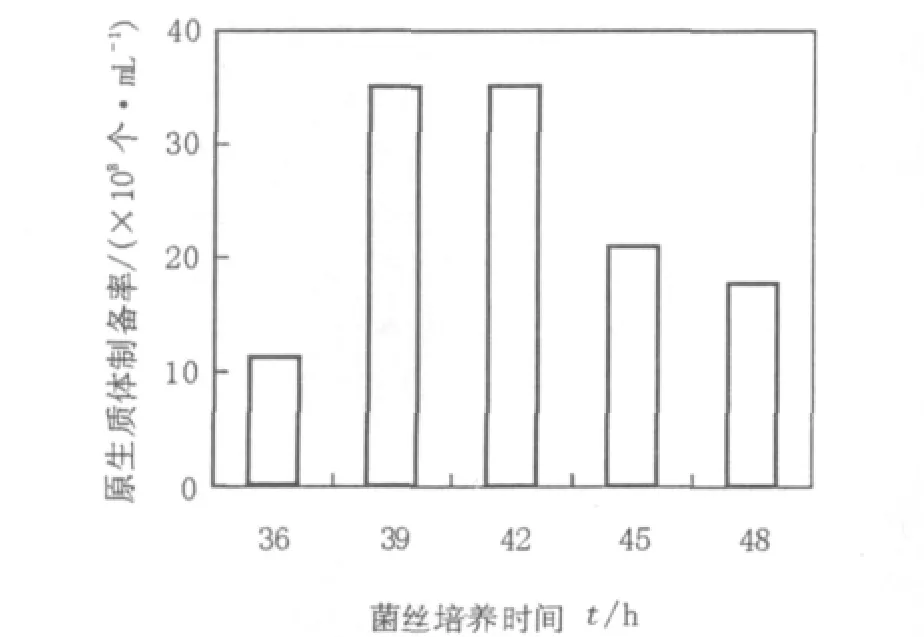
图4 菌丝培养时间对链霉菌11371原生质体制备率的影响Fig.4 The effect of culture time on the rate of preparation of protoplasts
2.5 甘氨酸浓度对原生质体形成的影响
在菌丝生长培养液中加入适量的甘氨酸可以增加菌丝体对溶菌酶的敏感性,因为甘氨酸能取代细胞壁肽聚糖中D-Ala残基,干扰交联,引起细胞壁结构的不完整,有利于去除细胞壁,促进形成大量的原生质体。但是,若甘氨酸过多,菌丝生长会受到强烈抑制,使菌丝量锐减,无法满足用于原生质体制备所需要的菌丝量,而且会使细胞壁结构过于疏松,这虽然有利于原生质体的形成,却容易造成酶解过程中菌丝脱壁太彻底,对脆弱的原生质体造成难以修复的损伤,不利于原生质体再生。试验结果表明,在浓度低于0.7%时,甘氨酸对11371菌丝体的生长有促进作用,原生质体的形成量有所增加;浓度大于0.7%时,菌丝生长量下降,甘氨酸表现出对链霉菌11371菌丝生长的抑制作用,并随着甘氨酸浓度的增加,抑制明显加强,并且原生质体形成的数量也显著下降。因此甘氨酸浓度0.7%更有利于原生质体形成。结果见图5。
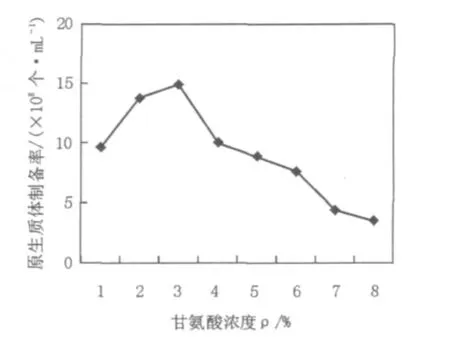
图5 甘氨酸浓度对链霉菌11371原生质体制备率的影响Fig.5 The effect of glycine concentration on the rate of preparation of protoplasts
2.6 再生培养基对原生质体再生的影响
在高氏一号培养基上几乎无再生菌落长出;而添加了10.3%蔗糖(渗透压稳定剂)的高氏一号再生培养基上有再生菌落长出,原生质体的再生率仅有0.2‰左右,但再生菌落形态很小,且少数产生少量孢子,多数不产孢子;在菌丝生长培养基上再生培养,原生质体的再生率可达0.7‰左右,菌落生长缓慢,正常培养7 d菌落仍然很小且产孢少;而R2YE再生培养基上培养的原生质体再生率较以上3种培养基都高,有2.0‰~3.0‰,正常培养7 d菌落即与原始菌落大小一致,产孢子也较多。由此,选定R2YE培养基为链霉菌11371的最适再生培养基。
3 讨论
原生质体的制备和再生是进行外源DNA转化的基础。因为不同菌种原生质体的制备和再生条件存在着差异,所以在进行转化操作之前需要对链霉菌11371菌株的原生质体制备和再生条件进行试验,得到大量的原生质体和较高的再生率以便进行下一步的转化操作。试验得到的最佳制备条件是取新鲜的链霉菌11371斜面孢子接种于30 mL/250 mL三角瓶(带有玻璃珠)含0.7%甘氨酸的菌丝生长培养液中,28℃恒温摇床培养42 h,溶菌酶浓度为3 mg/mL,在37℃温度下酶解90 min。最佳再生培养基为R2YE培养基。
再生培养基是原生质体进行再生的最重要的因素,它对原生质体既有维系、保护作用,又有支持的功效和营养的功能,直接关系到再生率的高低。一般的培养基就是在其菌体生长的培养基中加入渗透压稳定剂和营养物质。由于脱去细胞壁的原生质体需要环境中具有一定的渗透压力才能维持其固有的状态(圆形),否则便会因吸水膨胀而破裂或因失水而皱缩。为保证原生质体的生长,还必须在再生培养基中加入营养物质。添加的营养物质可分为2类,一类是适合于作为细胞壁合成的前体物质(如各种氨基酸、水解酪蛋白等易于用来合成放线菌细胞壁肽聚糖中的短肽链);另一类是通过代谢转化成细胞壁前体物质或促进代谢,加速细胞壁合成的营养因子(如含有大量维生素的酵母膏、各种血清蛋白、各种糖及各种原生质体扩张剂等)。
此外由于原生质体再生的非同步化,早期繁殖起来的菌落会产生自我抑制物质,自我抑制物质又可通过平板上多余的水分扩散,从而抑制周围原生质体的再生,而再生培养基的表面脱水可完全消除这种抑制作用,提高再生率。并且脱水后使平板表面干燥,无冷却水在表面形成可导致原生质体破裂的低渗环境,因此再生平板在使用之前需进行脱水处理,可置于50℃烘箱中30 min或37℃温箱过夜[8]。
[1] Hopwood D A,邓子新译.链霉菌遗传操作实验手册[M].长沙:湖南科学技术出版社,1988.
[2] 孙剑秋,周东坡.微生物原生质体技术[J].生物学通报,2002,37(7):9-11.
[3] 邱荔,孟春,郭养浩,等.金色链霉菌原生质体的制备[J].福州大学学报(自然科学版),2001,29(2):124-127.
[4] 王明兹,施巧琴,周晓兰,等.提高酿酒酵母原生质体制备与再生的方法研究[J].微生物学杂志,2005,25(3):10-13.
[5] 文铁桥.酵母菌原生质体形成与再生多因子从和效应分析[J].湖北大学学报(自然科学版),1997,(4):396-398.
[6] 刘青,肖冬光,姜天笑,等.一种观察酿酒酵母原生质体的简易方法[J].酿酒科技,2005,(6):123-124.
[7] 杨世辉,方呈祥.一种光学显微镜下观察原生质体的染色方法[J].微生物学通报,2000,27(1):55-57.
[8] 贺筱蓉,黄小倩.链霉菌原生质体的再生[J].生物学通报,1998,33(2):40-44.
