TassC结合过氧化物酶体对早期受染巨噬细胞内的鼠伤寒沙门菌的影响
2011-01-12潘欣蔡家麟李广波李晗陈龙吴鉴今
潘欣,蔡家麟,李广波,李晗,陈龙,吴鉴今
(第二军医大学微生物学教研室,上海200433)
鼠伤寒沙门菌(Salmonella typhimurium,St)可引起人胃肠炎,可使鼠产生伤寒样脓血症并致死,是研究人伤寒的一种常用模式微生物[1]。该菌属于细胞内致病菌,其感染细胞后一个显著特性是能够形成一个膜性小泡(salmonella-containing vacuole,SCV)。该菌侵入细胞后,虽可刺激巨噬细胞产生多种细胞因子、抗菌肽等物质杀伤胞内菌,但该菌有数种致病基因可以使其或者在宿主细胞内开发自己的小生境获取营养;或者干扰宿主的防御机制得以生存[2]。沙门菌通过Ⅲ型分泌系统(typeⅢsecretion system,TTSS)将细菌的毒力因子分泌转运到宿主细胞[3]。沙门菌有2个Ⅲ型分泌系统(TTSS-1和TTSS-2)[4],其中致病岛Ⅰ(salmonella pathogenesis island,SPI)编码的Ⅲ型分泌系统TTSS-1在细菌感染的最初阶段发挥作用,调节沙门菌与肠上皮细胞的相互作用,介导细菌的内化及促炎因子的产生[5]。致病岛Ⅱ(SPI-2)编码的Ⅲ型分泌系统TTSS-2在细菌所致的系统性感染中发挥重要作用,当细菌进入宿主细胞后,TTSS-2的效应蛋白被转运至细胞内的不同部位,包括细胞核、细胞质、细胞骨架及吞噬体等,这些不同的定位模式提示这些效应蛋白可能调控宿主细胞的多种功能[6]。SPI-2系统可以分泌很多蛋白,其中SpiC可以与宿主细胞的Hook3相互作用而抑制SCV与溶酶体的融合[7]。宿主细胞编码的一种NIPSNAP家族名为TassC(Target for Salmonella secreted protein SpiC,TassC)的蛋白可以与SpiC相互作用[8],SpiC阻止含TassC囊泡募集到SCV而绕开细胞内的降解途径,可以通过干扰SCV沿肌动蛋白细胞骨架运动或通过阻止携带细菌特异性成分的囊泡与溶酶体融合来实现[8]。沙门菌分泌的SifA和SseJ可以影响肌动蛋白重组织[9],但SpiC对细胞骨架没有影响,却在体内和体外阻止囊泡之间的融合[10]。而SpiC究竟阻止哪类囊泡的融合目前还不清楚。我们曾发现TassC多抗磁珠可以结合过氧化物酶体标志物过氧化氢酶(catalase)和可诱导型一氧化氮合成酶(iNOS)[11];最近的研究发现TassC定位于细胞的过氧化物酶体上,而过氧化物酶体和TassC在沙门菌感染后出现在沙门菌吞噬泡周围。推测在感染早期,TassC结合过氧化物酶体携带iNOS参与杀菌机制;而随着感染时间的延长,胞内菌分泌至细胞的SpiC得以积累[12],并通过与TassC的结合而阻止过氧化物酶体及其携带的杀菌物质与鼠伤寒沙门菌结合,杀菌作用被抑制,使部分细菌在胞内得以生存,感染的晚期事件还有待实验进一步验证。
1 材料与方法
1.1 材料
1.1.1 细胞系和菌株鼠伤寒沙门菌ATCC 14028(以下简称ST)购于美国ATCC;鼠巨噬细胞RAW264.7购于中国科学院上海细胞生物研究所。
1.1.2 主要试剂与仪器pDsRed2-Perxi和pTassC-GFP质粒为本课题组保存;SYTO42购于美国Invitrogen公司;山羊抗人溶酶体相关膜蛋白(LAMP-1)购于美国Santa Cruz公司;FuGENE 6购于瑞士Roche公司;Olympus IX81荧光显微镜购于日本Olympus公司。
1.2 方法
1.2.1 鼠巨噬细胞过氧化物酶体和TassC的荧光标记将鼠巨噬细胞RAW264.7以3×105细胞/孔的密度平铺于放有无菌盖玻片的6孔板内,37℃5%CO2孵育至细胞80%汇合时,取3 μL FuGENE 6与200 μL Opti-MEMⅠ无血清培养基混合,加入2 μg质粒(过氧化物酶体组为2 μg pDsRed2质粒;TassC组为2 μg pTassC-GFP质粒;过氧化物酶体-TassC组为pDsRed2-Perxi和pTassC-GFP质粒各1 μg;对照组为2 μg pcDNA 3.1-GFP质粒),分别混匀后室温静置20 min。各孔细胞分别用Opti-MEMⅠ无血清培养基洗涤1次,加入FuGENE 6-质粒混合物,并补充800 μL Opti-MEMⅠ无血清培养基,37℃5%CO2孵育4 h后,换含有10%小牛血清的DMEM培养基继续培养48 h。用荧光显微镜鉴定阳性细胞,pD-sRed2质粒转染阳性细胞名为RAW-D细胞,pTassC质粒转染阳性细胞名为RAW-T细胞,pD-sRed2-Perxi和pTassC-GFP质粒转染阳性细胞名为RAW-DT细胞,pcDNA3.1-GFP质粒转染阳性细胞名为RAW-G。
1.2.2 免疫染色6孔板无菌盖玻片上的质粒转染的巨噬细胞,染色前用PBS洗3次,加4%多聚甲醛(Polysciences)固定30 min,用PBS洗,经含0.5%Triton X-100(Shelton Scientific)的PBS透化30 min后,再用Image-iT FX信号增强剂(In-
2 结果与分析
2.1 巨噬细胞TassC位于囊泡结构中
绿色荧光蛋白在激发光谱为489 nm、发射光谱为508 nm的荧光显微镜下呈绿色,所用滤光片vitrogen)封闭30 min。将一抗和二抗用PBS稀释至适当浓度依次于室温孵育60 min。染色并干燥后的盖玻片用抗褪色金牌介质(Invitrogen)在载玻片上装片。指甲油封片。溶酶体标志物山羊抗人溶酶体相关膜蛋白(Lamp-1)多抗或过氧化物酶体标志物山羊抗人过氧化氢酶(catalase)多抗分别以1∶500稀释。用键合了Alexa 594的驴抗山羊IgG(Invitrogen)显色。
1.2.3 鼠伤寒沙门菌ATCC 14028感染质粒转染鼠巨噬细胞ST接种于LB培养基上,37℃过夜培养(不振荡)。收获细菌用不含抗生素的Opti-MEM I无血清培养基洗涤3次并悬浮于该培养基中,加入细胞渗透性荧光染料SYTO42至终浓度为1 μmol/L,涡旋混匀后室温孵育30 min。用不含抗生素的Opti-MEMⅠ无血清培养基洗涤3次去除浮色,再悬浮于该培养基中。以10∶1(细菌∶细胞)的比例感染质粒转染48 h的细胞,1 000 r/min室温离心5 min,然后在37℃5%CO2孵箱中放置60 min,PBS洗涤3次,加4%多聚甲醛(Polysciences)固定30 min,用PBS洗。干燥后的盖玻片用抗褪色金牌介质(Invitrogen)在载玻片上装片。指甲油封片。为FITC。pcDNA3.1-GFP质粒转染的阳性细胞可见绿色荧光蛋白GFP散布于细胞质中,没有成形的结构(图1);pTassC-GFP质粒转染的阳性RAW-T细胞可见发绿色荧光的TassC位于有形的囊泡结构中(图2)。
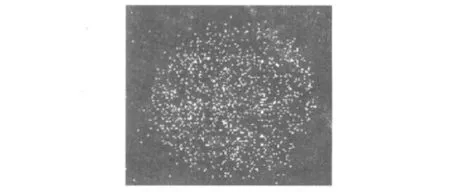
图1 pcDNA3.1-GFP质粒转染RAW264.7细胞示绿色荧光蛋白GFP散布于细胞质中Fig.1 The pcDNA3.1-GFP plasmids carrying green fluorescent protein showed dispersed pattern in RAW264.7 cytoplasm
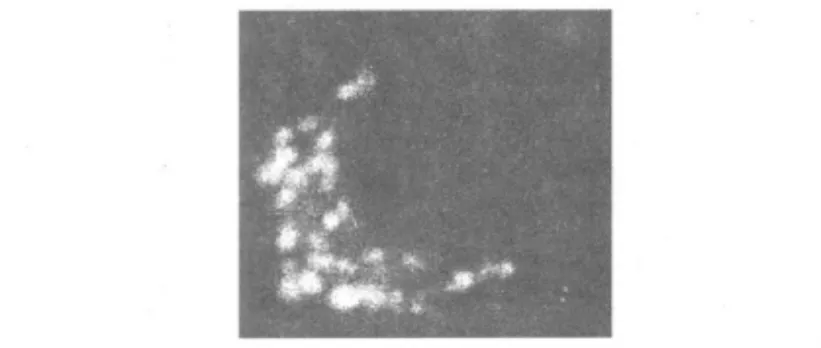
图2 pTassC-GFP质粒转染RAW264.7细胞示发绿色荧光的TassC-GFP位于囊泡结构中Fig.2 The pTassC-GFP plasmids carrying TassC-GFP localized in vesicular structures in RAW264.7 cells
2.2 巨噬细胞TassC与溶酶体、过氧化物酶体的关系

图3 RAW-T细胞TassC-GFP囊泡与溶酶体无共定位Fig.3 TassC-GFP uncolocalize with lysosomal marker Lamp-1 in RAW-T cells
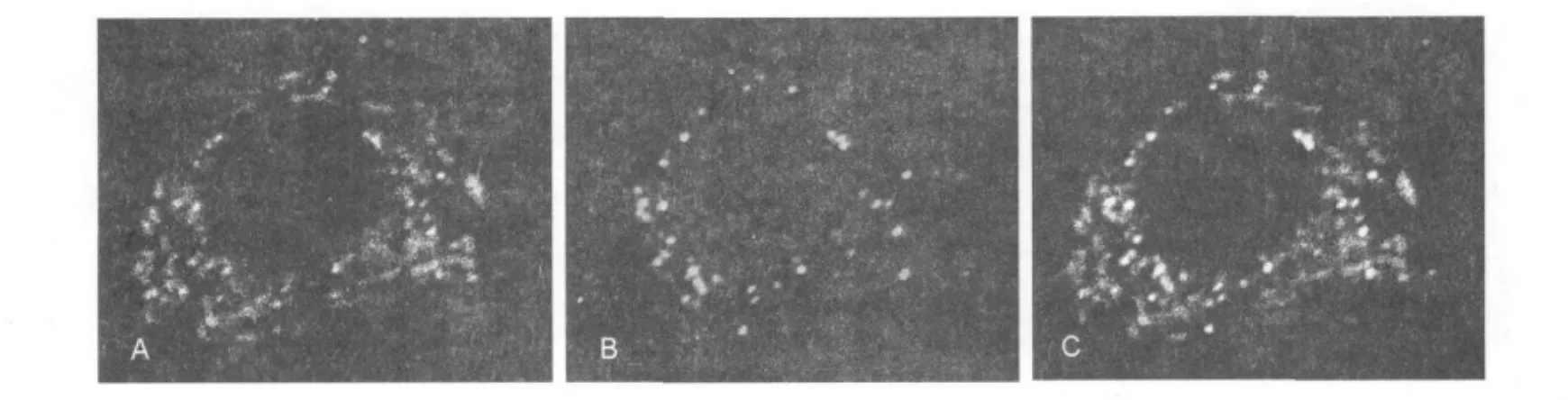
图4 RAW-DT细胞TassC-GFP囊泡与过氧化物酶体共定位Fig.4 TassC-GFP colocalize with peroxisome in RAW-DT cells
RAW-T细胞的免疫荧光结果显示溶酶体标志物Lamp-1与TassC-GFP囊泡结构区域无共定位(图3),即溶酶体与TassC囊泡两者不结合;pDsRed2-Perxi质粒含PTS1序列,可将红色荧光蛋白转入过氧化物酶体基质中,pDsRed2-Perxi和pTassC-GFP质粒共转染的阳性RAW-DT细胞中可见发绿色荧光的TassC-GFP可与发红色荧光的过氧化物酶体共定位(图4),即过氧化物酶体可与TassC囊泡结合。
2.3 巨噬细胞TassC与过氧化物酶体聚在入侵巨噬细胞的鼠伤寒沙门菌周围
SYTO42标记的鼠伤寒沙门菌感染RAW-DT细胞1 h,可见细胞内发蓝绿色荧光的鼠伤寒沙门菌吞噬泡(Salmonella-containing vacuole,SCV)可与发绿色荧光的TassC-GFP和发红色荧光的过氧化物酶体共定位(图5),且过氧化物酶体和TassC在SCV周围集聚较多。
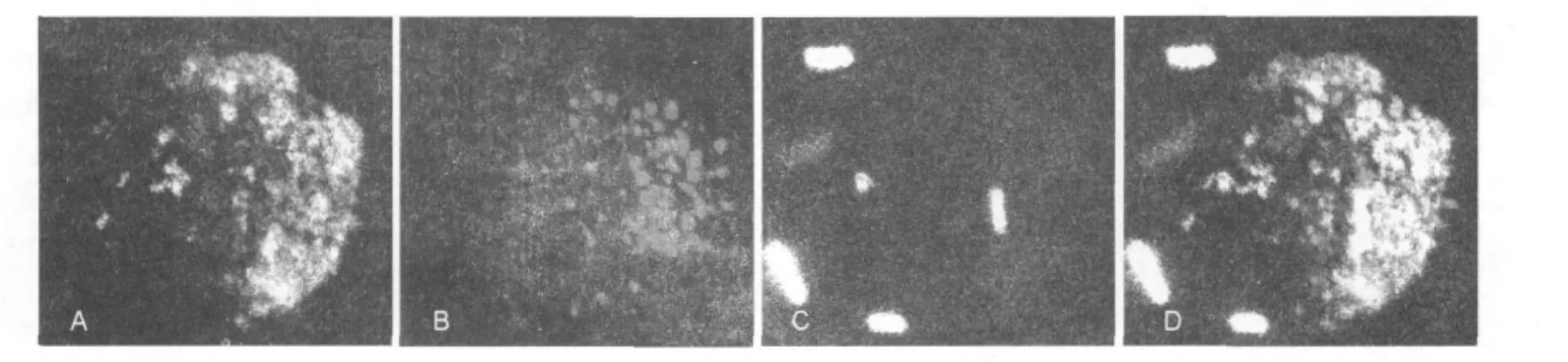
图5 鼠伤寒沙门菌入侵RAW-DT招募TassC-GFP囊泡与过氧化物酶体Fig.5 TassC-GFP on peroxisome was recruitmented to the Salmonella-containing vacuole in RAW-DT cells
3 讨论
沙门菌感染细胞形成的伤寒沙门菌吞噬泡SCV,其暂时获得的早期可循环内涵体标志物,如早期内涵体抗原1(Eea1)、转铁蛋白受体(Tfr1)、Rab5和Rab11,迅速被晚期内涵体标志物(如空泡ATP酶和Rab7)所取代;随后吞噬泡还会获得溶酶体标志物如Lamp-1(lysosome-associated membrane proteins,Lamp),但没有其他的溶酶体活性标志物,如6-磷酸甘露糖、组织蛋白酶L和组织蛋白酶D等水解酶[13]。这使含有寄生菌的囊泡得以伪装而逃逸宿主细胞的防御损伤。
本研究发现与鼠伤寒细菌产生的SpiC相互作用的TassC在细菌侵入早期可以与过氧化物酶体结合,并招募过氧化物酶体聚集在细菌周围。过氧化物酶体属于真核细胞中的呼吸类细胞器,行使的功能十分广泛,在脂质代谢和过氧化氢解毒方面起重要作用。已有的研究表明,诱导型一氧化氮合酶(iNOS)在鼠肝细胞中定位于过氧化物酶体[14],iNOS催化产生的NO˙具有重要的杀菌、抗病毒、杀伤肿瘤细胞等活性[15]。过氧化物酶体募集到吞噬泡周围可能已经获得了如iNOS[14]或其他天然杀菌的催化酶,有可能在过氧化物酶体贴近吞噬泡时实现了iNOS的杀菌功能。TassC和过氧化物酶体及其携带的诱导型一氧化氮合酶在鼠伤寒沙门菌感染中晚期是否由于SpiC的大量产生而远离胞内菌使之得以在胞内继续生存值得进一步研究。
[1] 潘欣.鼠伤寒沙门菌感染巨噬细胞铁稳态相关基因的mRNA表达谱[J].微生物学杂志,2008,28(3):15-20.
[2] Pan X,Tamilselvam B,Hansen EJ,et al.Modulation of iron homeostasis in macrophages by bacterial intracellular pathogens[J].BMC Microbiol,2010,10:64.
[3] Hueck CJ.Type III protein secretion systems in bacterial pathogens of animals and plants[J].Microbiol Mol Biol Rev,1998,62(2):379-433.
[4] Galán JE,Ginocchio C,Costeas P.Molecular and functional characterization of the Salmonella invasion gene invA:homology of InvA to members of a new protein family[J].J Bacteriol,1992,174(13):4338-4349.
[5] Galán JE.Interactions of Salmonella with host cells:encounters of the closest kind[J].Proc Natl Acad Sci USA,1998,95(24):14006-14008.
[6] Shea JE,Hensel M,Gleeson C,et al.Identification of a virulence locus encoding a second type III secretion system in Salmonella typhimurium[J].Proc Natl Acad Sci USA,1996,93(6):2593-2597.
[7] Shotland Y,Krämer H,Groisman EA.The Salmonella SpiC protein targets the mammalian Hook3 protein function to alter cellular trafficking[J].Mol Microbiol,2003,49(6):1565-1576.
[8] Lee AH,Zareei MP,Daefler S.Identification of a NIPSNAP homologue as host cell target for Salmonella virulence protein SpiC[J].Cell Microbiol,2002,4(11):739-750.
[9] Beuzón CR,Méresse S,Unsworth KE,et al.Salmonella maintains the integrity of its intracellular vacuole through the action of SifA[J].EMBO J,2000,19(13):3235-3249.
[10] Yu XJ,Ruiz-Albert J,Unsworth KE,et al.SpiC is required for secretion of Salmonella Pathogenicity Island 2 type III secretion system proteins[J].Cell Microbiol,2002,4(8):531-540.
[11] 潘欣.巨噬细胞过氧化物酶体与鼠伤寒沙门菌相互作用的初步分析[J].解放军医学杂志,2008,33(4):407-409.
[12] Uchiya K,Barbieri MA,Funato K,et al.A Salmonella virulence protein that inhibits cellular trafficking[J].EMBO J,1999,18(14):3924-3933.
[13] Ramsden AE,Holden DW,Mota LJ.Membrane dynamics and spatial distribution of Salmonella-containing vacuoles[J].Trends Microbiol,2007,15(11):516-524.
[14] Loughran PA,Stolz DB,Vodovotz Y,et al.Monomeric inducible nitric oxide synthase localizes to peroxisomes in hepatocytes[J].Proc Natl Acad Sci USA,2005,102(39):13837-13842.
[15] Pan Xin.Expression profiles of iron metabolism-related genes in macrophages infected by Salmonella typhimurium[J].Med J Chin PLA,2008,33(5):502-505.
