树突状细胞在AIDS灵长类动物模型疾病进程中的作用
2010-12-25夏厚军张高红郑永唐
夏厚军, 张高红, 郑永唐,*
(1.中国科学院昆明动物研究所 中国科学院和云南省动物模型与人类疾病机理重点实验室, 云南 昆明 650223; 2. 中国科学院研究生院, 北京 100039)
树突状细胞在AIDS灵长类动物模型疾病进程中的作用
夏厚军1,2, 张高红1, 郑永唐1,*
(1.中国科学院昆明动物研究所 中国科学院和云南省动物模型与人类疾病机理重点实验室,云南 昆明650223; 2.中国科学院研究生院,北京100039)
非人灵长类动物模型在艾滋病(AIDS)发病机制、传播途径、疫苗和药物等方面的研究中具有重要作用。树突状细胞(DC)作为最重要连接先天免疫与获得性免疫的抗原递呈细胞,在AIDS发病进程中扮演着重要的角色。研究非人灵长类AIDS动物模型中DC亚群数量、表型以及功能的变化,对揭示AIDS发病机制具有十分重要的意义。该文将重点总结近些年来DC亚群在AIDS动物模型发病机制中的作用研究进展,为以后的研究提供思路。
艾滋病; 人免疫缺陷病毒; 猴免疫缺陷病毒; 树突状细胞; 灵长类; 动物模型
非人灵长类动物是人类的近亲,由于在组织结构、免疫、生理和代谢等诸多方面与人类高度近似,科学界较普遍地利用非人灵长类作为动物模型来研究艾滋病(acquired immunodeficiency syndrome, AIDS),非人灵长类动物所携带的猴免疫缺陷病毒(simian immunodeficiency virus, SIV)也与HIV-2具有很高的同源性。迄今为止,已从非人灵长类宿主动物中分离出40多种SIV,遗传学上主要分为SIVcpz、SIVsm、SIVmnd、SIVsyk和SIVagm五大支系。尽管天然宿主体内病毒载量非常高,而且黏膜中大量CD4+T细胞被剔除,但是却不会进展为AIDS。非天然宿主的亚洲猴,如恒河猴(rhesus macaque)、食蟹猴(cynomolgus macaque)等,接种大部分SIV 病毒株后则可产生类似AIDS样病症,而其中又以SIVsm和SIVmac较成功(Li et al,2005)。AIDS灵长类动物模型在致病机制、药物和疫苗评价研究方面已显示出良好的应用前景和价值,尤其以SIV或SHIV感染的恒河猴模型应用最为广泛(Li et al, 2007; Zhang et al,2007)。树突状细胞(dendritic cell, DC)在人免疫缺陷病毒(human immunodeficiency virus, HIV)感染过程中扮演着十分重要的角色。Langerhans细胞(LC)是性传播途径中首先遭遇HIV的免疫细胞,并介导了HIV向淋巴结中CD4+T淋巴细胞的传播(Shattock & Moore,2003)。HIV/AIDS患者的髓样DC(myeloid DC,mDC)和浆细胞样DC(plasmacytoid DC, pDC)在血液和淋巴结中大量丢失,这种趋势与病毒载量呈负相关,而与CD4+T淋巴细胞数量呈正相关(Pacanowski et al,2001;Barron et al,2003)。通过AIDS动物模型中DC数量及功能变化研究,能够揭示许多重要的致病机制,为AIDS的防治提供新思路。本文将简要介绍DC亚群在非人灵长类AIDS动物模型疾病进展中的作用研究进展。
1 树突状细胞亚群的来源及种类
Steinman和Cohn(1973)首次描述了一种新的存在于小鼠脾脏、淋巴结和Peyer’s 结中的呈树突形态细胞,将其称之为DC。DC来源于骨髓中的造血干细胞,能够识别和加工外来抗原并将其递呈给T淋巴细胞,从而引发针对外来抗原的免疫应答。在共有的抗原获取和递呈的特性之下,DC是一群异质性细胞,并随其所处位置、迁移途径和特定的免疫学功能以及不同的发育相关细胞因子而被分成不同的亚群(Shortman & Liu,2002)。DC亚群广泛分布于外周组织中,成为阻止病原体侵入的重要屏障。
DC来源于骨髓,其发育过程包括4个主要阶段:1)骨髓造血干细胞(haematopoietic stem cells, HSC);2)前体DC,游离于血液和淋巴组织中,可识别病原体分泌细胞因子;3)未成熟DC,其抗原获取和处理能力强;4)成熟DC,具有在次级淋巴组织中将抗原递呈给T淋巴细胞的能力,并上调共刺激分子表达(Banchereau et al,2000)。从HSC到DC的发育过程主要沿两条途径,一条通过共同的髓系前体(common myeloid progenitors,CMP)最终发育成为mDC;另一条通过共同的淋巴系前体(common lymphoid progenitors,CLP),最终发育成为pDC。pDC和单核细胞一样,都只是DC前体,它们需经进一步分化才能成为未成熟DC(Liu,2001)。mDC又可以分成迁徙性DC(migratory DC)和淋巴组织常驻性DC(lymphoid-tissue-resident DC)。大多数非淋巴组织中的DC都可以视为迁徙性DC,主要包括LC、真皮DC(dermal DC)、间质DC(interstitial DC)以及血液中mDC等。迁徙性DC通常在外周非淋巴组织中巡游并监视着外来危险信号,摄取抗原,成熟后迁徙到淋巴组织中并递呈抗原。淋巴组织常驻性DC则通常分布于胸腺、脾脏和淋巴结等淋巴组织。这两类DC最明显的差异在于:迁徙性DC只能成熟后出现在淋巴组织中,而常驻性DC在淋巴组织中是非成熟的,但能获取并递呈抗原(Shortman & Naik,2007)。
2 非人灵长类动物体内主要DC亚群的鉴定
2.1 血液中的DC
在稳定状态(steady stage)下,mDC和pDC在血液中数量十分稀少,约占外周血单个核细胞中的0.5%~2%。Fms-相关酪氨酸激酶3受体(Flt3L)在控制DC群体动态平衡中具有重要作用。恒河猴注射Flt3L后能有效提高mDC和pDC的数量。与人DC亚群类似,恒河猴mDC和pDC均不表达CD3、CD14和CD20(Lin),而表达HLA-DR。通过CD11c和CD123的表达可从Lin-HLA-DR+细胞群中鉴定出mDC和pDC(Coates et al,2003;Teleshova et al,2004)。由于pDC高表达CD123,因此也可直接通过HLA-DR+CD123++圈出pDC(Chung et al,2005)。新鲜分离的mDC中度表达CD40和CD86,低表达CD80;pDC同样中度表达CD40,而低表达CD80和CD86。它们都处于未成熟状态,不表达CD83。利用CD40L刺激后的mDC和pDC均能上调共刺激分子表达并增强刺激T细胞增殖的能力(Coates et al,2003)。除了经典表面抗原外,人血液中DC还表达一类特殊的表面抗原,即血液树突状细胞抗原(blood denritic cells antigen,BDCA)。该类抗原共有4个,其中BDCA-1(CD1c)和BDCA-3(CD141)表达在mDC的两类亚群上;而BDCA-2(CD303)和BDCA-4(CD304)均表达在pDC上。人BDCA单克隆抗体中,只有CD1c与印度恒河猴DC细胞表面抗原交叉反应。值得注意的是,人CD11c+mDC也表达CD1c,而印度恒河猴CD11c+mDC不表达CD1c(Brown & Barratt-Boyes,2009),表明印度恒河猴中CD1c+mDC是区别于常规CD11c+mDC的另一mDC亚群。本实验室鉴定了中国恒河猴CD1c+mDC,初步研究发现这群细胞低度表达CD80和CD83,中度表达CD86和HLA-DR,LPS刺激后均显著上调(待发表)。
2.2 皮肤/黏膜中的LC
LC通常分布在表皮或黏膜中,特异性地表达C型凝集素Langerin(CD207)。LC可以直接从皮肤单个细胞悬液中通过圈定HLA-DR阳性细胞而确定。除了HLA-DR,LC还高表达CD1a,但不表达CD83。与mDC类似,LC也检测不到CD80表达,但有中等丰度CD86的表达。皮肤/黏膜中的LC处于一种非成熟状态,表达高水平的CCR5,而缺乏CCR7和CXCR4。LC也能通过CD40L刺激成熟,成熟后CD1a下调并成为CD83阳性细胞。与此同时,成熟后的LC上调了共刺激分子CD80和CD86,高表达CCR7而低表达CCR5(Zimmer et al,2002)。
2.3 淋巴结中的DC
淋巴结是产生免疫应答的重要场所。淋巴结中以T淋巴细胞为主,夹杂着其它免疫细胞,包括DC。早期研究中,恒河猴淋巴结DC通过其突起中的p55而被标记(Koopman et al,2001)。其后在引流淋巴结细胞中发现了大约0.5%的CD20-CD83+成熟并指状DC(interdigitating DC,IDC)(Zimmer et al,2002)。随后,Brown et al(2007)采用血液DC标记方法鉴定淋巴结中的DC亚群,发现恒河猴腋窝淋巴结(axillary lymph node)中的DC同样是Lin-HLA-DR+表型。根据HLA-DR表达的强弱将这群DC分为高中低三类。HLA-DR高、中表达的DC都是CD11c+mDC。不同的是Lin-HLA-DRhighDC处于成熟状态,不但高表达CD83和共刺激分子,还高表达CD1a。由于血液中的mDC不表达CD1a,表明Lin-HLA-DRhighDC是表皮来源的DC(如LC)迁移到了淋巴结中。Lin-HLA-DRmodDC则呈现未成熟状态,不表达CD83、CD80,它们很可能是淋巴结常驻DC。另一群Lin-HLA-DRlowDC则大多是CD123+pDC,也处于未成熟状态,仅中度表达CD40,与血液中的pDC一致。在恒河猴肠系膜淋巴结(mesenteric lymph node)中,其DC亚群分类方式与腋窝淋巴结中相同,高表达HLA-DR的mDC处于成熟状态,而低表达HLA-DR的pDC处于未成熟状态。这两个部位不同之处在于肠系膜淋巴结中的Lin-HLA-DRhighDC不表达CD1a,这表明表皮来源的DC只迁移到浅表淋巴结中。
3 DC亚群在SIV/印度恒河猴动物模型疾病进程中的作用
目前普遍使用的SIV/印度恒河猴AIDS动物模型具有致病性高和病程快的特点,是研究AIDS发病机制的最常用动物模型。大部分DC亚群研究结果来自于SIV/印度恒河猴AIDS动物模型。
3.1 DC亚群通过顺式或反式感染促进了SIV在印度恒河猴体内的传播
3.1.1 顺式感染传播 顺式感染(cis-infection)即产出型感染,是病毒通过在细胞内大量复制产生新的病毒颗粒,从而感染其它细胞的过程。DC亚群大都表达CD4和CCR5,是SIV的靶细胞。通过对阴道黏膜接种SIV感染恒河猴的研究发现,SIVmac251接种后60 min之内即可看到SIV进入阴道黏膜,此时感染SIV的LC占到了感染细胞的90%以上。接种后18 h左右,在引流淋巴结(draining lymph node)中可检测到感染的上皮内LC(Hu et al,2000)。接种后48~72 h,恒河猴子宫颈阴道的固有层(lamina propria)中产出型感染细胞主要包括了黏膜下层DC、T细胞和巨噬细胞(Spira et al,1996)。由此可见,在性传播途径中,LC是最早接触到HIV并被感染的免疫细胞。在恒河猴肠黏膜下层中,病毒产出型DC共表达DC-SIGN和DECTIN-1 mRNA,表明DC-SIGN+DC为SIV感染的靶细胞(Choi et al,2003)。Brown et al(2009)直接分选出SIV感染14 d后恒河猴淋巴结中的mDC和pDC并检测了其SIV前病毒,发现pDC整合SIV DNA的细胞比例超过4%,还略高于CD4+T细胞,但mDC中则几乎没有检测到整合的前病毒。这可能是在感染过程中,SIV对DC亚群具有选择性,或者是不同的DC亚群抑制SIV感染的能力有所不同。
3.1.2 反式感染传播 C型凝集素是DC表面获取SIV的分子, DC通过它吞噬并降解SIV和抗原递呈,但少量SIV却能逃逸出来,并利用DC进行传播,这个途径被称为反式感染(trans-infection)。DC-SIGN就是DC传播HIV/SIV的一个重要分子。DC-SIGN+DC广泛分布在恒河猴的PP结(Peyer’s patch)、阴道和直肠等组织黏膜中,DC-SIGN抗体可以阻断SIV在恒河猴体内的传播(Jameson et al,2002)。不过,血液中的mDC和pDC都不表达DC-SIGN,但Wu et al(2002)报道猴慢病毒也可通过非DC-SIGN的途径进行传播。
顺式感染与反式感染是SIV利用DC的正常生命周期(life cycle)加快自身传播的有效途径。SIV除了直接感染DC外,还可以结合DC表面的C型凝集素,随DC迁移到淋巴结中,然后通过感染性突触促进SIV感染T细胞(图1)(Kavanagh & Bhardwaj,2002)。
3.2 AIDS进程中DC亚群活化和成熟功能逐渐受损

图 1 SIV利用DC的传播(修改自Kavanagh & Bhardwaj,2002)Fig 1 SIV dissemination using DC subsets (Modified from Kavanagh & Bhardwaj,2002)
DC依靠其表面分子发挥基本功能。AIDS的疾病进程中,HIV通过调节DC表面分子的表达使得DC功能受损,最终导致调控免疫应答作用的改变。DC在免疫应答中最重要的表面分子包括成熟标志CD83,以及共刺激分子CD40、CD80和CD86。通常情况下,这4个表面分子标示着DC的活化程度及其抗原递呈能力。通过AIDS模型恒河猴和正常恒河猴的比较发现,前者血液中mDC表型并无变化,而pDC的CD40表达略有增加,说明此时血液中DC还是未成熟DC。在AIDS模型猴外周淋巴结中,mDC缺乏CD83,但仍保持CD40以及低水平的CD80、CD86的表达,表型与正常猴的HLAmodDC相一致,这表明淋巴结中主要缺乏成熟的皮肤来源mDC。pDC各表型则没有明显的改变(Brown et al,2007)。LC无论在急性期还是AIDS期都没有表型上的改变,仍高表达HLA-DR和CD1a,缺乏CD83表达。引流淋巴结中的IDC在急性期会活化,但到了AIDS期则显著低表达CD40和CD83(Zimmer et al,2002)。动物实验表明,相对于pDC,mDC是引起获得性免疫的关键细胞。AIDS期淋巴结中mDC多呈现未成熟表型,活化程度低,不能引起针对于病毒的免疫反应,相反还会诱导产生耐受型T细胞,引起免疫耐受。基于mDC在体内免疫功能缺陷,可以通过体外培养单核细胞来源的DC(MDDC),使其递呈SIV相关蛋白,然后刺激成熟后回输恒河猴体内,从而提高针对SIV免疫反应的强度。Lu et al(2003)利用AT-2灭活的SIV颗粒刺激体外培养的MDDC并将其回输SIVmac251感染的中国恒河猴体内,有效地提高了针对SIV特异性T细胞反应。因此,DC疫苗研究成为AIDS免疫预防和免疫治疗领域中新的热点,并可能有广泛的临床应用前景(Liu et al,2006)。本实验室也开展了基因重组DC疫苗的相关研究(Wang et al,2008),并在体外成功培养出中国恒河猴的MDDC(Xia et al,2009)。
3.3 致病性SIV感染导致血液和淋巴结中DC亚群数量减少
在正常状态下,血液中的DC亚群维持一个比较稳定的数量,但病毒感染后这种平衡会被打破。在SIVmac251攻毒3—6 d,pDC数量显著增多,最多可达到正常水平的7倍左右,表明pDC被大量动员起来以应对病毒。接下来在10—14 d里,pDC数量显著降低,其后就一直维持在该值附近。pDC数量与病毒载量呈显著负相关,而与CD4+T淋巴细胞呈显著正相关(Brown et al,2009)。另一项SIVmac239感染印度恒河猴的研究显示,感染后pDC在PBMC中的比例即呈现下降趋势,2 w后达到最低水平,并在其后的80 w时间里维持这个低水平比例。pDC比例与病毒载量呈负相关,但与CD4+T淋巴细胞比例没有相关性(Reeves & Fultz,2007)。SIVsm感染印度恒河猴后,mDC和pDC都在感染后10—15 d上升到最高,然后在几天内降低到一个低水平并维持着(Koopman et al,2004)。这几项研究表明,在急性感染期,血液中mDC和pDC都会显著减少。DC亚群减少机制是多样的,体外实验证实HIV颗粒能够刺激mDC和pDC活化并成熟,上调趋化因子促使DC迁移到淋巴结中。不同研究证实在SIV急性感染期,以LC为代表的mDC会在淋巴组织中聚集增多,该结果与人HIV急性感染相一致(Zimmer et al,2002)。这表明迁移是导致血液mDC数量减少的重要原因。不过,pDC在血液和淋巴结中都会大量减少。Brown等(2009)以SIVmac251感染14 d的印度恒河猴为模型,研究了在急性感染期内pDC数量减少的机制。静脉注射病毒14 d后,pDC在骨髓中仍保持正常水平,它们不断地从骨髓中被动员到血液里,并且随即涌入到淋巴结中。淋巴结中的pDC被SIV感染或凋亡的比例都增加了2—3倍,凋亡分子CD95+pDC更是达到75%以上。结果表明,感染14 d后pDC仍能正常发育产生,并动员迁移到淋巴结,只是在淋巴结中pDC与SIV或感染的CD4+T淋巴细胞频繁接触,使其被剔除(凋亡或感染致死)的速度远远超过了更新的速度,因此导致整体上pDC的数量大大减少。在急性感染期,SIV感染对mDC和pDC数量的影响不同,SIV通过促进mDC和pDC迁移到淋巴结,但会选择性地在淋巴结大量剔除pDC。这种现象可能是由DC亚群在感染中的不同角色所导致的。在体外实验中,mDC会通过反式感染传播HIV到T细胞,不过pDC却能通过其分泌的IFN-α以及其他细胞因子直接抑制HIV在T细胞中的复制(Groot et al,2006)。
在AIDS期,不仅血液中mDC和pDC的数量会减少,而且在众多淋巴组织,包括腋下淋巴结、肠系膜淋巴结和脾脏,mDC和pDC的数量都会有66.7%~80%的减少(Brown et al,2007)。这种减少的机制除了迁移和被剔除以外,还可能与骨髓中DC前体产出减少有关。Thiebot et al(2005)报道指出,AIDS恒河猴骨髓中有抑制现象,并且其造血功能的紊乱导致了CD4+T淋巴细胞难以从CD34+细胞分化而来。AIDS期DC数量的全面减少是恒河猴终于发病的重要原因之一。
DC亚群数量的维持有助于控制疾病快速进展,可通过注射佐剂诱导前体细胞分化成为DC亚群来维持DC数量。Progenipoietins-1(ProGP-1)是Flt3受体和G-CSF受体激动剂的嵌合蛋白。用ProGP-1处理过的SIVsm感染恒河猴会显著增加了mDC和pDC的数量,并相应增加了CD4+和CD8+T细胞数量(Koopman et al,2004)。除ProGP-1外,Flt3配体也可以有效地动员DC分化,从而提高血液中DC亚群的数量(mDC约7倍,pDC约4倍)(Coates et al,2003)。因此,适时地注入Flt3配体可能会有助于减缓疾病的进展。但是过早地提高DC亚群数量并不一定有助于疾病进程的控制,因为在感染后7 d内,DC亚群数量本身就会在病毒刺激之下显著提高,并且从我们实验室正在进行的研究来看,所选择的实验猴mDC数量过高似乎会加快病程进展。需要进一步的实验来优化投药的时间范围,从而达到控制疾病进程的作用。
3.4 AIDS进程中DC所处微环境影响了DC迁移
DC在获取抗原后需迁徙到淋巴结进行抗原加工递呈,不同的DC亚群表达不同趋化因子受体,以使其按所需途径迁移。CCL20/MIP3α促使未成熟DC表达CCR6而被引导到皮肤和黏膜等外周组织,而CCL19/MIP3β和CCL21/6Ckine 则促使成熟DC上调CCR7而进入引流淋巴结。LC成熟的标志之一就是其CCR5被CCR7所替换,尽管SIV感染2 w后LC可以正常水平迁徙出皮肤,但在AIDS期则仅有不到10%的LC能够迁徙出。然而,从AIDS期分离出的LC在体外仍能被CD40L刺激成熟并上调CCR7,说明LC成熟和迁徙的能力并未受到损伤,只是皮肤和淋巴管中的细胞因子和趋化因子微环境抑制了LC的迁徙。鉴于AIDS模型猴中淋巴结IL-10 mRNA表达增高,而IL-10能直接抑制DC的功能,因此AIDS中IL-10表达增加很可能抑制了LC的迁徙(Barratt-Boyes et al,2002;Zimmer et al,2002)。在许多人和恒河猴DC疫苗研究中也发现,大多数负载抗原的MDDC通过皮肤回输后仍然聚集在注射的位点,不能有效地迁移到淋巴结中,证实了感染后MDDC所处的微环境抑制了MDDC的迁移,故直接在淋巴结组织中进行疫苗回输似乎更为有效(Brown,2003)。
3.5 DC亚群选择性分泌细胞因子应对SIV感染
DC可以通过自身分泌细胞因子来调控免疫应答。DC亚群表面的TLR分子,可识别外来抗原并调控细胞因子的分泌。mDC特异性表达TLR3来识别病毒双链RNA,而pDC则表达TLR7识别病毒单链RNA,TLR9识别非甲基化的DNA CpG模体(motif)。利用TLR3配体poly(I:C)可刺激mDC分泌IL-12,而通过TLR9的配体CpG DNA则能刺激pDC分泌IFN-α。IL-12和IFN-α在体内都具有广泛的免疫效应,尤其是IFN-α不但可直接抑制病毒复制,而且能活化大部分免疫细胞。pDC是主要的IFN-α分泌细胞,大约占90%以上的IFN-α+细胞。在急性感染期,恒河猴体内pDC保留了大部分针对TLR7刺激的正常功能,IFN-α+pDC比例与正常猴无显著差异,不过TNF-α+pDC的比例则大大低于正常猴(Brown et al,2009)。其它DC亚群细胞因子的研究相对较少。由于缺乏IL-12和IFN-α在整个病程中的变化趋势,无法了解DC亚群在疾病进程中扮演的角色。针对这种现状,本实验正在开展DC亚群在整个病程中细胞因子分泌的研究。
4 DC亚群在其他SIV/灵长类动物模型疾病进程中的作用
4.1 早期适时免疫抑制减缓食蟹猴疾病进程
食蟹猴(crab-eating macaque)也是一种常用的AIDS模型动物。食蟹猴的mDC表达CD11c偏低,故mDC主要亚群用CD1c+mDC来代表。SIVmac251慢性感染食蟹猴的血液中CD1c+mDC数量高于正常猴,而pDC则略低于正常猴(Malleret et al,2008)。SIVmac251攻毒后,食蟹猴血液中pDC数量在7 d内出现短暂升高,然后在9—14 d急速降低。高剂量病毒组出现pDC数量下降的时间早于低剂量组,随后pDC会逐渐增加,在第3个月达到略低于正常值的水平并维持着;但在淋巴结中,pDC数量在感染后38 d,甚至9个月显著增加,表明pDC能迁移到淋巴结中,且不会被大量剔除。同时,通过对I型干扰素(IFN-I)的研究发现,IFN-I浓度与病毒载量呈正相关,说明病毒可促使pDC产生IFN-I;但其血浆中IFN-I浓度与免疫抑制相关酶IDO和调节性FoxP3+CD8+T细胞呈正相关,表明机体针对IFN-I适时地启动了免疫抑制,从而避免免疫应答的过度活化(Malleret et al,2008)。食蟹猴体内pDC不同于SIVmac251感染印度恒河猴pDC大量剔除的现象,很可能就是机体适应免疫抑制的结果。值得注意的是,相对于印度恒河猴,SIVmac251对食蟹猴的致病性较弱,故食蟹猴在感染2 w内会产生更强烈的病毒特异性细胞免疫应答。强烈的免疫应答加上适时的免疫抑制是食蟹猴在感染后病程缓慢的关键因素。
4.2 pDC数量变化预示着非洲绿猴的疾病进程
非洲绿猴(African green monkey)是SIVagm的天然宿主,其感染始终处于不发病状态。SIVagm感染非洲绿猴后,血液中pDC尽管会在1 w内降到最低值,但在后期会恢复到正常值附近并呈波动状态。有趣的是,非洲绿猴pDC的数量在慢性感染期间与CD4+T淋巴细胞数量呈正相关,而仅在第1 周会与病毒载量呈显著负相关(Diop et al,2008)。通过比较发现,当pDC与病毒载量长期呈负相关时,动物模型一般都将快速发病,如SIVmac感染的恒河猴;而处于慢性感染的非洲绿猴和食蟹猴则不具备这种长期的相关性,但与CD4+T淋巴细胞却呈正相关(Reeves et al,2007;Diop et al,2008;Malleret et al,2008; Brown et al,2009)。
4.3 IFN-α分泌缺陷导致乌黑白眉猴疾病不进展
乌黑白眉猴(sooty mangabey)是SIVsm的天然宿主,感染后也呈长期带毒但不发病状态。Mandl et al(2008)通过比较乌黑白眉猴与恒河猴pDC之间的差异发现了导致AIDS进程差异的可能原因。SIVsm感染的恒河猴在急性感染期,pDC受到病毒刺激后大量分泌IFN-α。IFN-α可刺激mDC和pDC上调CCR7,同时活化成熟;但是乌黑白眉猴感染SIVsm后却缺乏IFN-α的分泌,使得其体内的mDC和pDC仍保持未成熟状态而不活化和迁移。这种对病毒的不敏感反而使得乌黑白眉猴抑制了AIDS进展。深入地研究发现,乌黑白眉猴pDC之所以产生少量IFN-α,是因为其TLR7和TLR9信号通路中共用的干扰素调控因子7(interferon regulatory factor-7,IRF-7)出现了突变(Mandl et al,2008)。这表明免疫活化会促进AIDS进程,而IFN-α正好是免疫活化最关键的细胞因子(图2)。最近在HIV感染者性别差异研究中也证实,女性的pDC针对TLR7配体产生的IFN-α显著多于男性,从而使得女性免疫活化程度更高,AIDS进程更快(Meier et al,2009)。通过药物阻断病毒所引起的IFN-α产生,也许是抗病毒治疗的另外一种选择。
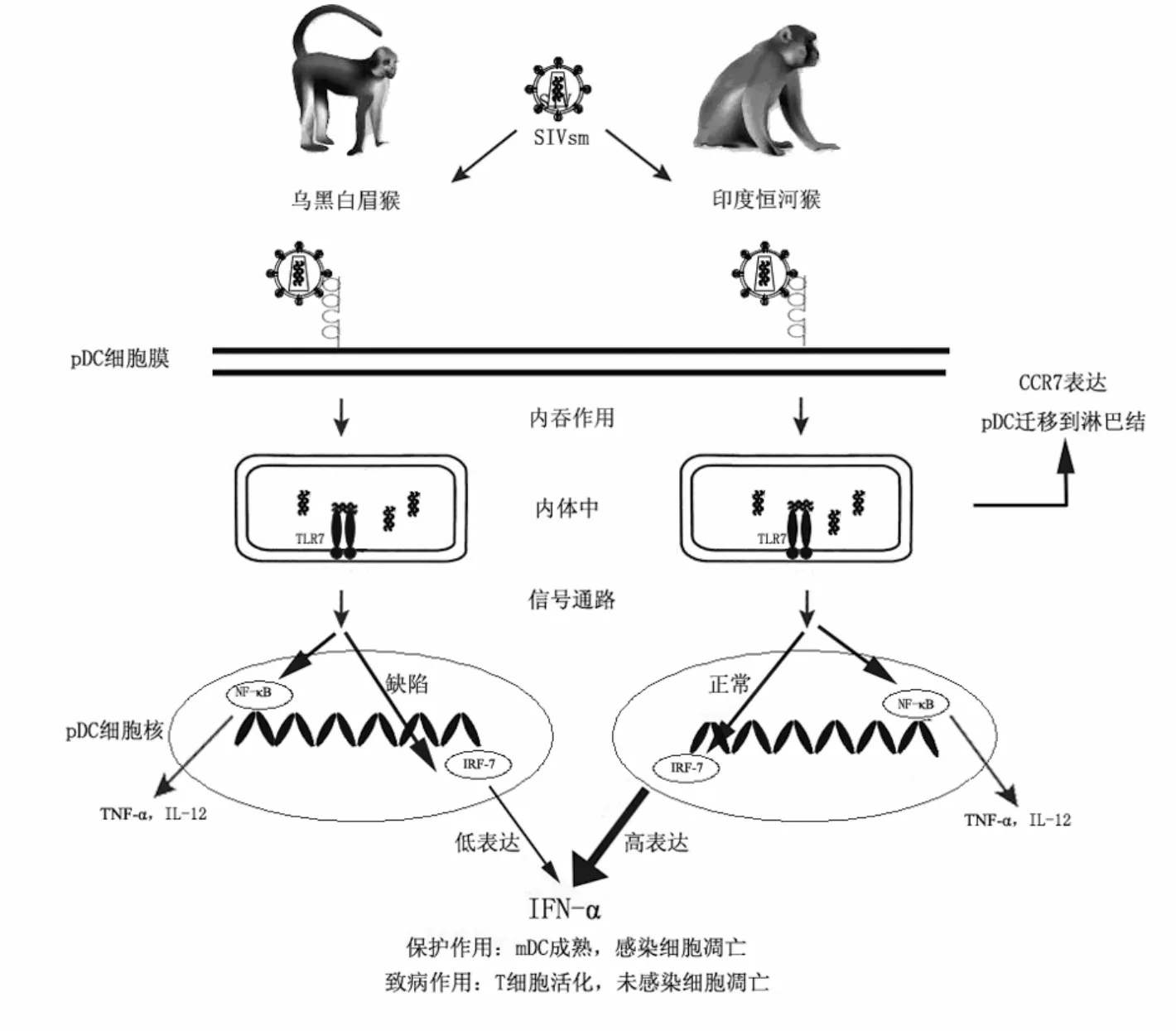
图 2 IFN-α在SIV感染的乌黑白眉猴与印度恒河猴中的不同表达(Mandl et al,2008)Fig 2 Differential expression of IFN-α by sooty mangabeys and Indian rhesus macaques in SIV infection (Mandl et al,2008)
5 结 语
通过研究DC亚群在非人灵长类AIDS动物模型疾病进程中的作用,发现影响AIDS进程的机制是相当复杂的。DC亚群参与了HIV感染的每一个过程,并显著地影响了AIDS进程。在感染早期,DC能正常地行使其抗原获取并加工递呈以及分泌细胞因子的功能。但这些应对HIV的策略却反被HIV加以利用,使得DC成为免疫活化、病毒传播的帮凶。随着病程的不断进展,不但大量DC被剔除,而且其功能也发生了紊乱,最终使得机体无法抵抗外来病原体的侵入而致病。一旦DC亚群能够恢复到正常水平,则机体与病毒就能长期共存,呈现慢性感染状态。利用不同的动物模型可以发现其DC亚群的数量及功能上存在很大的差异。动物之间在病毒感染期间不同的免疫状态,是决定AIDS进程的重要因素。然而,现阶段DC方面的研究还存在以下几个问题:一是在AIDS灵长类动物模型中相关的DC研究还比较少,尤其缺乏以中国恒河猴为模型动物的研究。SIV感染的中国恒河猴与印度恒河猴在疾病进展中有很大的不同,SIV/中国恒河猴的发病进程更接近于人的AIDS过程(Ling et al,2002)。二是DC在发病机制中的作用需要更深入的研究,如DC亚群在HIV感染中是否发挥不同的作用,这种作用是有益的还是有害的。我们实验室已成功构建了SIV和SHIV感染的中国恒河猴动物模型,并在体外成功培养、鉴定了单核细胞来源的中国恒河猴DC(Xia et al,2009),目前正在以SIVmac239和SHIV89.6分别感染的中国恒河猴动物模型为平台,观察感染早期外周血中DC亚群的数量和表型变化。通过poly(I:C)和CpG DNA刺激PBMC来观察DC亚群的功能变化,在此基础上分析DC亚群各指标与病毒载量以及CD4+T淋巴细胞的相关性,希望能为AIDS发病机制的研究提供新的思路。
Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, Pulendran B, Palucka K. 2000. Immunobiology of dendritic cells [J]. Annu Rev Immunol,36: 767-811.
Barratt-Boyes SM, Zimmer MI, Harshyne L. 2002. Changes in dendritic cell migration and activation during SIV infection suggest a role in initial viral spread and eventual immunosuppression [J]. J Med Primatol,31(4-5): 186-193.
Barron MA, Blyveis N, Palmer BE, MaWhinney S, Wilson CC. 2003. Influence of plasma viremia on defects in number and immunophenotype of blood dendritic cell subsets in human immunodeficiency virus 1-infected individuals [J]. J Infect Dis,187(1): 26–37.
Brown KN, Barratt-Boyes SM. 2009. Surface phenotype and rapid quantification of blood dendritic cell subsets in the rhesus macaque [J]. J Med Primatol,38(4): 272-278.
Brown K, Gao WT, Alber S, Trichel A, Murphey-Corb M, Watkins SC, Gambotto A, Barratt-Boyes SM. 2003. Adenovirus-transduced dendritic cells injected into skin or lymph node prime potent simian immunodeficiency virus-specific T cell immunity in monkeys [J]. J Immunol,171(12): 6875-6882.
Brown KN, Trichel A, Barratt-Boyes SM. 2007. Parallel loss of myeloid and plasmacytoid dendritic cells from blood and lymphoid tissue in simian AIDS [J]. J Immunol,178(11): 6958-6967.
Brown KN, Wijewardana V, Liu X, Barratt-Boyes SM. 2009. Rapid influx and death of plasmacytoid dendritic cells in lymph nodes mediate depletion in acute simian immunodeficiency virus infection [J]. PLoS Pathog,5(5).
Choi YK, Whelton KM, Mlechick B, Murphey-Corb MA, Reinhart TA. 2003. Productive infection of dendritic cells by simian immunodeficiency virus in macaque intestinal tissues [J]. J Pathol,201(4): 616-628.
Chung E, Amrute SB, Abel K, Gupta G, Wang YC, Miller CJ, Fitzgerald-Bocarsly P. 2005. Characterization of virus-responsive plasmacytoid dendritic cells in the rhesus macaque [J]. Clin Diagn Lab Immunol,12(3): 426-435.
Coates PT, Barratt-Boyes SM, Zhang LY, Donnenberg VS, O'Connell PJ, Logar AJ, Duncan FJ, Murphey-Corb M, Donnenberg AD, Morelli AE, Maliszewski CR, Thomson AW. 2003. Dendritic cell subsets in blood and lymphoid tissue of rhesus monkeys and their mobilization with Flt3 ligand [J]. Blood,102(7): 2513-2521.
Diop OM, Ploquin MJ, Mortara L, Faye A, Jacquelin B, Kunkel D, Lebon P, Butor C, Hosmalin A, Barré-Sinoussi F, Müller-Trutwin MC. 2008. Plasmacytoid dendritic cell dynamics andαinterferon production during Simian immunodeficiency virus infection with a nonpathogenic outcome [J]. J Virol,82(11): 5145-5152.
Groot F, van Capel TM, Kapsenberg ML, Berkhout B, de Jong EC. 2006. Opposing roles of blood myeloid and plasmacytoid dendritic cells in HIV-1 infection of T cells: transmission facilitation versus replication inhibition [J]. Blood,108(6): 1957-64.
Hu JJ, Gardner MB, Miller CJ. 2000. Simian immunodeficiency virus rapidly penetrates the cervicovaginal mucosa after intravaginal inoculation and infects intraepithelial dendritic cells [J]. J Virol,74(13): 6087-6095.
Jameson B, Baribaud F, Pöhlmann S, Ghavimi D, Mortari F, Doms RW, Iwasaki A. 2002. Expression of DC-SIGN by dendritic cells of intestinal and genital mucosae in humans and rhesus macaques [J]. J Virol,76(4): 1866-1875.
Kavanagh DG, Bhardwaj N. 2002. A division of labor: DC subsets and HIV receptor diversity [J]. Nat Immunol,3(10): 891-893.
Koopman G, Dalgleish AG, Bhogal BS, Haaksma AG, Heeney JL. 2001. Changes in dendritic cell subsets in the lymph nodes of rhesus macaques after application of glucocorticoids [J]. Hum Immunol,62(3): 208-214.
Koopman G, Niphuis H, Haaksma AG, Farese AM, Casey DB, Kahn LE, Mann D, MacVittie TJ, Woulfe SL, Heeney JL. 2004. Increase in plasmacytoid and myeloid dendritic cells by progenipoietin-1, a chimeric Flt-3 and G-CSF receptor agonist, in SIV-Infected rhesus macaques [J]. Hum Immunol,65(4): 303-316.
Li MH, He ZY, Zheng YT. 2005. The scapegoat of human AIDS research: Non-human primate models [J]. Chn J Nat,27(4): 208-212. [李明华,何昭阳,郑永唐. 2005.人类AIDS的研究替身——非人灵长类动物模型.自然杂志,27(4): 208-212.]
Li MH, Zhang GH, Sun T, Zheng YT. 2007. The value of nonhuman primate animal models in anti-HIV drugs studies [J]. Chn J New Drugs,16(16): 1237-1242. [李明华,张高红,孙 涛,郑永唐. 2007.灵长类动物模型在抗HIV药物研究中的应用.中国新药杂志,16(16): 1237-1242.]
Ling BH, Veazey RS, Luckay A, Penedo C, Xu KY, Lifson JD, Marx PA. 2002. SIV(mac) pathogenesis in rhesus macaques of Chinese and Indian origin compared with primary HIV infections in humans [J]. AIDS,16(11): 1489-1496.
Liu HL, Xia HJ, Zheng YT. 2006. Application of dendritic cells in anti-HIV infection immunoprophylaxis and immunotherapy [J]. Chn J Cell Mol Immunol,22(5): 686-688. [刘红亮,夏厚军,郑永唐. 2006.树突状细胞在抗HIV-1感染免疫预防与治疗中的应用.细胞与分子免疫学杂志,22(5): 686-688.]
Liu YJ. 2001. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity [J]. Cell,106(3): 259-262.
Lu W, Wu XX, Lu YZ, Guo WZ, Andrieu JM. 2003. Therapeutic dendritic-cell vaccine for simian AIDS [J]. Nat Med,9(1): 27-32.
Malleret B, Karlsson I, Manéglier B, Brochard P, Delache B, Andrieu T, Muller-Trutwin M, Beaumont T, McCune JM, Banchereau J, Le Grand R, Vaslin B. 2008. Effect of SIVmac infection on plasmacytoid and CD1c+myeloid dendritic cells in cynomolgus macaques [J]. Immunology,124(2): 223-233.
Malleret B, Manéglier B, Karlsson I, Lebon P, Nascimbeni M, Perié L, Brochard P, Delache B, Calvo J, Andrieu T, Spreux-Varoquaux O, Hosmalin A, Le Grand R, Vaslin B. 2008. Primary infection with simian immunodeficiency virus: plasmacytoid dendritic cell homing to lymph nodes, type I interferon, and immune suppression [J]. Blood,112(12): 4598-4608.
Mandl JN, Barry AP, Vanderford TH, Kozyr N, Chavan R, Klucking S, Barrat FJ, Coffman RL, Staprans SI, Feinberg MB. 2008. Divergent TLR7 and TLR9 signaling and type I interferon production distinguish pathogenic and nonpathogenic AIDS virus infections [J]. Nat Med,14(10): 1077-1087.
Meier A, Chang JJ, Chan ES, Pollard RB, Sidhu HK, Kulkarni S, Wen TF, Lindsay RJ, Orellana L, Mildvan D, Bazner S, Streeck H, Alter G, Lifson JD, Carrington M, Bosch RJ, Robbins GK, Altfeld M. 2009. Sex differences in the Toll-like receptor-mediated response of plasmacytoid dendritic cells to HIV-1 [J]. Nat Med,15(8): 955-959.
Pacanowski J, Kahi S, Baillet M, Lebon P, Deveau C, Goujard C, Meyer L, Oksenhendler E, Sinet M, Hosmalin A. 2001. Reduced blood CD123+(lymphoid) and CD11c+(myeloid) dendritic cell numbers in primary HIV-1 infection [J]. Blood,98(10): 3016-3021.
Reeves RK, Fultz PN. 2007. Disparate effects of acute and chronic infection with SIVmac239 or SHIV-89.6P on macaque plasmacytoid dendritic cells [J]. Virology,365(2): 356-368.
Shattock RJ, Moore JP. 2003. Inhibiting sexual transmission of HIV-1infection [J]. Nat Rev Microbiol,1(1): 25-34.
Shortman K, Liu YJ. 2002. Mouse and human dendritic cell subtypes [J]. Nat Rev Immunol,2(3): 151-161.
Shortman K, Naik SH. 2007. Steady-state and inflammatory dendritic-cell development [J]. Nat Rev Immunol,7(1): 19-30.
Spira AI, Marx PA, Patterson BK, Mahoney J, Koup RA, Wolinsky SM, Ho DD. 1996. Cellular targets of infection and route of viral dissemination after an intravaginal inoculation of simian immunodeficiency virus into rhesus macaques [J]. J Exp Med,183(1): 215-225.
Steinman RM, Cohn ZA. 1973. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution [J]. J Exp Med,137(5): 1142-1162.
Teleshova N, Jones J, Kenney J, Purcell J, Bohm R, Gettie A, Pope M. 2004. Short-term Flt3L treatment effectively mobilizes functional macaque dendritic cells [J]. J Leukoc Biol,75(6): 1102-1110.
Thiebot H, Vaslin B, Derdouch S, Bertho JM, Mouthon F, Prost S, Gras G, Ducouret P, Dormont D, Le Grand R. 2005. Impact of bone marrow hematopoiesis failure on T-cell generation during pathogenic simian immunodeficiency virus infection in macaques [J]. Blood,105(6): 2403-2409.
Wang L, Bai X, Liu HL, Zhang GH, Zheng YT. 2009. Construction ofreplication-deficient recombinant adenoviruses containing HIV-1 tat gene and its expression in 293 cells [J]. Immunol J,25(2): 168-172. [王路,白 雪,刘红亮,张高红,郑永唐. 2009.重组腺病毒载体vAd-tat的构建及其在细胞中的表达.免疫学杂志,25(2): 168-172]
Wu L, Bashirova AA, Martin TD, Villamide L, Mehlhop E, Chertov AO, Unutmaz D, Pope M, Carrington M, KewalRamani VN. 2002. Rhesus macaque dendritic cells efficiently transmit primate lentiviruses independently of DC-SIGN [J]. Proc Natl Acad Sci USA,99(3): 1568-1573.
Xia HJ, Liu HL, Zhang GH, Zheng YT. 2009. Phenotype and function of myeloid dendritic cells derived from Chinese rhesus macaque blood monocytes [J]. Cell Mol Immunol,6(3): 159-165.
Zhang GH, Li MH, Zheng YT. 2007. Application of AIDS macaque animal model in HIV vaccine research [J]. Zool Res,28(5): 556-562. [张高红,李明华,郑永唐. 2007. AIDS猕猴模型在HIV疫苗研究中的应用.动物学研究,28(5): 556-562.]
Zimmer MI, Larregina AT, Castillo CM, Capuano S 3rd, Falo LD Jr, Murphey-Corb M, Reinhart TA, Barratt-Boyes SM. 2002. Disrupted homeostasis of Langerhans cells and interdigitating dendritic cells in monkeys with AIDS [J]. Blood,99(8): 2859-2868.
Roles of Dendritic Cell in Disease Progression of AIDS Primate Models
XIA Hou-JUN1,2, ZHANG Gao-Hong1, ZHENG Yong-Tang1,*
(1. Key Laboratory of Animal Models and Human Disease Mechanisms of the Chinese Academy of Sciences & Yunnan Province, Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China; 2. Graduate School of the Chinese Academy of Sciences, Beijing 100039, China)
Non-human primate models are widely used in research of AIDS mechanism, transmission, vaccine and drugs. Dendritic cells (DC), as antigen presenting cells linking the innate immunity and acquired immunity, play a pivotal role in AIDS progression. Studies on the change of DC subsets number, phenotype and function in AIDS non-human primate models are important for revealing some mechanism of AIDS progression. This article reviews the progress in DC subsets of non-human primate AIDS models, which will provide an avenue for further study in AIDS.
AIDS; Human immunodeficiency virus; Simian immunodeficiency virus; Dendritic cells; Primate; Animal models
R512.91; Q95-33;Q959.848
A
0254-5853-(2010)01-0057-09
10.3724/SP.J.1141.2010.01057
2009-07-27;接受日期:2009-09-07
国家重点基础研究发展计划“973”(2006CB504208);国家科技重大专项“十一五”计划(2008ZX10001-002, 2008ZX10001-015, 2008ZX10005-005, 2009ZX09501-029);中国科学院知识创新工程重要方向(KSCX1-YW-R-15, KSCX2-YW-R-092);国家自然科学基金(30471605,30872317,30800113);“西部之光”资助课题
*通讯作者(
),Tel/Fax:0871-5195684, E-mail:zhengyt@mail.kiz.ac.cn
book=64,ebook=274
