βCaM KII蛋白修饰转基因小鼠工作记忆的研究
2010-12-19曾庆文曹晓华
殷 亮, 曾庆文, 杜 丹, 曹晓华
(华东师范大学上海市脑功能基因组学教育部重点实验室,上海 200062)
βCaM KII蛋白修饰转基因小鼠工作记忆的研究
殷 亮, 曾庆文, 杜 丹, 曹晓华
(华东师范大学上海市脑功能基因组学教育部重点实验室,上海 200062)
利用前额叶脑区过量表达β钙离子/钙调素依赖的蛋白激酶II(βCaM KII)的蛋白修饰转基因小鼠,研究βCaM KII对小鼠工作记忆的影响.Western Blo t结果显示,转基因小鼠前额叶脑区的βCaM KII过量表达.在修饰的水迷宫实验中,与对照组相比,转基因小鼠的逃避潜伏期没有发生明显变化.此外,在T迷宫实验中,转基因小鼠的正确率与对照组的正确率也基本相同.由此推测,βCaM KII的过量表达对于前额叶皮层依赖的工作记忆没有明显的影响.
工作记忆; β钙离子/钙调素依赖的蛋白激酶Ⅱ; 前额叶
0 引 言
学习和记忆作为脑的高级功能之一,对于动物与人类的生存极为重要.大量的研究表明,前额叶皮层在人和啮齿类动物的工作记忆[1,2]、情绪记忆[3]、注意力调节[4,5]和行为抑制[6,7]中起着重要作用.NMDA受体在神经回路的形成及学习记忆过程中起着重要的作用,是影响前额叶皮层功能的一类重要的兴奋性离子通道[8].CaM KII是NMDA受体的一个重要下游分子,当NMDA受体通道开放时,大量Ca2+内流入神经元突触后膜,激活与NMDA受体中NR2B亚基胞内端相互作用的CaM KII[9],从而调节突触可塑性和学习与记忆能力.
CaM KII有四种亚基,分别为α,β,δ和γ,脑中表达的CaM KII由α和β两种亚基组成[10].近年来有大量关于α亚基与学习记忆作用的研究[11,12],而对β亚基作用的研究较少.有研究表明,α和β亚基的比例决定了CaM KII全酶的生化功能[13].2007年M in等研究认为β亚基在海马齿状回过量表达会降低小鼠的突触可塑性并影响记忆的巩固过程[14].为了探讨β亚基对前额叶皮层依赖的工作记忆的作用,本文利用βCaM KII-F90G蛋白修饰转基因小鼠,进行了T迷宫和改良的水迷宫[15]任务测试,以检测上调βCaM KII对工作记忆的影响.
1 材料与方法
1.1 实验小鼠
从美国普林斯顿大学引进的前脑区βCaM KII-F90G蛋白修饰转基因C57/B6小鼠,该转基因小鼠使用αCaM KII启动子,使外源修饰过的βCaM KII-F90G可在前脑表达.外源表达的βCaM KII-F90G可在与 A TP绑定位点结合后被特异性抑制,其功能与内源性βCaM KII相同,而药物NM-PP1不会影响内源性βCaM KII的活性[14].将βCaM KII-F90G蛋白修饰转基因C57/B6小鼠与普通C57/B6小鼠杂交繁殖后,用鼠尾DNA基因型检测方法鉴定出转基因小鼠(Tg).在华东师范大学脑功能基因组学研究所实验中心饲养.每笼3~6只,自由进食、饮水,自动光控(间隔12 h,昼夜交替).室温(22±2)℃,相对湿度50%~60%.行为学实验小鼠为3月龄,雄性,所有实验均在9:00~18:00完成.
1.2 主要设备
高速冷冻离心机(Beckman);台式冷冻离心机(Eppendo rf);SDS-PA GE凝胶电泳仪(Biorad);Bio-Rad凝胶成像仪;恒温摇床等.小鼠自发活动开场实验观察箱及其追踪分析系统购买自美国Coubourn Instruments公司.小鼠水迷宫及其追踪分析系统购买自美国Coubourn Instruments公司.
1.3 方法
1.3.1 突触小体蛋白的提取
方法参照GRA YE等[16],选取6月龄转基因及同窝野生型小鼠各15只,快速断头,按小鼠脑图谱标示,冰上迅速取出前额叶皮层,保存于液氮中.取样品,在4m L A溶液(5 mmol/L Hepes,320 mmol/L蔗糖,p H 7.4)中用匀浆器充分研磨至均匀.将匀浆液转入50 m L离心管,加A溶液至10 mL,4℃,3 000 r/min离心5 min,得沉淀P1和上清液S1.吸取S1置冰上.在沉淀P1中加4m L A溶液重悬,4℃,3 000 r/min离心5 m in,得沉淀P1’和上清液S1’.弃沉淀,将S1’与S1合并,于4℃,10 000 r/min离心20 min,得沉淀P2.将P2重悬于2~3 m L A溶液中.将重悬液缓缓加至Ficoll密度梯度离心液(用A溶液配制,质量体积比为上层7.5%,下层12%)上层.4℃,24 600 r/min高速离心1 h.离心后得到分层溶液,中间层即为突触蛋白.小心吸出,加5 mL Kreb溶液(145 mmol/L NaCl,5 mmol/L KCl,1.2 mmol/L M gCl2·6H2O,1.2 mmo l/L NaH2PO4·2H2O,10 mmol/L葡萄糖, 20 mmol/L Hepes,使用前加入 CaCl2至终浓度为1.2 mmol/L),4℃,10 000 r/min离心20 min.沉淀重悬于裂解液(25 mmol/L Hepes,p H 7.4,10 mmol/L M gCl2,0.5 mmol/L DTT,0.5 mmol/L EGTA,0.5 mmol/L EDTA,1 mmol/L PM SF)备用.
1.3.2 蛋白质印迹(Western Blot)
BCA法测定样品总蛋白浓度,样品液中加入5×蛋白上样缓冲液(购自碧云天公司). 100℃煮沸5 min使蛋白质变性.配制SDS变性聚丙烯酰胺凝胶(8%分离胶和5%浓缩胶),每孔上样30μg,100 V恒压电泳2 h.使用NC膜4℃,100 V恒压转膜45 m in.室温下将膜用5%脱脂奶粉-TBST(25 mmo l/L Tris,140 mmol/L NaCl,3 mmol/L KCl,0.05%Tw een-20)封闭1 h;TBST洗3次,每次5 min.加一抗稀释液(1∶2 000,购于美国Zymed公司), 4℃孵育过夜;TBST洗3次,每次5 m in.辣根过氧化物酶(HRP)标记二抗室温孵育NC膜1 h,TBST洗3次,每次5 min.化学发光法显影(显影试剂购自博齐科技有限公司),用Bio-Rad凝胶成像仪拍摄后作光密度值分析.
1.3.3 开场实验(Open field)
将小鼠放入四周透明的开放场箱中心,应用美国Coubourn Instruments公司 True scan开场实验追踪分析系统记录活动总时间(s),记录15 min.每只实验结束后用75%的酒精将箱底及四壁清理干净,去除前一只小鼠的气味,以避免气味干扰.
1.3.4 T迷宫实验(T-maze) T迷宫是检测啮齿类动物空间工作记忆的一种经典行为学方法,与前额叶皮层功能相关.小鼠节食至原体重85%.训练前,抚摸小鼠并将其放入T迷宫适应10 min,在迷宫两臂碗里放入食物,待小鼠取食完毕后将其取出.
训练实验 每一个trial包括两个部分:forced run和test run.forced run小鼠只能随机进入一臂获取食物.取食完毕,立即取出.用酒精清洗去除气味.Test run两臂全部打开,将小鼠放入开始臂中,若小鼠选择未曾进入的臂,为正确选择,给予食物奖励;若重复进入相同的臂,则为错误选择,不给予食物.每天进行4个trial,取平均值作一次统计,2 d为1个block,分别计算转基因与野生型小鼠的正确率.当平均正确率都达到85%以上,训练阶段结束.
测试实验 延长forced run和test run之间的时间间隔至1 min和3 min,分别计算转基因与野生型小鼠的正确率.所有实验都在小鼠基因型未知的条件下进行.
1.3.5 水迷宫工作记忆测试 (Water maze)
实验历时4 d,每天训练4个trial.平台的位置每天变化,位于不同象限中.在1 d 4个trial的训练中,平台位置保持不变.小鼠随机选择4个入水点入水.记录小鼠寻找并爬上平台所需时间,即逃避潜伏期.如在60 s内未找到平台,将其引至平台,逃避潜伏期记为60 s;小鼠在平台上停留20 s.所有实验都是在小鼠基因型未知的条件下进行.
1.4 统计分析
组间比较采用One-w ay ANOVA s进行检验,P<0.05为显著性差异.数据均采用mean ±S.E.M表示.
2 结 果
2.1 蛋白质印迹(Western Blot)结果
实验结果用光密度值做分析,管家蛋白β-actin OD值分别为:转基因6 796.7± 1 036.8,野生型7 780±160.9;βCaM KII蛋白OD值分别为:转基因13 800±500,野生型9 880±477.9.以管家蛋白为内参,比值分别为:转基因1.923±0.28;野生型1.14±0.13.两者有显著性差异(见图1,F(1,6)=6.443,P<0.05).蛋白质印迹实验结果表明βCaM KIIF90G蛋白修饰转基因小鼠前额叶突触上βCaM KII蛋白相对于野生型小鼠是过量表达的.
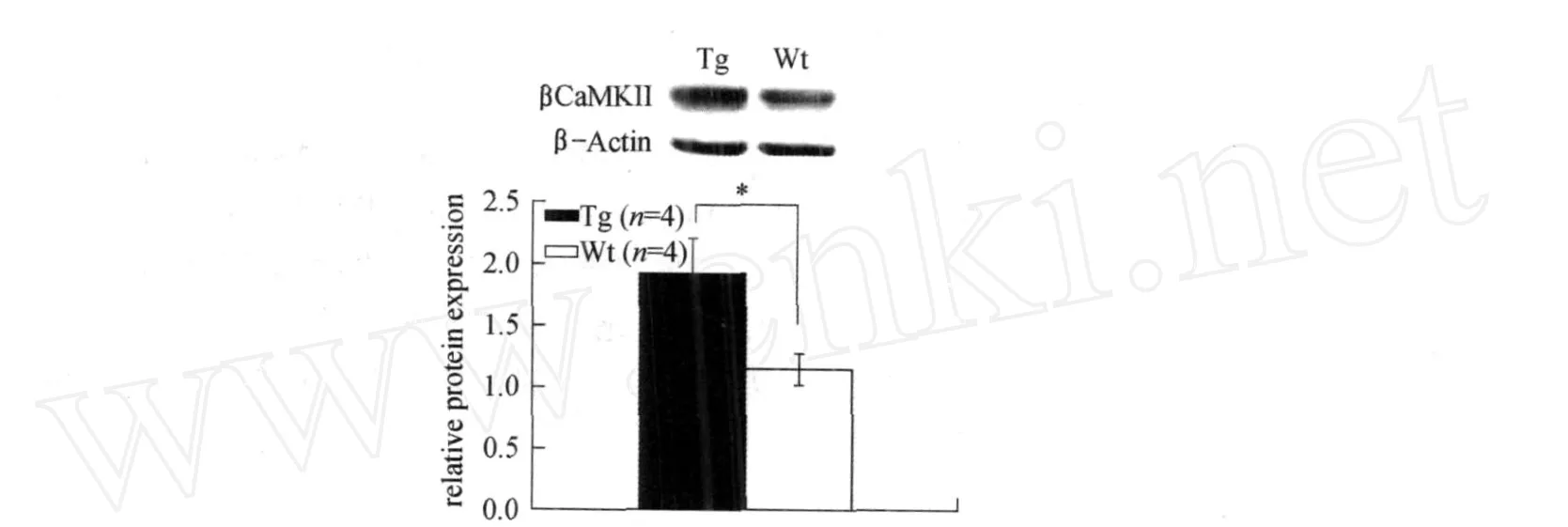
图1 Western Blotting中,βCAM KII在前额叶脑区的表达量Fig.1 Exp ression ofβCAM KIIin p refrontal co rtex
2.2 开场实验结果
开场实验所测指标为在开场中的活动时间,将小鼠分别放入实验测试箱中,记录15 min,结果显示:两组鼠的活动时间没有显著差异(见图2,Tg 607.13±14.560,Control 609.18±13.38,F(1,31)=0.011,P>0.05).数据表明,βCaM KII在前额叶的过量表达对小鼠的活动量和探索能力没有产生影响.

图2 βCAM KII上调对小鼠活动量的影响Fig.2 The effect ofβCAM KIIoverexp ression on locomotor activity
2.3 T迷宫实验结果
训练实验 βCaM KII转基因组和野生型组的学习曲线同步上升,没有明显差异(见图3).说明βCaM KII过量表达对小鼠T迷宫学习能力没有影响.
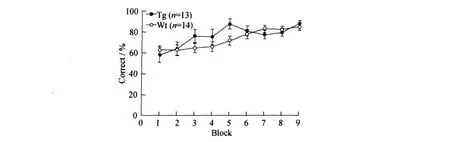
图3 βCAM KII上调对小鼠T迷宫学习过程的影响Fig.3 The effect ofβCAM KIIoverexp ression during the learning p rocess in T maze
测试实验 当两组学习正确率都超过85%后进行延迟非匹配性实验测试.延迟间隔为1 min和3 min,βCaM KII-F90G蛋白修饰转基因小鼠在1 min和3 min的延迟间隔测试的正确率与野生型小鼠相比都没有显著差异(见图4).提示前额叶过量表达βCaM KII对前额叶依赖性的工作记忆能力没有影响.
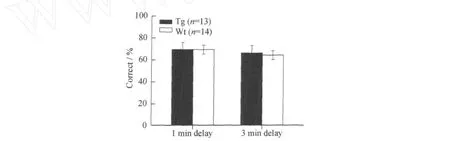
图4 βCAM KII上调对小鼠空间工作记忆的影响Fig.4 The effect ofβCAM KIIoverexp ression on spatial working memory in T maze
2.4 水迷宫实验结果
统计每个trial 4 d的平均逃避潜伏期.第二个trial的平均逃避潜伏期反映小鼠工作记忆能力,第三个trial和第四个trial的平均逃避潜伏期反映空间参考记忆能力.
实验结果显示(见图 5),第二个 trial(Tg 38.95±2.09,W t 38.75±2.24,F(1,31)= 0.004,P>0.05)、第三个 trial(Tg 40.76±2.86,W t 41.58±2.16,F(1,31)=0.053,P> 0.05)和第四个 trial(Tg 30.89±3.26,W t 27.48±2.00,F(1,31)=0.816,P>0.05) βCaM KII-F90G蛋白修饰转基因小鼠的平均逃避潜伏期与野生型小鼠无显著性差异.表明βCaM KII-F90G蛋白修饰转基因小鼠的前额叶相关性工作记忆能力没有发生变化.提示前额叶皮层过量表达βCaM KII对前额叶依赖性的工作记忆能力没有影响.
3 讨 论
前脑包括皮层、海马和纹状体等结构,与高级认知功能有密切联系.其中前额叶皮层与短时程的工作记忆密切相关,而海马区与长时程学习记忆能力相关[1,2].学习记忆能力又与突触可塑性的强弱有着紧密的关系[17].

图5 水迷宫实验,βCAM KII上调对小鼠逃避潜伏期的影响Fig.5 The effect ofβCAM KIIoverexp ression on latency in water maze
NMDA受体是一类配体电压门控通道.其功能的强弱与突触可塑性以及学习记忆能力有着密切的关系,CaM KII与NR2B亚基的互相作用可以调节NMDA受体的活性[9].依此推测,CaM KII表达量的变化可能会影响NMDA受体的活性,进而影响小鼠的神经元突触可塑性和学习记忆能力.AM PA受体的上下膜是突触可塑性的重要机制[18,19],CaM KII在调节神经元突触后膜AM PA受体的上下膜的过程中起到了重要的作用.综上所述,研究CaM KII的功能对小鼠学习与记忆的影响有着重要意义.
已有实验表明αCaM KII的改变会影响学习与记忆能力,在海马中αCaM KII的过量表达会抹除小鼠的恐惧记忆[20],在前额叶中αCaM KII的过量表达会使与学习记忆相关的长时程抑制现象降低[21].而αCaM KII的286位氨基酸发生突变时,海马和皮层中的L TP现象都会被抑制[22,23].另有研究表明βCaM KII在海马齿状回区过量表达会降低小鼠的神经元的突触可塑性,并且会抑制小鼠恐惧记忆的形成[14].已有实验证明脑中CaM KII的α和β亚基的比例决定了CaM KII全酶的磷酸化效率,野生型小鼠中α和β的比例约为3∶1,α亚基的数量占多数,所以对于αCaM KII有大量的研究.上调αCaM KII,使α和β亚基的比例变大,可改变CaM KII全酶的磷酸化效率[13].本文将βCaM KII上调,研究βCaM KII对工作记忆能力的影响.
T迷宫非匹配延缓任务实验中,转基因小鼠与野生对照组小鼠学习寻找食物的正确率同步增加,并且检测时在相同的间隔时间的正确率也无显著性差异,说明βCaM KII的过量表达并没有影响βCaM KII-F90G蛋白修饰转基因小鼠的工作记忆能力.
在修饰的水迷宫实验中,βCaM KII-F90G蛋白修饰转基因小鼠在训练中反应小鼠工作记忆能力的平均逃避潜伏期与反应小鼠参考记忆能力的平均逃避潜伏期均与野生对照型小鼠处于同一水平,说明βCaM KII的过量表达并没有影响到βCaM KII-F90G蛋白修饰转基因小鼠的短期的学习与记忆能力.
本研究表明过量表达βCaM KII不影响前额叶皮层依赖的工作记忆能力,而M in等人研究过量表达βCaM KII影响海马依赖的条件恐惧记忆.说明βCaM KII在前额叶皮层脑区并没有与在海马DG区中起到相同的作用.有研究显示,在皮层和海马区相同的分子,如αCaM KII也表现了不同的作用.αCaM KII在海马中过量表达使长时程增强现象显著性的增大[20],而在前额叶皮层中过量表达αCaM KII,转基因小鼠长时程增强现象与野生型并无差异[21].不同的脑区相同分子有着不同的作用,使得对学习记忆机制的研究更加复杂.本研究中βCaM KII-F90G蛋白修饰转基因小鼠前额叶皮层βCaM KII过量表达量远远不及在海马DG区的过量表达量,对CaM KII的α和β亚基比例的改变影响较少,这可能是βCaM KIIF90G蛋白修饰转基因小鼠前额叶皮层依赖的工作记忆能力没有发生变化的原因之一.有关前额叶皮层中βCaM KII在学习记忆中的作用,还需进一步的研究.
[1] FUKUNAGA K,MULLER D,OHM ITSU M,et al.Decreased p rotein phosphatase 2A activity in hippocampal long-term potentiation[J].J Neurochem,2000,74(2):807-817.
[2] BANNERMAN D M,GOOD M A,BU TCHER SP,et al.Distinct componentsof spatial learning revealed by prior training and NMDA recep to r blockade[J].Nature,1995,378(6553):182-186.
[3] KAWABE K,ICH ITAN I Y,IWASA KI T.Effects of intrahippocampal AP5 treatment on radial-arm maze performance in rats[J].Brain Res,1998,781(1-2):300-306.
[4] CU IZ,WANG H,TAN Y,et al.Inducible and reversible NR1 knockout reveals crucial roleof the NMDA recepto r in p reserving remote memo ries in the brain[J].Neuron,2000,41(5):781-793.
[5] LU W,MAN H,JU W,et al.Activation of synaptic NMDA receptors inducesmembrane insertion of new AMPA recep tors and L TP in cultured hippocampal neurons[J].Neuron,2001,29(1):243-254
[6] ZHAO M G,TOYODA H,LEE Y S,et al.Roles of NMDA NR2B subtype receptor in p refrontal long-term potentiation and contextual fear memo ry[J].Neuron,2005,47(6):859-872.
[7] NA KAZAWA K,SUN L D,QU IRK M C,et al.Hippocampal CA3 NMDA receptors are crucial formemory acquisition of one-time experience[J].Neuron,2003,38(2):305-315.
[8] BL ISS T V,COLL INGRIDGE G L.A synap ticmodel of memory:long-term potentiation in the hippocampus[J]. Nature,1993,361(6407):31-39.
[9] ZHOU Y,TA KAHASHIE,L IW,et al.Interactions between the NR2B receptor and CaM KIImodulate synaptic plasticity and spatial learning[J].J Neurosci,2007,27(50):13843-13853.
[10] L ISMAN J,SCHULMAN H,CL INE H.The molecular basis of CaM KII function in synap tic and behavioural memo ry[J].Nat Rev Neurosci,2002,3(3):175-190.
[11] MA YFORD M,WANG J,KANDEL E R,et al.CaM KII regulates the frequency-response function of hippocampal synapses fo r the p roduction of both L TD and L TP[J].Cell,1995,81(6):891-904.
[12] FRANKLAND PW,O’BRIEN C,OHNO M,et al.Alpha-CaM KII-dependent plasticity in the cortex is required for permanentmemory[J].Nature,2001,411(6835):309-313.
[13] SHEN K,TERUEL M N,CONNOR J H,et al.Molecular memory by reversible translocation of calcium/calmodulin-dependent p rotein kinase II[J].Nat Neurosci,2000,3(9):881-886.
[14] CHO M H,CAO X,WANG D,et al.Dentate gyrus-specific manipulation of beta-Ca2+/calmodulin-dependent kinase II disrup tsmemo ry consolidation[J].Proc Natl Acad Sci USA,2007,104(41):16317-16322.
[15] DUDCHENKO P A.An overview of the tasks used to test working memory in rodents[J].Neurosci Biobehav Rev,2004,28(7):699-709.
[16] HESTRIN S.Activation and desensitization of glutamate-activated channelsmediating fast excitato ry synap tic currents in the visual cortex[J].Neuron,1992,9(5):991-999.
[17] L ISMAN J.A mechanism for the Hebb and the anti-Hebb p rocesses underlying learning and memo ry[J].Proc Natl Acad Sci USA,1989,86(23):9574-9578.
[18] PONCER JC,ESTEBAN JA,MAL INOW R.M ultiplemechanisms for the potentiation of AMPA receptor-mediated transmission by alpha-Ca2+/calmodulin-dependent p rotein kinase II[J].J Neurosci,2002,22(11):4406-4411.
[19] HA YASH I Y,SH IS H,ESTEBAN J A,et al.Driving AMPA recep tors into synapses by LTPand CaM KII:requirement for GluR1 and PDZ domain interaction[J].Science,2000,287(5461):2262-2267.
[20] WANG H,SH IM IZU E,TANG Y P,et al.Inducible p rotein knockout reveals temporal requirement of CaM KII reactivation for memory consolidation in the brain[J].Proc Natl Acad Sci USA,2003,100(7):4287-4292.
[21] WEIF,WANG G D,ZHANG C,et al.Fo rebrain overexp ression of CaM KIIabolishes cingulate long term dep ression and reducesmechanical allodynia and thermal hyperalgesia[J].Mol Pain,2006(2):21.
[22] SILVA A J,STEVENSC F,TONEGAWA S,et al.Deficient hippocampal long-term potentiation in alpha-calcium-calmodulin kinase IImutant mice[J].Science,1992,257(5067):201-206.
[23] SILVA A J,PA YLOR R,WEHNER J M,et al.Impaired spatial learning in alpha-calcium-calmodulin kinase II mutant mice[J].Science,1992,257(5067):206-211.
Study ofβCaM KIIon working memory in protein modified transgen ic mice
YIN Liang, ZENG Qing-w en, DU Dan, CAO Xiao-hua
(KeyLaboratoriesofMOEandSTCSM,ShanghaiInstituteofBrainFunctionalGenomics, EastChinaNormalUniversity,Shanghai200062,China)
This experiment was designed to investigate the effect of theβCa2+/calmodulin-dependent p rotein kinases II(βCaM KII)on the working memory in mice.The result of Western Blot showed thatβCaM KIIwasoverexp ressed in the p refrontal co rtex in transgenic mice.There was no significance in escape latency between transgenic mice and controls in Morriswatermaze. In addition,the co rrect of transgenic mice in T-maze was also similar to that of controls.These results suppose that overexp ression of theβCaM KII has no significant effect on the p refrontal cortex-dependent wo rking memo ry in mice.
wo rking memory; βCa2+/calmodulin-dependent p rotein kinasesII; p refrontal cortex
Q6
A
1000-5641(2010)02-0119-08
2009-03
国家自然科学基金(30670682)
殷亮,男,硕士研究生.E-mail:yourfriendyl@163.com.
曹晓华,女,教授.E-mail:xhcao@brain.ecnu.edu.cn.
