槲皮素与铬(III)配合物合成及光谱分析
2010-12-12雷克林
雷克林
(襄樊学院 化学工程与食品科学学院,湖北 襄樊 441053)
槲皮素与铬(III)配合物合成及光谱分析
雷克林
(襄樊学院 化学工程与食品科学学院,湖北 襄樊 441053)
利用槲皮素与铬盐在无水乙醇中回流加热,用三乙醇胺调节 PH至中性得到产物. 合成配合物用红外光谱、紫外光谱对其结构进行表征,推测出螯合位置发生在槲皮素 3-羟基与 4-羰基及3',4'-羟基处. 并采用TU—1900双光束紫外可见分光光度计研究一系列不同浓度溶液的吸光度,通过摩尔比法确定Cr3+与槲皮素的配位比为1:1和2:1.
槲皮素;铬;配位比
槲皮素(Quercetin,Qu,3,5,7,3',4'-五羟基黄酮,3,5,7,3',4'-pentahydroxyflavone)广泛存在于植物界,是膳食中最常见的类黄酮化合物之一,具有较强的抗氧化性能. 槲皮素抗氧化作用的研究已引起国内外学者的高度重视. 槲皮素药理作用广泛,具有降血压、调血脂、扩张冠状动脉、抗血小板聚集、抗炎、抗过敏、抗氧自由基和抗心律失常等多种生物活性及药理作用[1]. 槲皮素对金属离子具有强烈的螯合作用[2-3]. 槲皮素与稀土及其它金属离子配位后,其抗氧化活性、抗癌活性和抗病毒活性均有所改变. 对于槲皮素与金属离子如 Al (III)、Fe(II)、Fe(III)、Cu(II)和Sn (II)等配合物的荧光光谱及其抗氧化活性等方面已有报道[4-9].
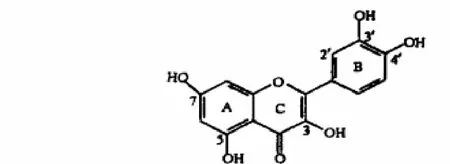
图1 槲皮素分子结构示意图
铬是生命必需的微量元素,Cr(III)具有维持机体正常的糖代谢和脂类代谢等作用,缺乏时会发生两种物质的代谢紊乱,形成高血脂症、糖尿病、动脉硬化性心脑血管等疾病. 文献[10]报道Cr(III)与槲皮素配合物的抗氧化性增强,但对于螯合机理和配位比报道尚未成熟.
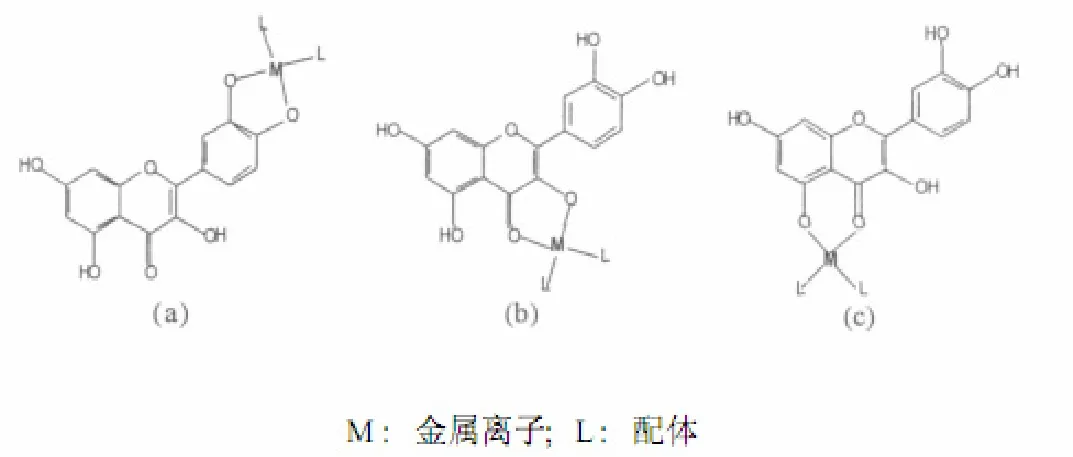
图2 槲皮素与金属配位的几种可能形式
争议较大的是螯合位置的选择,5-羟基与3- 羟基配位均有报道过. 从槲皮素的分子结构(图1)可以得知,分子上的一个羰基氧和五个羟基氧都能提供孤电子对,都具有一定的配位能力. 因此,多个氧原子与金属离子配位可能会有不同结果,见图 2,并影响槲皮素的金属配位活性及其生物活性功能.
槲皮素与过渡金属元素能形成多种金属配合物.大致可分为 3类[11-13]:①[M2L·(H2O)4]Cl2;②ML2·.nH2O(n=2或3);③ML3·6H2O. 因此配合物的分子结构也有3种模型(见图3).
本文采用紫外分光光度法研究了槲皮素与Cr形成配合物的配位条件、配位比、稳定常数,并初步探讨了它们的配位作用方式,提出了槲皮素Cr配合物的分子结构,为进一步研究其药理活性和寻找新型、高效、低毒的槲皮素配合物提供初步的实验依据.
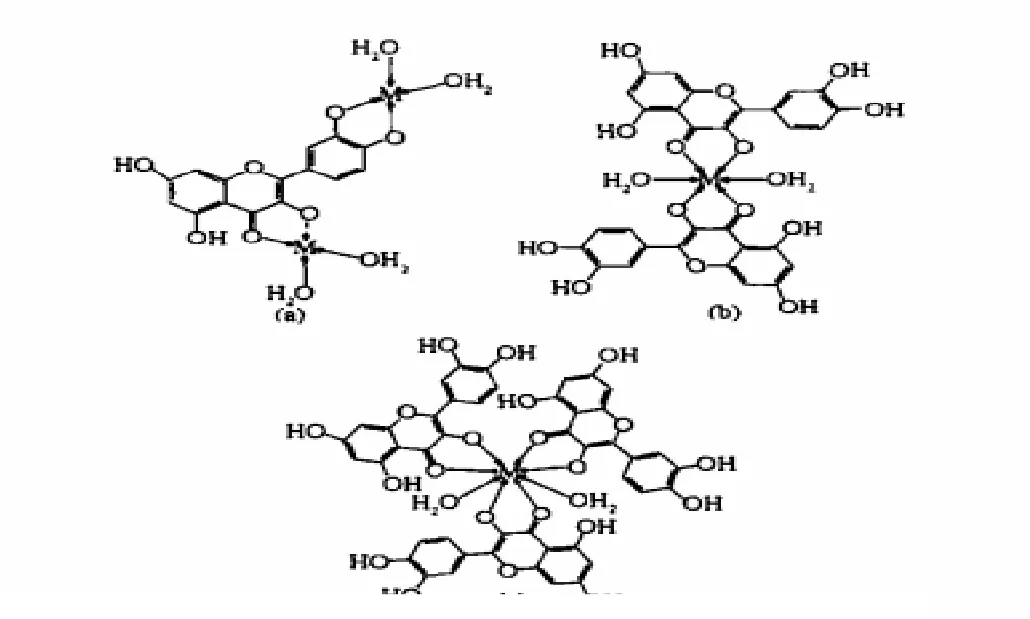
图3 槲皮素金属配合物的三种结构模型
1 实验部分
1.1 实验仪器与试剂
IRPrestige-21型红外光谱仪(日本岛津精密仪器公司);85-2A恒温磁力搅拌器(巩义市英峪予华仪器厂);DEF—6020型真空干燥箱(上海精宏实验设备有限公司);TU—1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);970CRT荧光分光光度仪(上海分析仪器).
槲皮素(生化试剂),国药集团化学试剂有限公司;三氯化铬,洛阳市化学试剂厂;硝酸铬,中国医药(集团)上海化学试剂公司;三乙醇胺,天津市化学试剂厂;无水乙醇,天津市天力化学试剂有限公司. 以上均为分析纯.
1.2 实验方法
1.2.1合成
槲皮素与氯化铬反应:将1.5g(约5.0mmol)槲皮素与30ml乙醇加入三颈烧瓶中,在60℃下加热回流90分钟,使其溶解. 将659mg(约2.48mmol)CrCl3·6H2O溶于少量乙醇后,加入上述三颈烧瓶中,在65℃下加热回流反应六个小时,缓慢滴加三乙醇胺,待溶液pH为7~8时,即有大量棕黄色沉淀生成,放置冷却至室温. 离心,分别用蒸馏水和95%乙醇洗涤,60℃真空干燥,即得棕黄色粉末状固体.
槲皮素与硝酸铬反应:将1g(约3.3mmol)槲皮素和0.66gCr(NO3)3·9H2O(1.6mmol)同上方法反应.
1.2.2红外光谱
在红外灯照射下,按照1:100比例添加固体产物与KBr,充分研磨后压片,进行红外光谱测定. 结果如图4—6.
1.2.3 紫外光谱
分别将槲皮素和产物溶于无水乙醇中,配制浓度为0.0002mol/L的溶液. 取两个50ml容量瓶,分别加入10ml槲皮素与产物溶液,定容,进行紫外光谱测定. 结果如图7、图8.
1.2.4 荧光光谱
用无水乙醇配制一系列不同浓度的槲皮素及配合物溶液,室温下扫描槲皮素及其铬配合物的荧光光谱.
1.2.5 摩尔比法
设铬离子和槲皮素的浓度分别为CM,CR,固定槲皮素的浓度,改变金属离子的浓度,可得到一系列CR/ CM值不同的溶液. 分别对各溶液进行光谱扫描得吸收曲线如图9. 在选定波长下测定各溶液的吸光度,以吸光度A对CR/CM作图得图10.
2 结果与讨论
2.1红外光谱分析

图4 槲皮素红外光图谱

图5 槲皮素与三氯化铬配合物红外图谱
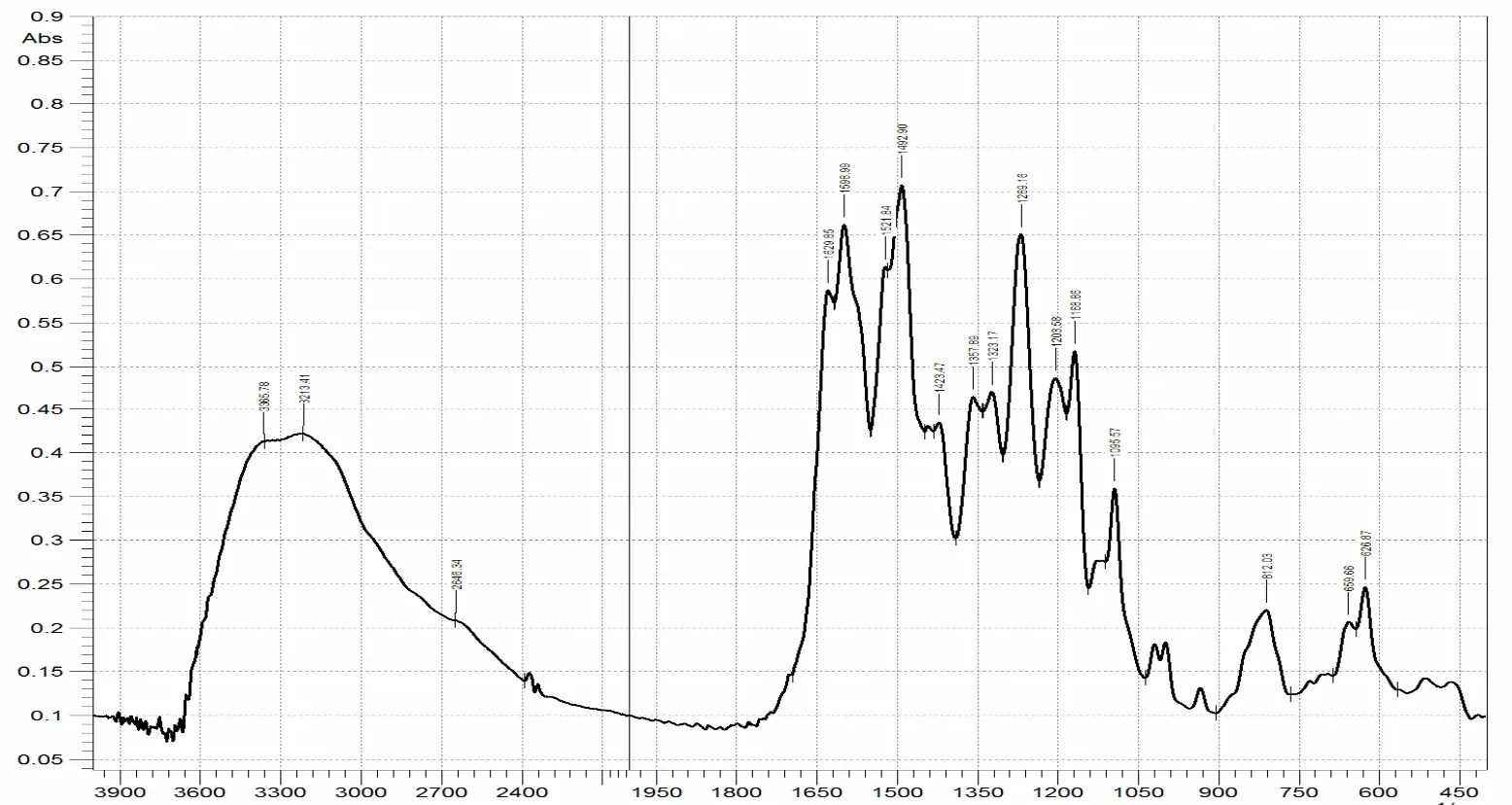
图6 槲皮素与硝酸铬反应配合物红外图谱
红外图谱及特征峰比较结果显示:1)槲皮素的羰基振动频率1662.64cm-1,两种槲皮素铬配合物羰基振动频率1622.13cm-1,1629.85cm-1,向低波数分别移动了40.51cm-1和32.79cm-1,可见槲皮素的4-羰基参与了配位;2)配合物苯环体系的V(C= C)为1598.99cm-1,相对于槲皮素的V(C=C)为1612cm-1向低波数方向移动了14cm-1. 共轭体系的延长,新环生成,影响苯环共轭体系;3)配合物和槲皮素的V(C-O-C)相比,变化较小,也表明了C环上的氧并未与金属离子发生作用;4)配合物在518.85cm–1、516.9cm-1出现了V(Cr-O),说明有金属配位键的生成;5)槲皮素邻羟基变角振动频率为右移,说明邻位羟基有参加配位;6)配合物中3-OH变角振动频率左移20cm-1,说明配合物中3-OH参加了配位.
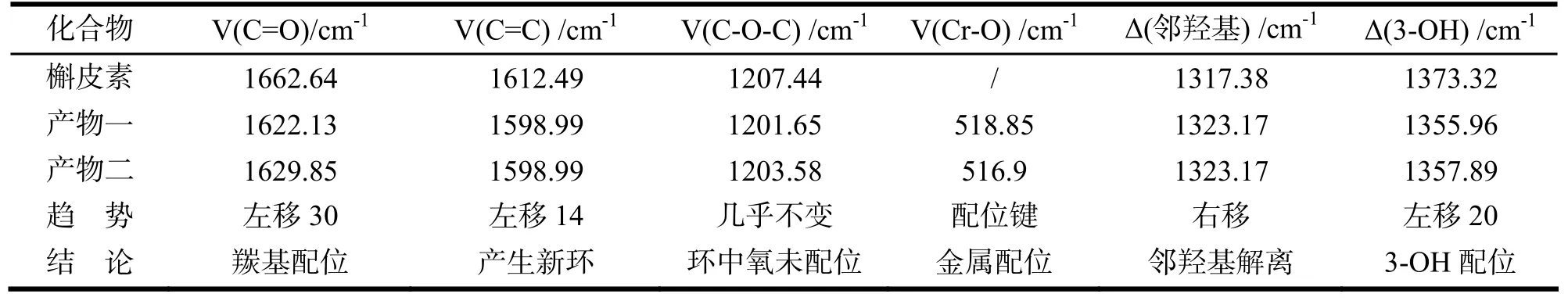
表1 槲皮素及其铬配合物红外光谱峰值比较
2.2 紫外光谱分析
槲皮素在255nm和375nm有两个吸收峰,如图7,分别属于π→π*(A环)电子跃迁和π→π*(B环)电子跃迁,分别对应两个生色团:255nm吸收带由苯甲酰色团产生,为Ⅰ带,375 nm吸收带由肉桂酰生色团产生,为Ⅱ带;其存在的羟基为酚羟基或烯醇式羟基,容易作为供体与 Cr(Ⅲ)形成配位. 从槲皮素铬配合物的UV-Vis数据可知,槲皮素与铬配合物在455nm处有吸收峰,如图8,吸收带Ⅱ红移了80cm-1而吸收带Ⅰ几乎没有红移,表明A环上的5-OH和7-OH不参与配位. 而B环上的3',4'-邻羟基可能与金属离子发生了配位作用. 不同部位的官能团配位能力大小为:3',4'-邻羟基 > 3-OH~4-CO > 5-OH~7-OH, 所以槲皮素金属配合物主要以构型a(见图3)存在. 从电子结构角度分析,5-OH不参与配位主要是由于它的质子酸性比3-OH低,并且当4-CO和3-OH配位后会对5-OH产生空间位阻效应.
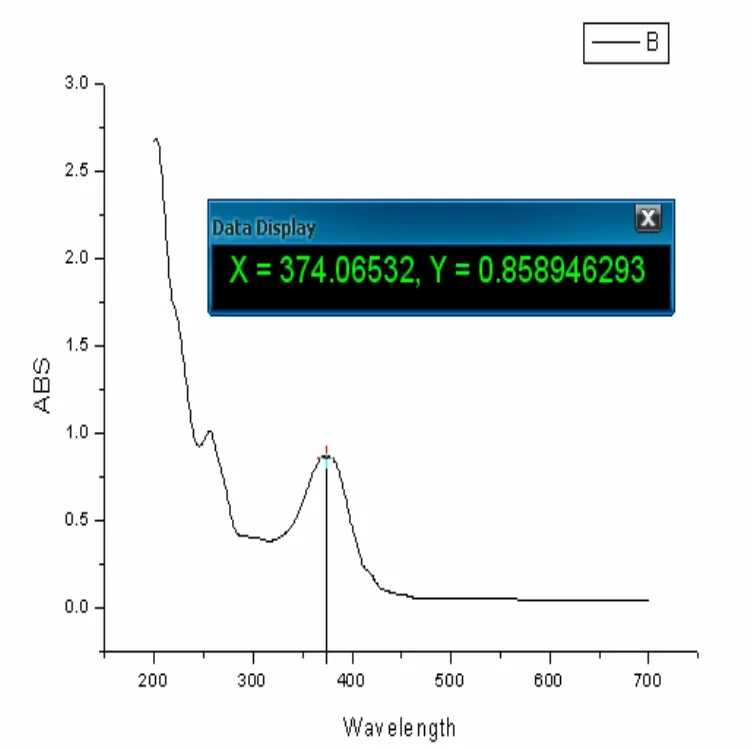
图7 槲皮素紫外光谱图
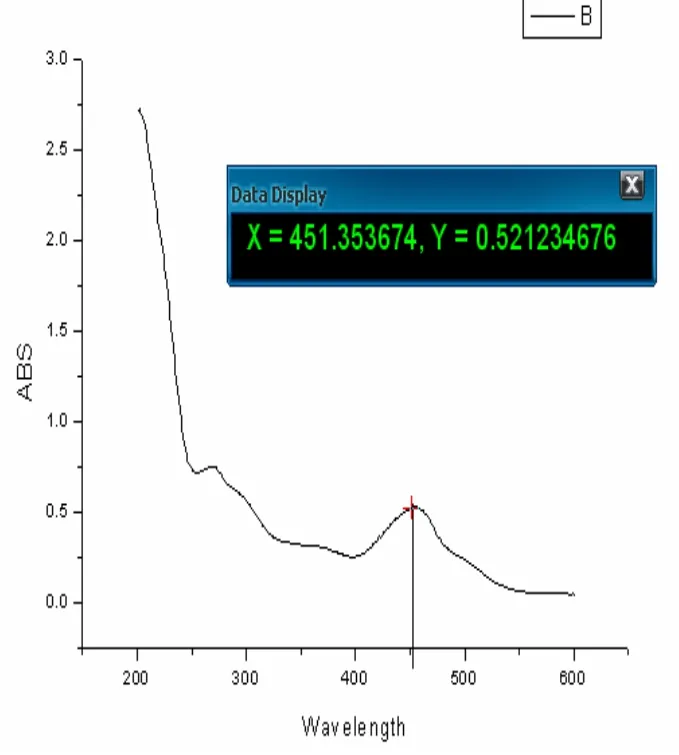
图8 配合物紫外光谱图
2.3 荧光光谱分析
槲皮素本身有微弱的荧光,其激发波长为500nm,发射波长为535nm. 槲皮素与铬形成配合物后使槲皮素原有荧光碎灭,其原因可能是槲皮素形成铬配合物后使其共轭体系增大,加速了能量之间的传递. 2.4摩尔比法测配位比
由图9可知,随着铬离子溶度的增加,反应溶液吸光度在375nm处的吸光度逐渐减少,而在455nm处逐渐增加. 当铬离子与槲皮素摩尔比小于1时,在413nm处有一个等吸收点. 表明两种物质在相互竞争,且生成一种螯合物. 最后,375nm处的吸收峰几乎消失,取而代之的是455nm处的吸收峰.

图9 不同摩尔比Cr3+与槲皮素螯合后溶液的吸收曲线
如图10当加入的配位体Qu还没有使Cr定量转化为Cr(Qu)n时,曲线处于近似直线阶段;当加入的金属离子Cr已使Qu定量转化为Cr(Qu)n并稍有了过量时,曲线便出现转折;加入的Cr继续过量,曲线便成水平直线. 转折点所对应的摩尔比数便是配合物的组成比. 结果表明,配合物在455nm处吸光度随摩尔比变化曲线转折点分别发生在摩尔比为1:1和2:1处,即(Cr): n(Qu)=1:1和(Cr): n(Qu)=2:1.说明Cr(III)与槲皮素的配比为1:1和2:1.
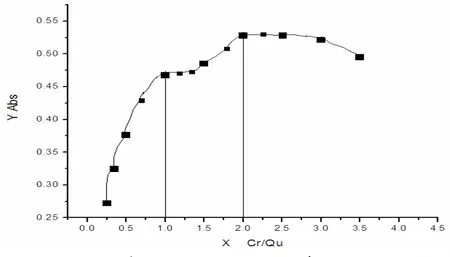
图10 配合物在455nm处吸光度随摩尔比变化曲线
3 结语
1) 本文分别用氯化铬和硝酸铬在无水乙醇中合成槲皮素与铬金属配合物,红外光谱分析得到几乎雷同光谱图,即配合物性质几乎完全相同.
2) 进行了红外光谱、紫外光谱、荧光光谱分析,可得知槲皮素为3-羟基、4-羰基和3',4'-邻羟基参与配位.
3) 通过摩尔比法测得配合物中Cr(Ⅲ)与槲皮素比值为1:1和2:1,结构如图11所示.

图 11 配合物结构
[1] 曹治权. 中药药效的物质基础和作用机理研究新思路: 中药中化学物种形态和生物活性关系的研究[J]. 上海中医药大学学报, 2000, 14(1): 36-40.
[2] 潭 君, 王伯初, 祝连彩. 槲皮素金属配合物的药理作用研究进展[J]. 中国药学, 2006, 44(22): 1688-1691.
[3] 苏俊峰, 郭长江. 食物黄酮槲皮素的抗氧化作用[J]. 解放军预防医学, 2001, 19(3): 229-237.
[4] 吴新建, 林素英, 李荣华. 槲皮素与3d-过渡金属二价离子的配位反应研究[J]. 福建师范大学学报, 2007, 23(6): 68-71.
[5] 林天乐, 严宝珍, 胡高飞. Al(Ⅲ)-槲皮素配合物的光谱分析[J]. 分析化学研究简报, 2008, 34(8): 1125-1128.
[6] 王齐明, 李 萍, 薛俊鹏, 等. 槲皮素与Cu2+和Al3+配位反应的紫外可见吸收光谱法研究[J]. 光散射学报, 2009, 21(2): 174-177.
[7] 杨 波, 许明录, 张裕平, 等. Zn-槲皮素螯合机理的紫外分光光度法研究[J]. 光谱实验室, 2009, 26(5): 1068-1072.
[8] 陈 翔, 童育鹏, 仇佩虹. 两种黄酮与硒配合物的合成及其结构分析[J]. 温州医学院学报, 2009, 39(1): 63-65.
[9] 蒋柳云, 刘玉明. 两种槲皮素配合物的抗氧化活性及其结构的量子化学研究[J]. 有机化学, 2005, 25(6): 684-689.
[10] 余燕影, 俞梅兰, 曹树稳. 槲皮素铬(III)配合物合成及清除自由基活性研究[J]. 食品科学, 2006, 27(10): 29-32.
[11] 赵 兵, 徐清海, 段丽颖. 国内黄酮金属配合物的研究进展[J]. 化学试剂, 2006, 28(3): 141-143.
[12] 刘玉法, 魏素梅. 槲皮素衍生物的研究进展[J]. 研发前沿, 2008, 16(17): 20-22.
[13] 周 晶, 王进义, 唐 宁. 槲皮素与金属Cd(Ⅱ), Sc(Ⅲ)配合物合成及抗氧性研究[J]. 兰州大学学报: 自然科学版, 2001, 37(1): 123-125.
Quercetin and Chromium (III) Complexes Synthesis and Spectral Analysis
LEI Ke-lin
(School of Chemical Engineering and Food Science, Xiangfan University, Xiangfan 441053, China)
In this paper, the quercetin and chromium salts were refluxed in anhydrous ethanol to be precipitated, with pH neutral adjusted with triethanolamine. Using infrared spectroscopy, ultraviolet spectroscopy to characterize the structure of the synthesized complex, it shows that the chelating position was in quercetin 3-hydroxyd and 4-carbonyl and 3', 4'-hydroxy department. And then with TU-1900 double beam UV-Vis spectrophotometer, absorbance of the solution with different concentration were measured, and the molar ratio of Cr3+ and quercetin determined, which was 1:1 and 2:1.
Quercetin; Cr; Molar ratio
O657.15
A
1009-2854(2010)08-0024-05
2010-07-18
雷克林(1966— ), 女, 湖北襄樊人, 襄樊学院化学工程与食品科学学院教授.
徐 杰)
