乳腺浸润性导管癌中AQP1、HIF-1α、VEGF的表达及意义
2010-12-11薛洪燕施红旗陈志梅王瑞权
薛洪燕 施红旗 陈志梅 王瑞权
(1.金华市人民医院,浙江 金华 321000;2.金华市中心医院,浙江 金华 321000)
水的跨膜转运是细胞生存和生长的必要条件,水通道蛋白(aquaporin,AQP1)是近年发现的一类高效转运水分子的特异孔道,它与水分子的快速跨膜转运关系密切[1],水通道蛋白1(AQP1)广泛存在于动物、植物及微生物中,调节细胞内外水跨膜转运。恶性肿瘤细胞具有无限增殖、异常分化、快速生长、侵袭和转移等诸多特性,其细胞形态和功能的改变离不开水的参与,甚至比正常细胞更需要水分子的快速跨膜转运。新近研究证实,AQP1对肿瘤演进具有重要作用[2],提示AQP1与人类肿瘤的发生发展有关。
局部缺氧是实体肿瘤微环境普遍存在的一种现象,缺氧诱导因子1(HIF-1)是缺氧条件下广泛存在于哺乳动物和人体内的一种核转录因子,HIF-1能与多种靶基因上的缺氧反应元件相结合,进而激活靶基因的转录活性,从而提高肿瘤细胞在缺氧状态下的生存率。研究证实,HIF-1为肿瘤信号传导的重要因子,与肿瘤演变关系密切[3-4]。HIF-1能激活血管内皮生长因子(VEGF)基因的转录活性,这三种分子是否存在内在联系,以及如何相互作用,国内外均少见报道。为此,作者通过检测120例乳腺浸润性导管癌组织中AQP1、HIF-1α及VEGF的表达水平,初步探讨三者的临床意义及相互间是否存在相关性。
1 资料与方法
1.1 一般资料 收集金华市人民医院及金华市中心医院1995年1月~2004年12月120例诊断为乳腺浸润性导管癌的存档组织蜡块,均为女性患者,每例均有详细临床资料、手术记录及5年以上的随访结果。术前均未接受化疗和放疗。患者年龄24~76岁,中位年龄47.8岁。标本经4%中性甲醛固定。按Elston和Ellis评分标准进行组织学分级,I级69例,II级41例,III级 10例;按TNM 分期,I期44例,II期57例,III期19例。42例有淋巴结转移,无转移者78例。生存时间≥5年者91例,<5年者29例,5年生存率75.8%。12例乳腺腺病为同期外科送来的标本。
1.2 方法
1.2.1 免疫组化检测实验步骤 4μ m厚切片,脱蜡至水,采用免疫组织化学EnvisionTM二步法,置于3%H2O2内5分钟灭活内源性过氧化物酶。抗原修复后,自然冷却20分钟,滴加一抗,4℃冰箱过夜,PBS冲洗,2分钟×3次;滴加二抗-HRP多聚体,37℃温箱内孵育20分钟,PBS冲洗2分钟×3次;DAB显色,蒸馏水冲洗、苏木素衬染,乙醇脱水,二甲苯透明,中性树脂封固。
1.2.2 免疫组化主要试剂 鼠抗人AQP1的多克隆抗体为美国Santa cruz公司产品,抗体按1:100稀释后应用。鼠抗人HIF-1α单克隆抗体购自武汉博士德生物工程有限公司,鼠抗人VEGF多克隆抗体及免疫组化染色试剂盒购自北京中杉生物技术有限公司。
1.2.3 免疫组化结果判断 AQP1阳性结果判定:细胞质或细胞膜上存在棕黄或棕褐色颗粒判为AQP1阳性细胞,选背景清晰阳性表达效果好的切片作统计学分析。每张切片随机选择5~10个高倍视野,计数1000个细胞中的阳性细胞取其平均数作为阳性细胞表达率。HIF-1α阳性仅定位于细胞核内,呈棕黄色。高倍镜(10×40倍)下对每张切片随机选择5个视野,每个视野计数200个细胞,共计1000个肿瘤细胞。无阳性细胞为阴性(-),阳性细胞数<10%为(+),10%~50%为(++),>50%为(+++)。VEGF阳性细胞为胞浆内棕黄色颗粒沉着细胞。在高倍镜(10×40倍)下对每张切片随机选择5个视野,计数200个细胞/视野,共计1000个,计算阳性细胞百分比=阳性细胞数/计数肿瘤细胞总数×100%。无染色或阳性细胞百分比<10%为阴性(-),阳性细胞数10%~30%为(+),30%~50%为(++),>50%为(+++)。
1.3 统计学处理 用SPSS11.0软件包,计数资料不同组间比较用卡方检验,计量资料用t检验,应用 spearman 等级相关检验对 AQP1、HIF-1α、VEGF表达之间的相关性进行分析。
2 结 果
2.1 AQP1的表达 AQP1主要表达于肿瘤的新生血管内皮细胞及部分肿瘤细胞,乳腺腺病组织中无AQP1表达。乳腺IDC与乳腺腺病组织相比,AQP1表达差异有显著性(t=23.862,P<0.01)。AQP1表达与乳腺IDC的肿块大小(t=23.990,P<0.01)、TNM分期(t=23.857,P<0.01)、组织学分级(t=23.835,P<0.01)、淋巴结转移与否(t=23.981,P<0.01)和肿瘤坏死与否(t=23.985,P<0.01)有关,两者或三者之间有显著性差异,而与患者年龄和术后5年生存率无关(P>0.05),见表1。
2.2 HIF-1α的表达 HIF-1α表达于细胞核,其阳性细胞主要出现于肿瘤边缘或与正常组织交界处,在坏死的肿瘤组织周围的癌细胞中阳性表达尤为明显,乳腺IDC组织中HIF-1α表达阳性率为44.2%,12例乳腺腺病组织中HIF-1α表达均阴性,乳腺IDC和乳腺腺病组织相比,HIF-1α表达差异有显著性(χ2=11.16,P<0.01)。HIF-1α表达率与乳腺IDC的肿块大小(t=22.392,P<0.01)、TNM分期(t=20.793,P<0.01)、组织学分级(t=6.035,P<0.05)、淋巴结转移与否(t=10.606,P<0.01)和肿瘤坏死与否(t=21.541,P<0.01)有关,两者或三者之间有显著性差异,而与患者年龄和术后5年生存率无关(P>0.05),见表1。
2.3 VEGF的表达 VEGF表达于癌细胞胞质,乳腺IDC组织中VEGF表达阳性率为62.5%,12例乳腺腺病组织中VEGF表达均阴性,乳腺IDC和乳腺腺病组织相比,VEGF表达差异有显著性(χ2=13.76,P<0.01)。VEGF表达率与乳腺IDC的肿块大小(χ2=9.163,P <0.01)、TNM 分期(χ2=11.362,P<0.01)、组织学分级(χ2=11.408,P<0.01)、淋巴结转移与否(χ2=11.966,P<0.01)和肿瘤坏死与否(χ2=18.020,P<0.01)有关,两者或三者之间有显著性差异,而与患者年龄和术后5年生存率均无关(P>0.05),见表1。
2.4 乳腺IDC组织HIF-1α与AQP1和 VEGF表达的相关性 AQP1与HIF-1α、VEGF两两比较呈正相关(r=0.555,r=0.495,r=0.377,均 P<0.01)。
3 讨 论
局部缺氧是包括乳腺癌在内的实体肿瘤普遍存在的一种现象,也是实体瘤微环境的基本特征,同时肿瘤细胞缺氧也成为肿瘤恶性转化甚至转移的启动因子。HIF-1是缺氧条件下广泛存在于哺乳动物和人体内的一种核转录因子,能激活多种基因的转录活性,这些基因的蛋白产物包括血管内皮生长因子(VEGF)、促红细胞生成素(EPO)、内皮素1(endotheltin-1)、糖酵解酶等,进而参与维持肿瘤细胞的能量代谢、新血管生成、促进肿瘤增殖和转移[5]。大多数肿瘤表现为更高的血管渗透性及细胞间质液压力的增高,导致局部缺氧,缺氧可直接刺激HIF-1表达升高。本组检测结果显示,12例乳腺腺病组织中均未见HIF-1α的表达,而乳腺IDC阳性表达率为44.2%,并与乳腺IDC的肿块大小、TNM分期、组织学分级、肿瘤坏死和淋巴结转移有关;同时发现,在乳腺IDC的坏死区周围更易见到HIF-1α阳性细胞,同时这些区域的AQP1也都高表达,另外,肿瘤浸润的边缘或间质血管增生处HIF-1α往往呈阳性表达,提示HIF-1α过表达往往伴随血管生成、浸润和转移。
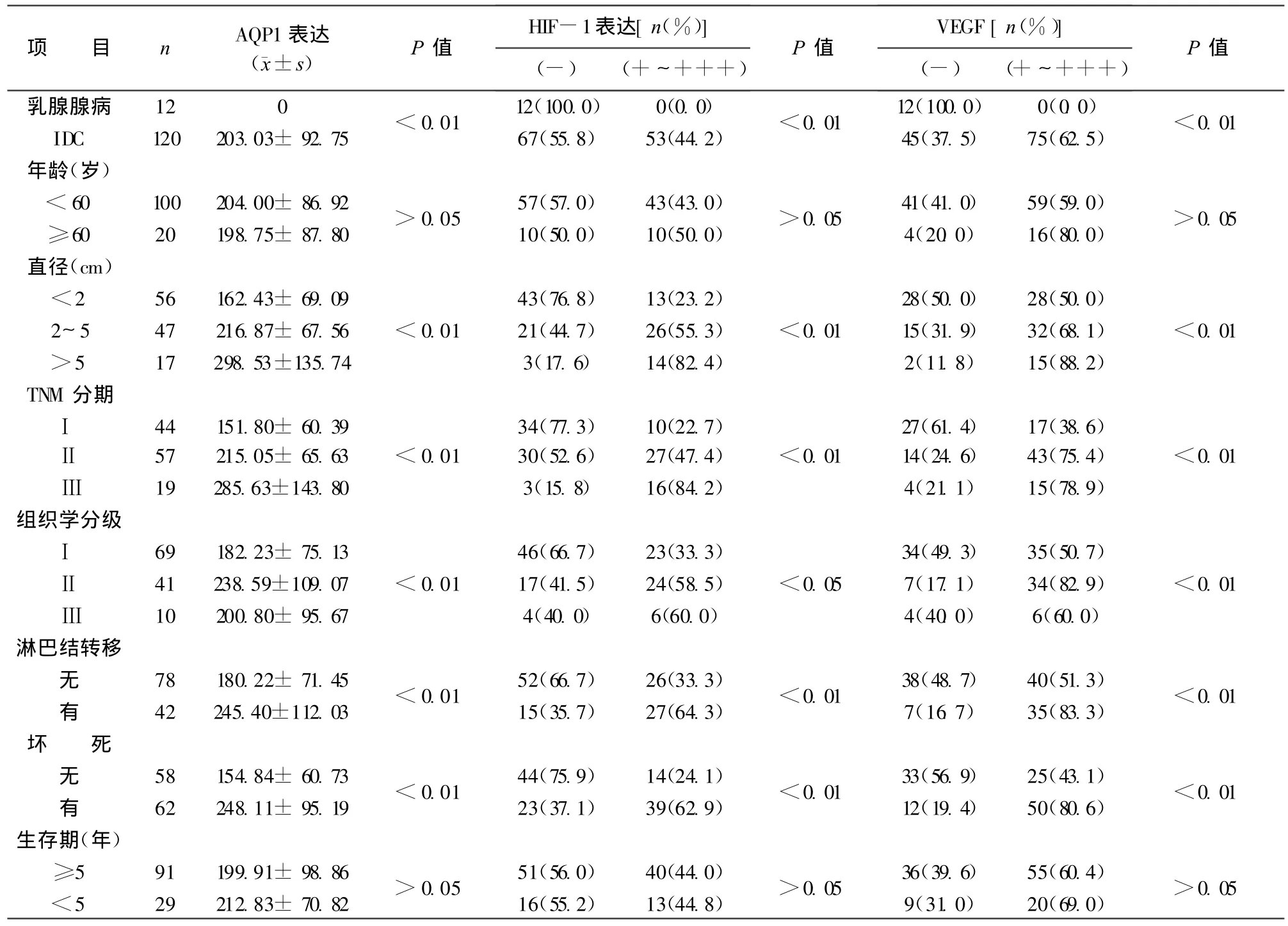
表1 乳腺腺病及乳腺IDC中AQP1、HIF-1α和VEGF表达
局部缺氧,也将影响细胞的能量代谢及细胞膜离子通道的功能,进而可能影响细胞膜上水通道蛋白的功能。水通道蛋白通过调节细胞及组织间水的跨膜转运,可有效地调节细胞及组织间的液压力,调节局部缺氧程度,间接影响HIF-1的表达,可见,AQP1与HIF-1α之间可能存在着复杂的病理生理联系。本组结果显示,HIF-1α阳性表达组的AQP1阳性细胞表达率较HIF-1α阴性表达组明显高,表明两者在生化水平上存在一定的关联,在功能上可能存在相互作用机制。AQP1正常在血管内皮细胞胞浆或胞膜中表达,研究表明AQP1在许多肿瘤的血管生成过程中起重要作用[6]。本组结果显示,AQP1在乳腺IDC的表达高于乳腺腺病的表达,并且其表达与肿块大小、TNM分期、组织学分级、淋巴结转移和肿瘤坏死有关。AQP1过表达表明肿瘤间质中不仅有大量新生微血管,而且AQP1介导的水分子快速跨膜转运有助于水分及其携带的大量营养物质通过内皮细胞进入到周围的组织间隙中,满足肿瘤细胞的生长代谢并为其向周围组织侵袭浸润提供充分的物质基础。Baluk等[7]有关肿瘤毛细血管上AQP1基因表达的研究提示,肿瘤异常血管的形成可能是通过增强血管的渗透性和组织间隙的压力来实现的。VEGF是参与肿瘤血管生成的主要直接调控因子之一,有研究发现在VEGF基因转录起始点上游存在HIF-1α结合位点,HIF-1α可促进VEGF基因转录和翻译,诱导血管形成[8]。本组结果显示乳腺IDC组织中VEGF的阳性表达率明显高于乳腺腺病组织,并与乳腺IDC的肿块大小、TNM分期、组织学分级、肿瘤坏死和淋巴结转移有关。经分析AQP1与HIF-1α、VEGF表达变化,结果显示两两比较呈正相关(r=0.555、r=0.495、r=0.377,P<0.01),推测通过AQP1介导的高渗透性引起流体静力压的增高,并且随之引起缺氧,缺氧状态下HIF-1α基因激活,通过调控VEGF的转录而促进乳腺IDC组织中新生血管的生成。乳腺癌组织雌激素受体、孕激素受体、表皮生长因子受体靶分子信号传导网络及调控机制的阐明,已深刻地揭示了其在乳腺癌演进过程中的重要意义,已成为选择治疗策略的重要依据。通过乳腺癌组织中AQP1与HIF-1α、VEGF相关性研究,初步探讨其间存在的关系,为进一步探明生物靶分子之间相互作用的信号传导机制,特别是寻找新的分子治疗靶点,进而为乳腺癌的防治提供有益帮助。
[1] Verkman A S.More than just water channels:unexpected cellularroles of aquaporins.J Cell Sci,2005,118(pt 15):3225
[2] Hoque M O,soria J C,Woo J,et a1.Aquaporin 1 is overexpressed in lung cancer and stimulates NIH-3T3 cell proliferation and anchorageindependent growth.Am J Pathol,2006,168(4):1345
[3] Yashuda H.Solid tumor physiology and hypoxia-induced chemo/radioresistance:novel strategy for cancer therapy:nitric oxide donor as a therapeutic enhancer.Nitric Oxide,2008,19(2):205
[4] Brennan P A,Mackenzie N,Quintero M.Hypoxia-inducible factor 1alpha in oral cancer.J Oral Pathol Med,2005,34(7):385
[5] Li J,Shi M,Gao Y,et a1.Knockdown of hypoxia—inducible factorl alpha in breast carcinoma MCF-7 cells results in reduced tumor growth and increased sensitivity to methotrexate.Biochem Biophys Res Commun,2006,342(5):1341
[6] Saadoun S,Papadopanlos M C,Hara—Chikuma M,et a1.Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption.Nature,2005,434(7034):786
[7] Baluk P.Hashizume H,McDonald D M.Cellular abnormalities of blood vessels as targets in cancer.Curr Opin Genet Dev,2005,15(1):102
[8] 赵丽莎,邓涛,黄磊,等.缺氧诱导因子和血管生成素在直肠癌中的表达及血管形成中的作用.武汉大学学报(医学版),2008,29(3):371
