含电子给体乙炔二茂铁化合物的光谱及电化学性质
2010-12-05曹迁永匡仁云李志华杨震宇
曹迁永 卢 鑫 匡仁云 李志华 杨震宇
(1南昌大学化学系,南昌 330031; 2井冈山大学化学化工学院,江西吉安 343009)
含电子给体乙炔二茂铁化合物的光谱及电化学性质
曹迁永1,*卢 鑫1匡仁云2李志华1杨震宇1
(1南昌大学化学系,南昌 330031;2井冈山大学化学化工学院,江西吉安 343009)
合成了三种含电子给体乙炔基桥连二茂铁化合物Fc—C≡C—Ph—(p-OMe)(3a),Fc—C≡C—Ph—(p-NMe2)(3b)与Fc—C≡C—Ph—(p-NPh2)(3c),并对其结构、光化学及电化学性质进行了表征.吸收光谱表明,所有化合物在可见光区400-550 nm都可归属为Fe(II)→Cp—C≡C—Ph—(p-R)(Cp为环戊二烯基)的金属到配体的电荷跃迁(MLCT)光谱,同时检测到3a与3c氧化态在近红外区(分别位于946与1044 nm)可归属为Cp—C≡C—Ph—(p-R)→Fe(III)的配体到金属的电荷跃迁(LMCT).电化学测试结果表明,三种化合物都有稳定的Fc+/Fc可逆氧化还原电位,且3b与3c还出现Ph—NR2的氧化电位.3b对质子表现出光及电化学敏感性,随着质子的加入,其MLCT光谱红移,Fc+/Fc电位正移,而Ph—/Ph—NR2峰消失.
二茂铁;质子化;吸收光谱;氧化;电化学
含有延伸π电子共轭体系的金属有机化合物由于其在光、电、磁性等方面所具有的独特性能,已经引起了人们的广泛重视和深入研究[1-3].二茂铁及其衍生物由于好的芳香性、氧化还原活性、稳定性及易化学修饰等特点,在这一领域中具有重要的地位[4].近年来,这类共轭体系二茂铁化合物在非线性光化学、化学传感器、超分子组装及异核金属有机化合物合成等方面的研究获得了较大的进展[5-10].在这些共轭二茂铁化合物中,二茂铁部分(Fc)一般作为电子给体(D),而其余部分常含吸电子基作为电子受体(A),通过双键或三键等不饱和键相连形成D(Fc)-π-A二元化合物,给体与受体部分通过不饱和键有效地进行分子内电荷转移.而相对于其余部分含供电子基的D(Fc)-π-D二元化合物的研究则相对较少[11-13].由于二茂铁稳定的氧化态,通过适当的化学氧化或电化学氧化,这种D(Fc)-π-D二元化合物可变为A(Fc+)-π-D,有望应用于分子导线及近红外光检测等领域[5].在此,我们合成了三种D(Fc)-π-D型二元化合物,Fc—C≡C—Ph—(p-OMe)(3a),Fc—C≡C—Ph—(p-NMe2)(3b)与Fc—C≡C—Ph—(p-NPh2) (3c).研究了它们中性及氧化态电子吸收光谱及电化学性质,并对化合物3b进行了质子识别研究.
1 实验部分
1.1 试剂、仪器及相关测试
乙炔二茂铁(2)与N,N-二苯基-对溴苯胺(1c)按文献方法[14-15]合成,Pd(PPh3)2Cl2及HBF4·Et2O(分析纯)从英国Alfa Aeser公司购买,其它试剂及药品(分析纯)购于国药集团化学试剂公司.无水溶剂按文献方法纯化[16].
使用日本Shimadzu UV2300型紫外光谱仪;美国PE公司Spectrum One傅里叶转换红外仪(KBr压片);美国Varian 400 MHz核磁共振仪,四甲基硅烷(TMS)为内标;上海辰华电化学工作站CHI 610C;德国IKA-RET磁力搅拌器.
电化学相关测试在上海辰华仪器有限公司生产的CHI 610C电化学工作站上进行,测试时采用三电极体系,以铂圆盘电极为工作电极、铂丝电极为对电极、Ag/Ag+为参比电极(Ag+的浓度0.10 mol·L-1),六氟磷酸四丁基铵(0.10 mol·L-1)为支持电解质,乙腈为溶剂.测试样品浓度为500 μmol·L-1,测定之前通N2,15-20 min除氧,在氮气气氛中进行测定,利用循环伏安法(CV)和常规差分脉冲伏安法(DPV)(脉冲宽度为50 ms)进行测定,其扫描范围为-0.100-1.000 V,扫描速率为0.05 V·s-1.
1.2 合 成
化合物3a-3c由2与溴代苯在Pd(PPh3)2Cl2/CuI催化下,通过Sonogashira偶联反应[17-18]得到(见图1).其基本反应步骤如下:在N2保护下,将2 mmol(420 mg)2和2 mmol溴代苯(1),0.06 mmol Pd(PPh3)2Cl2, 0.06 mmol CuI加入40 mL的无水三乙胺和四氢呋喃(体积比为1/1)中,搅拌回流18 h.反应结束后,抽滤,将滤液旋干,粗产品通过硅胶柱分离 (洗脱剂:乙酸乙酯/石油醚)得到黄色固体.

图1 3a-3c的合成方法Fig.1 Synthetic approach for 3a-3c
3a:379 mg,产率60%.1H NMR(400 MHz,CDCl3, 25℃,TMS)δ:3.18(s,3H),3.93-3.96(d,2H),4.11(s, 5H),4.48-4.51(d,2H),6.57-6.62(d,2H),7.47-7.52 (m,2H).分析计算得C19H16FeO(316.06):C,72.18%; H,5.10%;O,5.06%.实验得到:C,72.33%;H,5.01%; O,5.16%.IR(KBr,cm-1):1258,1389,2180.
3b:467 mg,产率71%.1H NMR (400 MHz, CDCl3,25℃,TMS)δ:2.98(s,6H),4.19-4.2(d,2H), 4.23(s,5H),4.46-4.47(d,2H),6.63-6.66(d,2H),7.35-7.38 (d,2H).分析计算得C20H19FeN (329.09):C, 72.97%;H,5.82%;N,4.25%.实验得到:C,72.85%; H,5.90%;N,4.14%.IR(KBr,cm-1):1378,2215.
3c:607 mg,产率67%.1H NMR(400 MHz, CDCl3,25℃,TMS)δ:4.22-4.23(m,2H),4.26(s,5H), 4.47-4.48(t,2H),6.98-7.0(d,2H),7.03-7.05(d,2H), 7.06-7.12(m,4H),7.27-6.29(d,4H),7.32-7.34(d, 2H).分析计算得到C30H23FeN(453.12):C,79.48%;H, 5.11%;N,3.09%.实验得到:C,79.30%;H,5.23%;N, 3.02%.IR(KBr,cm-1):2210.
2 结果与讨论
2.1 化合物的吸收光谱及电化学性质
化合物3a-3c在乙腈溶液中的吸收光谱见图2,详细的光谱数据见表1.从表1和图2可看出,三种化合物在紫外区都有强的吸收(λ<380 nm),可归属为配体Cp—C≡C—Ph—(p-R)(Cp为环戊二烯基)内部π-π*或n-π*跃迁.同时,在可见光区400-550 nm处有一低能吸收,吸收峰分别位于446、440和443 nm,可以归属为Fe(II)→Cp—C≡C—Ph-(p-R)的MLCT带[4-5].该吸收峰相对于含吸电子基—NO2的D-A二元化合物有一定的蓝移[19],这与文献报道结果一致,即吸电子基使MLCT光谱红移,而供电子基导致蓝移.

图2 3a-3c(30 μmol·L-1)在CH3CN溶液中的紫外-可见吸收光谱Fig.2 UV-Vis spectra of 3a-3c(30 μmol·L-1) in CH3CN solutioninset:enlarge figure in the range of 380-600 nm
通过循环伏安(CV)和常规差分脉冲伏安(DPV)法表征了所有化合物的的电化学性质(表1和图3).对于3a,在循环伏安曲线中,半波电位E1/2=0.193 V (ΔE=0.088 V)处出现一个可归属为Fc+/Fc的单电子可逆氧化还原峰.对于3b和3c,除观察到E1/2分别位于0.161及0.187 V,归属为Fc+/Fc的单电子可逆氧化还原峰外,同时在阳极电位峰Epa为0.632和0.788 V处出现单电子非可逆氧化还原峰,可归属为苯胺N原子Ph—NR+2/Ph—NR2电位,同样的结果在文献中也有报道[20].与CV法相一致,在DPV法中, 3a仅在0.179 V处出现单氧化峰,而3b和3c都出现了两个氧化峰,分别对应为Fc(3b的0.144 V和3c的0.162 V)及苯胺N原子(3b 0.564 V和3c 0.692 V)的得失电子过程.同时,通过比较Fc+/Fc电位,发现其电位按3a、3c、3b的顺序减少,且都小于含吸电子取代基化合物Fc—C≡C—Ph—(p-NO2)氧化还原电位(0.20 V,相对于二茂铁电位)[12].这与取代基的给电子能力相一致:吸电子取代基使Fc+/Fc电位增大,而供电子取代基使Fc+/Fc电位减少.—OCH3、—NPh2、—NMe2都为供电子取代基,且供电子能力依次增强.
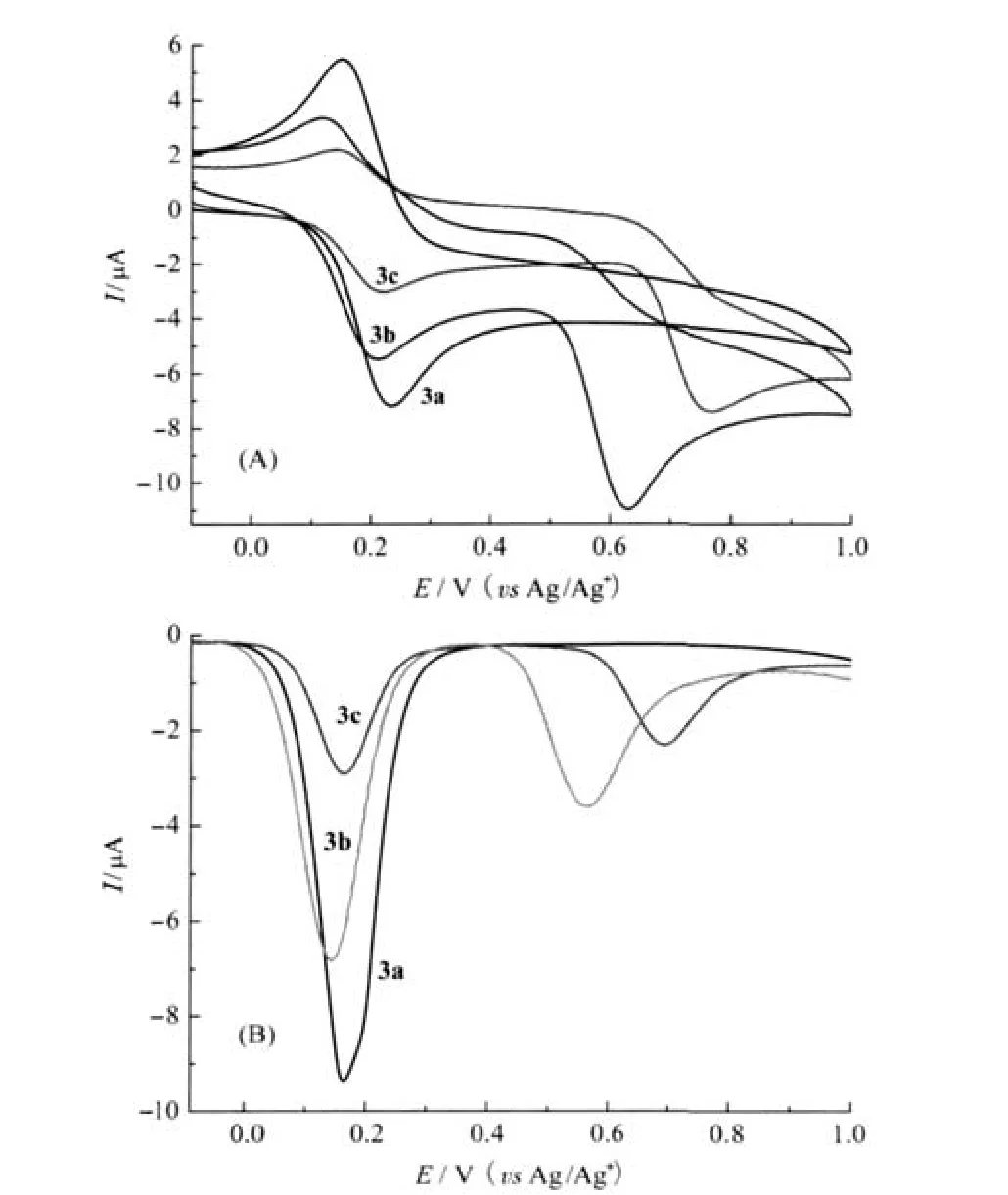
图3 3a-3c(500 μmol·L-1)在CH3CN溶液中的循环伏安谱图(A)和在CH3CN溶液中常规差分脉冲谱图(50 ms脉冲宽度)(B)Fig.3 CVs of 3a-3c(500 μmol·L-1)in CH3CN solution(A)and DPVs(50 ms pulse width)of 3a-3c (500 μmol·L-1)in CH3CN solution(B)

表1 3a-3c的紫外-可见-近红外吸收数据和电化学数据Table 1 UV-Vis-NIR absorption and electrochemical data of 3a-3c
2.2 化合物的化学氧化
二茂铁化合物具有稳定的氧化态,通过适当的电化学氧化或化学氧化剂氧化,可将Fc→Fc+,这在研究化合物分子内电荷转移机理及分子导线设计等领域有重要的意义[21].在此我们以三氟甲基磺酸铜作为氧化剂[22],研究了3a-3c氧化态Fc+—C≡C—Ph—(p-R)在200-1100 nm处的电子光谱变化.其氧化态时的电子光谱数据见表1,同时图4给出了3c不断滴加氧化剂时光谱变化.从图4中可看出,随着氧化剂浓度的增加,3c在紫外光区340 nm吸收峰减弱并蓝移至327 nm,300 nm吸收峰增强蓝移至295 nm;在可见光区410及493 nm出现两个新的宽的吸收峰.同时,在近红外区λmax=1044 nm(摩尔吸光系数ε=1.4×103L·mol-1·cm-1)出现了一个宽的可归属为Cp—C≡C—Ph—(p-R)→Fe(III)的LMCT光谱[11,23].在311和365 nm处的等吸收点表明两化学氧化过程中仅出现3c与氧化态3c+两种组份.3a+的电子光谱同3c类似,其LMCT光谱λmax=946 nm (ε=1.0×103L·mol-1·cm-1).而对于3b,滴加氧化剂时在UV-Vis区域光谱变化类似于3a与3c,其在紫外区310 nm处吸收峰减弱直至消失,伴随352 nm出现新的吸收峰(ε=25.6×103L·mol-1·cm-1);在可见光区410-650 nm出现宽的低能吸收.同时,在274和339 nm处出现两个等吸收点.在仪器测试范围200-1100 nm,未检测到近红外区吸收,这可能因为3b+的LMCT光谱处于更低级,因为—NMe2相比—NPh2与—OCH3为更强的供电子基.这一点同样可从3c与3a及文献中报道不含吸电子基Fc—C≡ C—Ph的吸收光谱得到证实[11].随着供电子能力减弱,其LMCT最大吸收峰分别位于1044、946及797 nm处.
2.3 化合物3b的质子识别
由于3b中的N原子含有孤对电子,具有一定的碱性.通过质子化,—NMe2由供电子基转变为吸电子基—NHMe,从而使化合物的电子谱及电化学性质发生改变.基于这一原理,质子识别的光化学及电化学传感器已有文献报道[24-25].在此,我们研究了化合物3b滴加不同浓度质子时的电子光谱及电化学性质的变化.
3b在乙腈溶液中滴加HBF4·Et2O的吸收光谱变化见图5.从图中可看出,随着HBF4·Et2O浓度的增加,在紫外光区310 nm吸收峰减弱并蓝移到306 nm,247 nm吸收峰减弱并消失,同时,在358 nm产生一个新的吸收峰;而在可见光区,归属为Fe(II)→Cp—C≡C—Ph—(p-NMe2)的MLCT带增强并发生红移(由440→446 nm).在272及353 nm处的两个等吸收点表明该过程中存在质子化产物[24].当滴加HBF4·Et2O浓度至10倍当量时,峰形不再变化,表明3b质子化为3b H+.
这种质子化过程中取代基推位电子效应的变化同样导致3b电化学性质的变化(见图6).随着HBF4· Et2O浓度的增加,CV变化曲线中3b中第一对二茂铁的可逆氧化还原峰Fc+/Fc电位向正方向移动(E1/2由0.161增大至0.231 V);同时,由于N原子孤对电子对与质子络合,其在0.632 V处归属为—NMe/—NMe2氧化峰发生正移,直至消失.这个结果在3b加酸的DPV变化曲线中得到了进一步的印证,随着酸的浓度加大,二茂铁的半波电位Ep不断增大(ΔEp=0.086 V),而—/—NMe2氧化峰正移,减弱至逐渐消失.
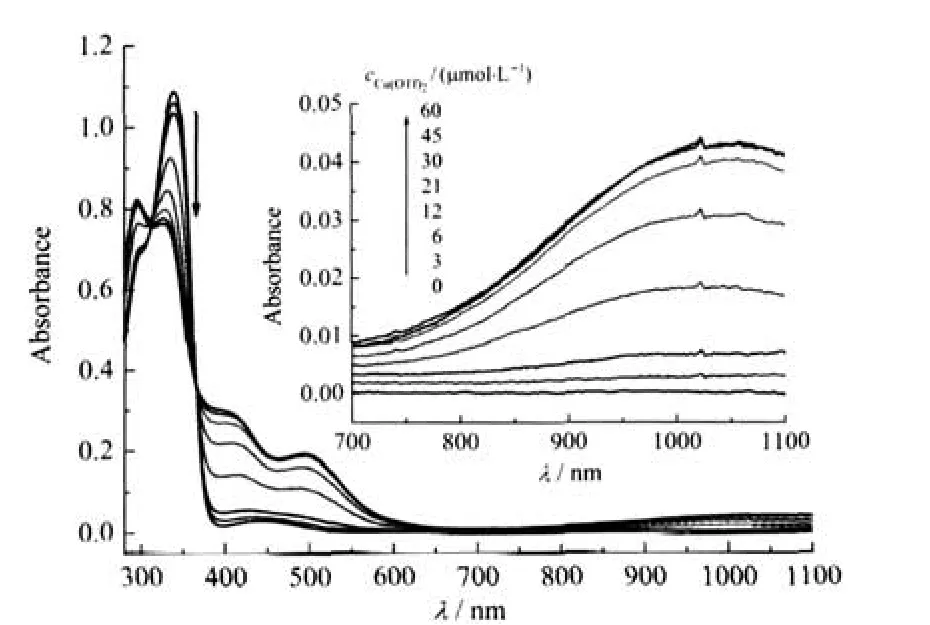
图4 3c(30 μmol·L-1)在乙腈中滴定Cu(OTf)2 (0-60 μmol·L-1)的紫外-可见-近红外光谱图Fig.4 UV-Vis-NIR spectra of 3c(30 μmol·L-1)on titration with Cu(OTf)2(0-60 μmol·L-1)inCH3CN solutioninset:enlarge figure in the range of 700-1100 nm
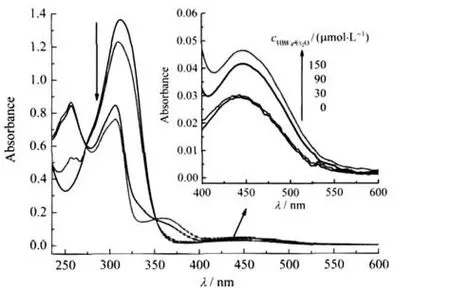
图5 3b(30 μmol·L-1)在乙腈中滴定HBF4·Et2O (0-150 μmol·L-1)的紫外-可见吸收谱图Fig.5 UV-Vis spectra of 3b(30 μmol·L-1)on titration with HBF4·Et2O(0-150 μmol·L-1)in CH3CN solutioninset:enlarge figure in the range of 400-600 nm

图6 3b(500 μmol·L-1)在乙腈中滴定HBF4·Et2O (0-2.5 mmol·L-1)的循环伏安(A)和常规差分脉冲伏安谱图(B)Fig.6 CVs(A)and DPVs(B)of 3b(500 μmol·L-1) on titration with HBF4·Et2O(0-2.5 mmol·L-1) in CH3CN solution
虽然3c中的N原子同样含有孤对电子,但加入大量HBF4·Et2O后其吸收光谱及电化学性质并没有很大的变化.这可能是因为三芳胺与N,N-二甲基-苯胺相比为更弱的碱,文献报道它们的pKa值分别为5.15及-5.0[26].
3 结论
合成了三种含电子给体乙炔基桥连二茂铁化合物3a-3c,这些化合物相比于一些含吸电子基的二元化合物的MLCT光谱出现了一定程度蓝移,但其氧化态在近红外区有更低能量的配体内部电荷转移(ILCT)吸收.三化合物都有稳定的Fc+/Fc可逆氧化还原电位,且3b与3c还出现Ph—NR2的氧化电位.对于含—NMe2取代基3b,发现对质子表现出光及电化学敏感性,对设计合成新的化学传感器有一定的参考价值.
1 Gust,D.;Moore,T.A.;Moore,A.L.Acc.Chem.Res.,2001,34:40
2 Sauvage,J.P.;Collin,J.P.;Chambron,J.C.;Guillerez,S.; Coudret,C.;Balzani,V.;Barigelletti,F.;Cola,L.D.;Flamigni,L. Chem.Rev.,1994,94:993
3 Bella,S.D.Chem.Soc.Rev.,2001,30:355
4 Fery-Forgues,S.;Delavaux-Nicot,B.J.Photochem.Photobiol.A: Chem.,2000,132:137
5 Debroy,P.;Roy,S.Coord.Chem.Rev.,2007,251:203
6 Peris,E.Coord.Chem.Rev.,2004,248:279
7 Liao,Y.;Eichinger,B.E.;Firestone,K.A.;Haller,M.;Luo,J.D.; Kaminsky,W.;Benedict,J.B.;Reid,P.J.;Jen,A.K.Y.;Dalton,L. R.;Robinson,B.H.J.Am.Chem.Soc.,2005,127:2758
8 Delavaux-Nicot,B.;Maynadie,J.;Lavabre,D.;Fery-Forgues,S. Inorg.Chem.,2006,45:5691
9 Guldi,D.M.;Maggini,M.;Scorrano,G.;Prato,M.J.Am.Chem. Soc.,1997,119:974
10 Ceccon,A.;Santi,S.;Orian,L.;Bisello,A.Coord.Chem.Rev., 2004,248:683
11 Cuffe,L.;Hudson,R.D.A.;Gallagher,J.F.;Jennings,S.; McAdam,C.J.;Connelly,R.B.T.;Manning,A.R.;Robinson,B. H.;Simpson,J.Organometallics,2005,24:2051
12 Chawdhury,N.;Long,N.J.;Mahon,M.F.;Ooi,L.;Raithby,P.R.; Rooke,S.;White,A.J.P.;Williams,D.J.;Younus,M.J. Organomet.Chem.,2004,689:840
13 Chen,Y.J.;Pan,D.S.;Chiu,C.F.;Su,J.X.;Lin,S.J.;Kwan,K. S.Inorg.Chem.,2000,39:953
14 Polin,J.;Schottenberger,H.Org.Synth.,1998,9:411
15 Xiao,H.B.;Shen,H.;Lin,Y.G.;Su,J.H.;Tian,H.Dyes Pigments,2007,73:224
16 Perrin,D.D.;Armarego,W.L.F.;Perrin,D.R.Purification of laboratory chemicals.2th ed.Oxford:Pergamon Press,1980
17 Muthiah,C.;Kumar,K.P.;Mani,C.A.;Swamy,K.K.C.J.Org. Chem.,2000,65:3733
18 Kocher,S.;Lang,H.J.Organomet.Chem.,2001,637-639:198
19 Barlow,S.;Marder,S.R.Chem.Commun.,2000:1555
20 Ju,H.D.;Tao,X.T.;Wan,Y.;Shi,J.H.;Yang J.X.;Xin,Q.;Zou, D.C.;Jiang,M.H.Chem.Phys.Lett.,2006,432:321
21 Barlow,S.;O′ahare,D.Chem.Rev.,1997,637-669:97
22 Martınez,R.;Ratera,I.;Tarraga,A.;Molina,P.;Veciana,J.Chem. Commun.,2006:3809
23 McGale,E.M.;Robinson,B.H.;Simpson,J.Organometallics, 2003,22:931
24 Zucchero,A.J.;Wilson,J.N.;Bunz,U.H.F.J.Am.Chem.Soc., 2006,128:11872
25 García-Acosta,B.;Martínez-Mánez,R.;Sancenon,F.;Soto,J.; Rurack,K.;Spieles,M.;García-Breijo,E.;Gil,L.Inorg.Chem., 2007,46:3123
26 Goodall,W.;Williams,J.A.G.Chem.Commun.,2001:2514
January 5,2010;Revised:April 6,2010;Published on Web:June 25,2010.
Optical and Electrochemical Properties of Ethynyl-Bridged Ferrocenes with Electron Donor Groups
CAO Qian-Yong1,*LU Xin1KUANG Ren-Yun2LI Zhi-Hua1YANG Zhen-Yu1
(1Department of Chemistry,Nanchang University,Nanchang 330031,P.R.China;2College of Chemistry and Chemical Engineering,Jinggangshan University,Ji′an 343009,Jiangxi Province,P.R.China)
We present the synthesis,optical and electrochemical properties of three ethynyl-bridged ferrocenes with electrondonorgroups,Fc—C≡C—Ph-(p-OMe)(3a),Fc—C≡C—Ph-(p-NMe2)(3b)and Fc—C≡C—Ph—(p-NPh2)(3c). All three compounds show a Fe(II)→Cp—C≡C—Ph—(p-R)(Cp=cyclopentadienyl)metal to ligand charge transition (MLCT)in 400-550 nm.Upon oxidation,3a and 3c show a Cp—C≡C—Ph—(p-R)→Fe(III)ligand to metal charge transition(LMCT)in the near-IR range(946 and 1044 nm).A reversible Fc+/Fc potential for 3a-3c and an irreversible Ph—/Ph—NR2potential for 3b and 3c are observed by in the cyclic and differential pulse voltammetry.Finally, 3b shows an optical and electrochemical response upon protonation,with a red shift of the MLCT transition,an anodic shift of the Fc+/Fc potential,and disappearance of the Ph—/Ph—NR2peak.
Ferrocene;Protonation;Absorption spectrum;Oxidation;Electrochemistry
[Article] www.whxb.pku.edu.cn
*Corresponding author.Email:cqyong@ncu.edu.cn;Tel:+86-791-3969252.
The project was supported by the National Natural Science Foundation of China(20963007),Bureau of Education of Jiangxi Province,China (GJJ09074)and Program for Innovative Research Team of Nanchang University,China.
国家自然科学基金(20963007),江西省教育厅自然科学基金(GJJ09074)和南昌大学创新团队基金资助
O646;O644
