阿霉素诱导食管癌耐药细胞中ABCG2的表达及其意义
2010-12-03刘亮左静赵丽王静郭建文刘江惠左连富
刘亮,左静,赵丽,王静,郭建文,刘江惠,左连富
(河北医科大学 第四医院1.肿瘤研究所流式细胞室;2.肿瘤内科,石家庄050011)
食管癌是我国常见的恶性肿瘤之一,目前食管癌化疗过程中出现的耐药现象严重影响了治疗效果。因此,阐明食管癌化疗的耐药现象就十分重要。ATP结合转运蛋白G超家族员2(ATP-binding cassetee transporter G2,ABCG2)是新发现的与化疗耐药有关的因子。研究发现,ABCG2在多种肿瘤中高表达[1~3],并且我们研究发现,ABCG2在食管癌中也有高表达[4],认为ABCG2参与了食管癌耐药的形成。本实验采用递增阿霉素(adriamycin,ADM)的浓度,来诱导食管癌细胞(Eca109)细胞产生耐药,建立耐药食管癌细胞模型,并利用多项实验方法检测其生物学特征。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器:ADM,浙江海正药业股份有限公司;引物,上海生工生物公司;反转录试剂盒,Promega公司;Trizol试剂,Gibco BRL公司;流式细胞仪,美国Beckman Coulter公司;PCR扩增仪,德国eppendorf公司;ABCG2抗体,Biolegend公司(用于流式细胞术检测);ABCG2抗体(克隆号:sc-18841)购自SANTA CRUZ公司(用于Western Blot方法检测)。
1.1.2 细胞株:人食管癌Eca109细胞株由本实验室传代培养,接种细胞于含10%胎牛血清的RPMI1640培养基中(补充青霉素、链霉素各100 U/L),培养器皿置于37℃含有5%CO2的细胞培养箱中。
1.2 方法
1.2.1 耐药细胞株Eca109/ADM的诱导:采用药物持续接触浓度递增诱导法[5],将对数生长期Eca109细胞接种于含低浓度ADM(0.002 μg/ml)的培养基中,根据细胞的生长情况不断提高药物浓度,直到细胞能在含ADM浓度为0.02 μg/ml的培养基中稳定生长,历时8个月。细胞命名为Eca109/ADM细胞。
1.2.2 药敏试验:采用MTT法检测Eca109细胞、Eca109/ADM细胞对ADM的敏感性。Eca109/ADM细胞在不含ADM的RPMI1640培养基中培养2周后备用,取对数生长期的Eca109细胞、Eca109/ADM细胞,用RPMI1640培养基制备成单细胞悬液,分别接种到 96 孔板(200 μl/孔,约1×105个/孔),培养4 h细胞贴壁后,参照ADM对人的药物血浆高峰浓度加入不同浓度的ADM(设3个复孔),再培养24 h后,每孔加入20 μl(5 mg/ml)MTT继续培养4 h,弃上清液,加入二甲基亚砜150 μl/孔,充分振荡10 min,酶标仪测每孔A490 nm值。计算细胞存活率(存活率=实验组A490 nm值/对照组A490 nm值×100%),应用统计学软件SPSS11.5计算半数抑制浓度(IC50),从而计算耐药指数(RI)=耐药细胞 IC50/亲本细胞IC50。
1.2.3 RT-PCR方法检测细胞中ABCG2mRNA的表达:取生长状态良好处于对数生长期的Eca109、Eca109/ADM细胞,冷PBS洗涤2次,加入1 ml Trizol试剂,常规一步法提取总RNA。RT-PCR方法采用两步法[6],ABCG2 上游引物5′-GGTCAGAGTGTGGTTTCTGTAGCA-3′,下游引物5′-GTGAGAGATCGATGCCCTGCTTTA-3′。 扩增片段280 bp。GAPDH 上游引物5′-ACCACAGTCCATGCCATC-3′,下游引物5′-TCCACCACCCTGTTGCTG-3′,扩增片段452 bp。扩增条件为94℃5 min,94℃30 s,63.1℃30 s,72 ℃30 s,共30 个循环,72 ℃10 min。对扩增产物进行1.5%琼脂糖电泳,溴化乙锭染色,在凝胶成像分析仪下成像,用Gel-proAnalyzer3.1软件分析扩增产物的光密度(optical density,OD)值,计算ABCG2OD值/GAPDHOD值的比值,对ABCG2 mRNA表达强度进行光密度半定量分析。
1.2.4 流式细胞术方法检测细胞中ABCG2蛋白的表达:取生长状态良好,处于对数生长期的Eca109、Eca109/ADM细胞,冷PBS洗涤2次,用0.25%胰酶消化,4℃预冷的PBS缓冲液洗2次细胞后,离心弃去上清液,冷PBS液将沉淀细胞重悬成1×106/100 μl,向细胞悬液中加入FITC标记的ABCG2抗体,避光作用2 h后,流式细胞仪检测细胞中ABCG2蛋白的表达量,以平均荧光强度表示蛋白的含量。实验重复3次。
1.2.5 Western Blot方法检测细胞中ABCG2蛋白的表达:取生长状态良好,处于对数生长期的Eca109、Eca109/ADM细胞,冷PBS洗涤2次,使用RIPA试剂常规方法提取细胞蛋白。常规Western Blot方法检测细胞中ABCG2蛋白,其中β-actin为内参照。对条带进行扫描,并用Gel-Pro Analyzer3.1软件分析条带的光密度值,计算ABCG2条带OD/β-actin条带OD值,作为ABCG2的相对含量。实验重复3次。
1.2.6 药物外排实验:取对数生长期的Eca109、E-ca109/ADM细胞4×105个/孔接种于6孔板中,在37℃、5%CO2的培养箱中培养,待细胞贴壁后加0.02 μg/mlADM作用2 h后,弃去上清液,换无ADM药物的含10%胎牛血清RPMI1640培养基,在37℃、5%CO2的培养箱中继续培养1 h。弃去上清,冷PBS液洗涤细胞两遍。收集细胞,流式细胞仪上检测细胞内ADM的荧光强度。细胞内的ADM受488 nm的激光激发后能产生红色荧光,可被流式仪接收,测出荧光强度,从而反映细胞内ADM的含量。每组设6复孔。
1.3 统计学分析
2 结果
2.1 耐药细胞株Eca109/ADM细胞培养
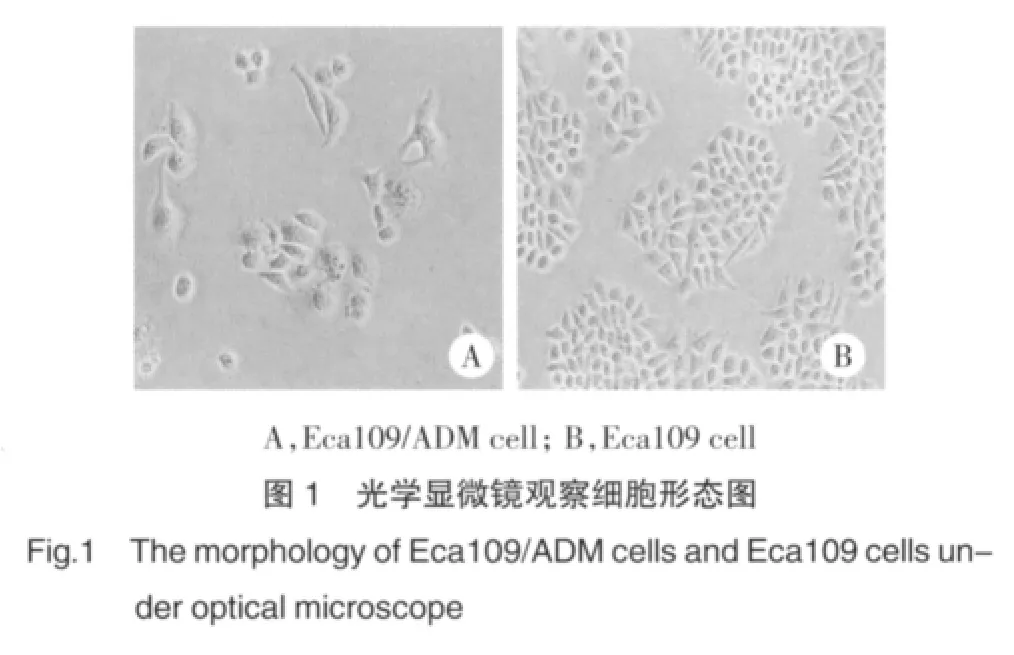
历时8个月,成功培养了耐药细胞株Eca109/ADM。与Eca109细胞相比,Eca109/ADM细胞体积变大,形态更不规则。见图1。
2.2 药敏实验
MTT方法检测,ADM药物作用Eca109/ADM细胞、Eca109细胞24 h,采用统计学软件SPSS11.5计算 IC50值,分别为15.45±1.15,4.69±0.88,耐药系数为3.29倍。
2.3 RT-PCR方法检测细胞中ABCG2mRNA的表达
Eca109、Eca109/ADM细胞中ABCG2mRNA的表达量分别为0.67±0.04、0.82±0.10,Eca109/ADM 细胞中ABCG2mRNA的表达显著增高(P<0.05)。
2.4 流式细胞术检测细胞中ABCG2蛋白的表达
Eca109/ADM细胞、Eca109细胞中ABCG2蛋白表达量分别为 659.88±10.60、628.25±12.49,Eca109/ADM细胞中ABCG2蛋白的表达量较Eca109细胞显著性增高(P<0.01)。
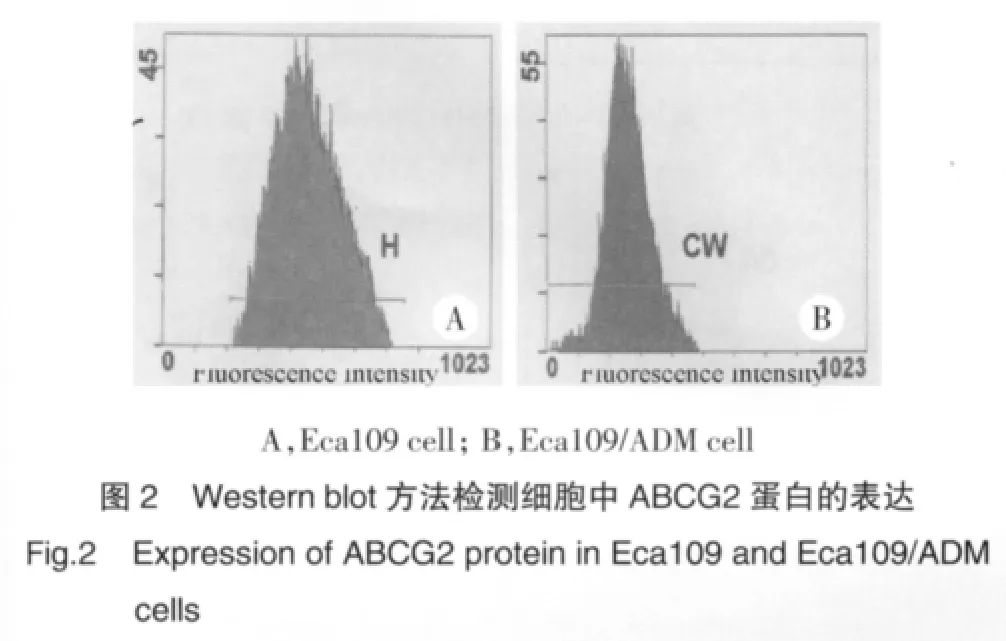
2.5 Western Blot方法检测细胞中ABCG2蛋白的表达
Eca109/ADM细胞中ABCG2蛋白的表达量较Eca109细胞增高,见图2。
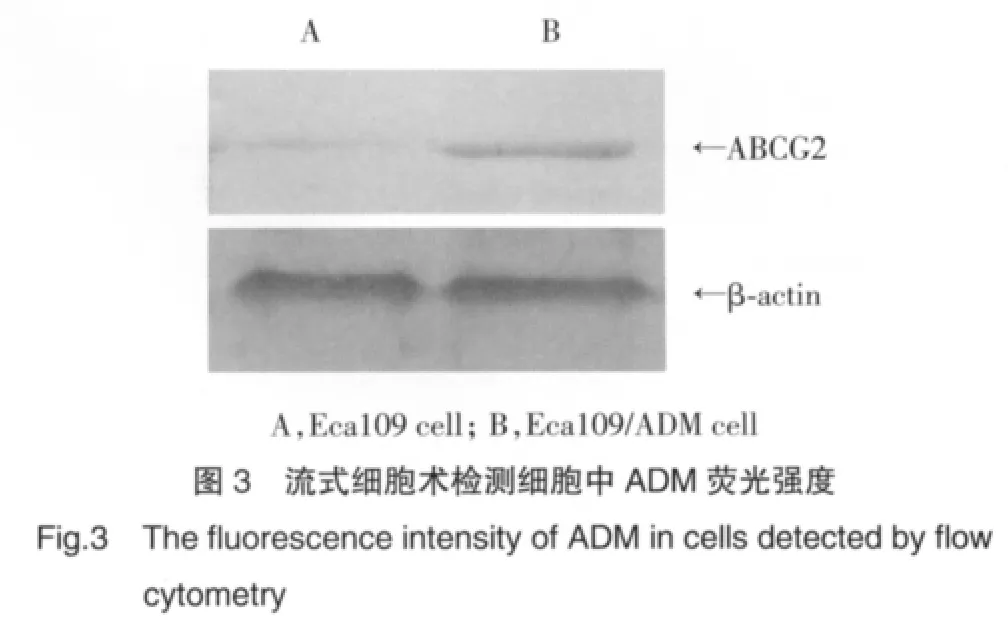
2.6 药物外排实验
Eca109/ADM细胞内ADM的含量与Eca109细胞内ADM的含量相比降低,Eca109/ADM细胞外排ADM的作用较Eca109细胞增加。见图3。
3 讨论
抗肿瘤药物产生耐药是导致肿瘤化疗达不到预期效果甚至失败的主要原因之一。ADM是蒽环类细胞毒抗生素,是一种广谱抗肿瘤药物,对多种肿瘤的治疗有较好的疗效,由于它的抗肿瘤活性强,所以在临床化疗中被广泛应用,占有重要地位。但是ADM具有很大的毒副作用和易产生耐药性的特点,严重影响了其在临床上的作用。要提高其临床疗效,需逆转肿瘤对其耐药。ABCG2是近来发现的与多药耐药相关的半转运蛋白,属ABC转运蛋白超家族成员之一[7~10],具有将化疗药物米托蒽醌、ADM等从肿瘤细胞泵出的作用,使肿瘤细胞产生耐药。
本研究采用药物浓度递增法,体外诱导耐药肿瘤细胞系Eca109/ADM,建立食管癌耐药细胞模型,研究ABCG2与食管癌耐药的关系。实验从ADM0.002 μg/ml浓度开始逐渐增加药物的浓度,最终使细胞在0.02 μg/ml ADM中稳定生长。药物浓度增长10倍,在此过程中细胞形态发生变化,细胞体积变大,形态变得更不规则。应用MTT方法检测到E-ca109/ADM细胞对ADM产生了耐药,耐药系数为3.29。接下来研究Eca109/ADM细胞的耐药机制,应用了多项实验技术检测Eca109/ADM细胞耐药因子的表达,发现ABCG2mRNA及蛋白在Eca109/ADM细胞中高表达,提示ABCG2参与了Eca109/ADM细胞耐药形成。同时我们还利用流式细胞技术检测了Eca109/ADM细胞外排药物作用,发现Eca109/ADM细胞外排ADM作用增加,提示Eca109/ADM细胞中高表达的ABCG2可以外排ADM,从而使Eca109/ADM细胞产生耐药。
综上研究,本实验所诱导的耐药细胞株Eca109/ADM是一个典型的具有ABCG2表型的耐药模型,并且高表达ABCG2。提示ABCG2有望成为食管癌耐药逆转治疗的新靶点。
[1]Diestra JE,Scheffer GL,Catala I,et al.Frequent expression of the multi-drug resistance-associated protein BCRP/MXR/ABCP/ABCG2 in human tumours detected by the BXP-21 monoclonal antibody in paraffin embedded material[J].J Pathol,2002,198(2):213-219.
[2]Robey RW,Medina-Perez WY,Nishiyama K,et al.Overexpression of the ATP-binding cassette half-transporter,ABCG2 (Mxr/BCrp/ABCP1),in flavopiridol-resistant human breast cancer cells[J].Clin Cancer Res,2001,7(1):145-152.
[3]Plasschaert SL,Van Der Klolk D,De Bont ES,et al.Breast cancer resistance protein(BCRP)in acute leukemia[J].Leuk Lymphoma,2004,45(4):649-654.
[4]刘亮,赵丽等.三磷酸腺苷结合转运蛋白G超家族成员2基因在食管癌中的表达及意义[J].中国医科大学学报,2008,37(6):776-778.
[5]Yang LY,Trujillo JM.Biological characterization of multidrug-resistant human colon carcinoma sublines induced/selected by two methods[J].Cancer Res,1990,50(11):3218-3225.
[6]Larbcharoensub N,Leopairat J,Sirachainan E,et al.Association between multidrug resistance-associated protein1and poor prognosis in patients with nasopharyngeal carcinoma treated with radiotherapy and concurrent chemotherapy[J].Hum Pathol,2008,39(6):837-845.
[7]Imai Y,Tsukahara S,Asada S,et al.Phytoestrogens/flavonoids reverse breast cancer resistance protein/ABCG2-mediated multidrug resistance[J].Cancer Res,2004,64(12):4346-4352.
[8]Tsunoda S,Okumura T,Ito T,et al.ABCG2 expression is an independent unfavorable prognostic factor in esophageal squamous cell carcinoma[J].Oncology,2006,71(3-4):251-258.
[9]Choudhuri S,Klaassen CD.Structure,function,expression,genomic organization,and single nucleotide polymorphisms of human ABCB1(MDR1),ABCC (MRP),and ABCG2 (BCRP)efflux transporters[J].Int J Toxicol,2006;25(4):231-259.
[10]Salphati L,Plise EG,Li G.Expression and activity of the efflux transporters ABCB1,ABCC2 and ABCG2 in the human colorectal carcinoma cell line LS513[J].Eur J Phamaco Sci,2009;37(3-4):463-468.
