葡萄糖氧化酶-过氧化物酶改良法的建立——血糖测定时间窗口的探讨
2010-11-29朱传江
朱传江,刘 苹
(中国医学科学院北京协和医学院药物研究所,北京 100050)
1 材料
1.1 动物 Wistar大鼠,♂,体质量240~280 g,购自中国医学科学院动物研究所实验动物中心,动物许可证号:SCXK(京)2005-0013。
1.2 试剂 链脲佐菌素(streptozotocin,STZ)、过氧化物酶和葡萄糖氧化酶,购自Sigma-Aldrich公司。柠檬酸、柠檬酸三钠、2-甲基苯胺和葡萄糖,购自北京化学试剂公司。草酸钾、三氯醋酸和4-氨基安替吡啉(4-AA),购自国药集团化学试剂有限公司。
1.3 仪器 紫外可见分光光度计,UV-2000型,尤尼科(上海)仪器有限公司产品。离心机,TGL-16G型,上海安亭科学仪器厂产品。pH计,Delta 320,梅特勒-托利多仪器(上海)有限公司产品。
2 方法与结果
2.1 溶液配制
2.1.1 柠檬酸-柠檬酸三钠溶液 总体积500 ml。准确称取柠檬酸0.7350 g,柠檬酸三钠13.620 g,加蒸馏水至500 ml,测pH值为6.11(范围在5.4~7.0内即可)。
2.1.2 GOD-POD溶液 总体积200 ml。准确称取4-AA 10 mg,加柠檬酸-柠檬酸三钠溶液199.7 ml,2-甲基苯胺0.05 ml,POD(1 040 IU·ml-1)0.125 ml,GOD(1 040 IU·ml-1)0.125 ml,4℃可保存1 wk,如显淡红色,不宜使用。
2.1.3 葡萄糖标准液 准确称取无水葡萄糖,用蒸馏水配成 3.75、7.5、15、30、60、120、240、480 mg·dl-1不同浓度的标准液,4℃保存,过夜后使用。
2.1.4 STZ溶液 浓度为55 mg·kg-1,用0.05 mol·L-1柠檬酸溶液(pH4.5)现配现用。
徐州境内河网交错,水系复杂。大运河傍城而过,故黄河贯穿东西,河道纵横贯通,水库星罗棋布;以故黄河为界,分沂沭泗、故黄河及濉安河三个水系。历史上徐州以战场、煤场、工厂著名,水资源匮乏,洪涝旱渍灾害频发,“水多、水少、水脏”问题突出。徐州市委、市政府立足市情水情,坚持把生态文明建设融入经济社会发展全过程。2011年市委、市政府明确提出要大力建设生态文明;2012年《徐州市生态市建设规划(2011—2015)》审议通过,确定了水生态文明建设的宏伟蓝图;徐州市“十二五”规划把绿色增长列为“六大发展战略”之一,对水生态文明建设进行了全面部署。
2.2 高血糖模型大鼠制备及血糖测定方法 取Wistar大鼠,腹腔注射新鲜配制的STZ溶液(浓度为55 mg·kg-1,注射体积为5 ml·kg-1),1 wk后测禁食3 h后的血糖,选取血糖值在180 mg·dl-1以上的模型大鼠用于GOD-POD改良法实验。
自模型大鼠内眦静脉丛取血,置凝集盘(1%草酸钾抗凝)中,取0.06 ml置于预先加有5%三氯醋酸0.36 ml的EP管中,混匀,离心3 000 r·min-1×10 min,取上清液0.1 ml置10 ml试管中(冰上操作),加入GOD-POD溶液2 ml,混匀。同时设空白对照管和标准样品管,前者以同体积的水代替血样,后者以同体积的系列葡萄糖标准溶液代替血样。各管37℃温浴30 min(显色反应),然后取出室温下(20~22)℃静置反应一定时间,于550 nm处测OD值,根据标准曲线求出血糖值。
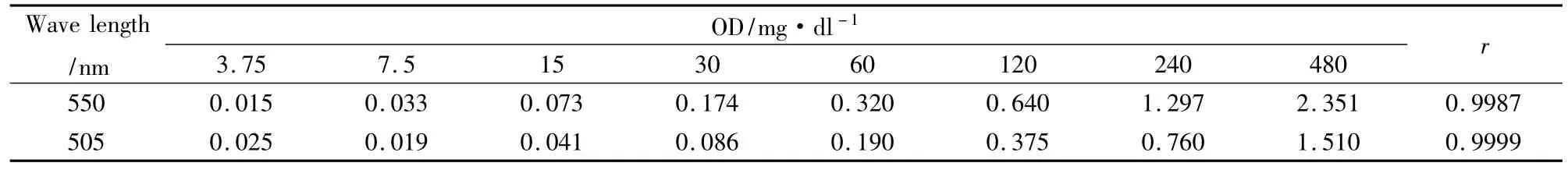
Tab 1 Effects of different wave lengths on the optical density of serial concentrations of glucose
Tab 2Effects of different GOD-POD concentrations on the optical density of serial concentrations of glucose(±s,n=3)

Tab 2Effects of different GOD-POD concentrations on the optical density of serial concentrations of glucose(±s,n=3)
GOD-POD concentration/IU·ml-1 OD/mg·dl-1 30 60 120 240 480 720r b 65 0.033±0.004 0.068±0.004 0.126±0.009 0.264±0.018 0.539±0.037 0.767±0.072 0.999 926.930 130 0.059±0.006 0.124±0.014 0.240±0.025 0.493±0.055 1.024±0.105 1.459±0.153 0.999 485.992 260 0.093±0.006 0.202±0.017 0.394±0.032 0.818±0.064 1.636±0.132 2.216±0.134 0.998 317.210 520 0.132±0.009 0.285±0.017 0.552±0.036 1.157±0.071 2.178±0.093 2.516±0.026 0.982 265.891 1 040 0.159±0.003 0.343±0.012 0.659±0.014 1.369±0.060 2.381±0.043 2.565±0.020 0.966 253.827
2.3 反应条件优化
2.3.1 不同波长对测定结果的影响 使用已知系列浓度的葡萄糖标准溶液及1 040 IU·ml-1GOD-POD溶液,按“2.2”项分别测定波长为550 nm和505 nm的OD值,求出OD值与血糖值的相关系数r,见Tab 1。
由Tab 1可看出波长为550 nm时,葡萄糖浓度在3.75~480 mg·dl-1范围内与OD值对应良好,随着葡萄糖浓度倍增,OD值也大致成倍递增,相关系数(r)达到0.999。而波长为505 nm时,葡萄糖浓度在15~480 mg·dl-1范围内与OD值对应良好,但低段3.75~7.5对应不好,提示用550 nm波长测定灵敏度高于用505 nm。故GOD-POD改良法以及本文以下实验中,测定波长均选用550 nm。
2.3.2 不同GOD-POD浓度对测定结果的影响 在GODPOD法测定样品葡萄糖含量时,酶的量需足够才能使葡萄糖完全氧化,故应对GOD和POD的浓度进行优化。按1∶1比例配制不同浓度的GOD-POD溶液,按“2.2”项测定系列浓度的葡萄糖标准溶液,其中温浴后室温静置时间为90 min。结果见Tab 2。
从 Tab 2 可见,GOD-POD 浓度分别为 65、130、260、520、1 040IU·ml-1时,葡萄糖浓度(30~720 mg·dl-1)与OD值大多对应良好,相关系数(r)为0.966~0.999,提示 GODPOD浓度取65 IU·ml-1或130 IU·ml-1已能满足对葡萄糖的氧化要求,且有较高的斜率(b)值。故下一步实验中,选择GOD-POD浓度为130 IU·ml-1,观察显色后室温放置不同时间(0~300 min)对高血糖模型大鼠血样测定结果的影响。
2.3.3 显色反应稳定时段的选择 取9只STZ诱导的糖尿病模型大鼠,从内眦静脉采血0.06 ml,5%三氯醋酸(0.36 ml)沉淀蛋白后离心取上清液0.15 ml,加入GOD-POD(130 IU·ml-1)溶液3 ml,温浴(37℃)30 min,取出室温放置 0、30、60、90、120、150、180、210、240、270、300 min,并分别在这些时间点测定 OD 值,依次求出0~90、30~120、60~150、90~180、120~210、150~240、180 ~270、210 ~300 min时间段OD均值和CV均值。结果见Tab 3。
Tab 3 Observation of a stable period of time for OD detection(GOD-POD:130 IU·ml-1;±s,n=9)
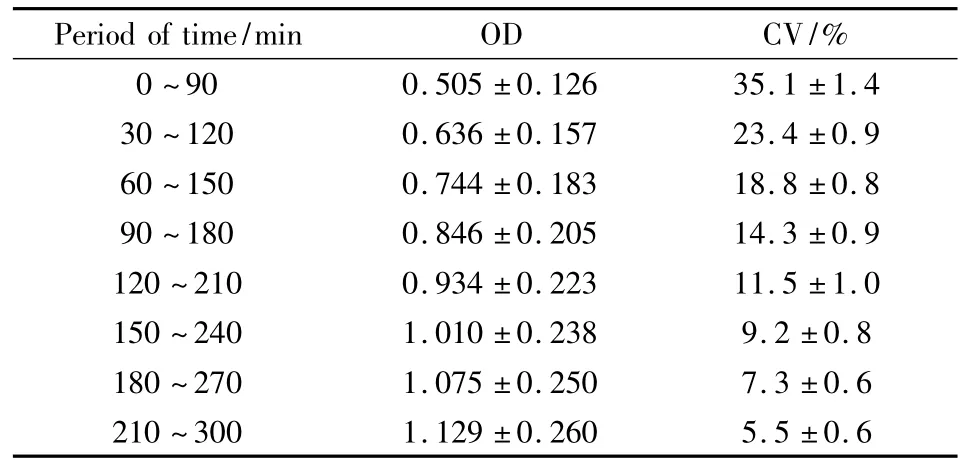
Tab 3 Observation of a stable period of time for OD detection(GOD-POD:130 IU·ml-1;±s,n=9)
Period of time/min OD CV/%0~90 0.505±0.126 35.1±1.4 30~120 0.636±0.157 23.4±0.9 60~150 0.744±0.183 18.8±0.8 90~180 0.846±0.205 14.3±0.9 120~210 0.934±0.223 11.5±1.0 150~240 1.010±0.238 9.2±0.8 180~270 1.075±0.250 7.3±0.6 210~300 1.129±0.260 5.5±0.6
Tab 3显示当酶浓度为130 IU·ml-1时,CV均值在5.5%以上,随着样品放置时间延长,OD均值逐渐增大,CV均值逐渐减小,5 h内没有相对稳定的测定区间。这提示酶浓度为130 IU·ml-1,虽然相关系数r值达到0.999、斜率(b)值达到486(Tab 2),酶用量节省,但操作中,由于缺乏显色相对稳定的时段(测定窗口),结果的准确性和组间可比性难以得到保证。因此,以下实验调整GOD-POD浓度为1 040 IU·ml-1,按上法测定不同时间段(90 min时长)的OD均值和CV均值,并重复3次实验,观察并选择显色稳定时段,结果见Tab 4。
Tab 4数据表明,当GOD-POD浓度为1 040 IU·ml-1时,CV均值从0~90 min时段到90~180 min时段逐渐减小,而从90~180 min时段到210~300 min时段逐渐增大,90~180 min时段最小,3次实验分别为 0.8%、0.9%、0.8%,也就是说这区间颜色变化相对较小,而且有90 min时长,便于完成对较大样本的测定。由此可见,1 040 IU·ml-1的GOD-POD浓度和反应管温浴后室温下放置90 min,并在90~180 min时段(时间窗口)内测定OD值较合适。
2.3.4 GOD-POD比例不同对测定结果的影响 GOD在第1步反应中催化葡萄糖生成葡萄糖酸和过氧化氢,其特异性很高,只针对β-D葡萄糖。而POD在第2步反应中,作用过氧化氢释放出氧,使4-AA与2-甲基苯胺氧化缩合,生成红色醌类化合物,其特异性较差[5],故需对二者的比例进行优化。取GOD和POD溶液,浓度均为1 040 IU·ml-1,分别按1∶1、1∶2、2∶1进行配制,按2.2项测定已知浓度的系列葡萄糖标准溶液OD值,并求出r值,结果见Tab 5。
结果显示,GOD和POD分别取1∶1、1∶2和2∶1比例时,测得的OD值和相关系数r值,几无差别,故将GOD和POD的比例选定为1∶1。
Tab 4Observation of a stable period of time for OD detection(GOD-POD:1 040 IU·ml-1;±s,n=9)

Tab 4Observation of a stable period of time for OD detection(GOD-POD:1 040 IU·ml-1;±s,n=9)
ND:not determined
Period of time/minⅠOD CV/%ⅡOD CV/%ⅢOD CV/%0~90 1.735±0.344 9.0±1.7 1.736±0.386 10.9±2.2 1.768±0.353 10.8±2.1 30~120 1.825±0.354 4.3±1.0 1.844±0.397 4.5±1.1 1.876±0.363 4.3±0.9 60~150 1.867±0.358 1.6±0.5 1.892±0.401 1.8±0.8 1.918±0.367 1.6±0.6 90~180 1.877±0.358 0.8±0.3 1.907±0.402 0.9±0.6 1.929±0.368 0.8±0.4 120~210 1.865±0.356 1.6±0.5 1.909±0.402 0.9±0.3 1.921±0.368 1.3±0.4 150~240 1.840±0.354 2.4±0.5 1.897±0.402 1.5±0.5 1.898±0.368 2.1±0.8 180~270 ND ND 1.874±0.401 2.1±0.8 1.867±0.366 2.6±0.8 210~300 1.775±0.346 3.2±0.7 1.844±0.399 2.7±1.0 1.828±0.364 3.1±1.0
Tab 5Effects of the different proportion of GOD to POD on the optical density of serial concentrations of glucose(±s,n=3)

Tab 5Effects of the different proportion of GOD to POD on the optical density of serial concentrations of glucose(±s,n=3)
GOD ∶POD OD/mg·dl-1 30 60 120 240 480r 1∶1 0.151±0.002 0.253±0.002 0.640±0.012 1.218±0.013 2.487±0.012 0.9996 1∶2 0.142±0.003 0.241±0.002 0.600±0.004 1.176±0.047 2.479±0.009 0.9995 2∶1 0.155±0.001 0.260±0.001 0.652±0.005 1.237±0.003 2.510±0.005 0.9996
2.3.5 线性范围 配制葡萄糖系列标准溶液:720,480,240,120,60,30,15,7.5,3.75 mg·dl-1,以 GOD-POD 改良法测定其OD值,每一浓度测定3次,取均值,绘制葡萄糖浓度对OD值的曲线,见Fig 1。

Fig 1 Curve of glucose concentration-optical density
Fig 1显示,GOD-POD改良法在3.75~480 mg·dl-1葡萄糖标准液范围内线性良好,此段线性方程为Y=199.267X-3.043,r值为0.998,能满足血糖实测需求。
3 讨论
通过对血糖测定中一些重要影响因素的优化,我们在林志共等[4]建立的小鼠血糖GOD-POD原法的基础上,建立了大鼠血糖GOD-POD改良法。改良法在GOD和POD的浓度及比例、血糖测定窗口、线性范围等方面都较原法有了较大改进。
GOD-POD浓度和测定窗口选择在原法中,GOD的浓度为30 IU·ml-1,而POD的浓度在文献中没有明确[4]。我们按1∶1考察了GOD和POD从65~1 040 IU·ml-1不同浓度对血糖测定结果的影响。发现GOD和POD的浓度为65 IU·ml-1已能完成对大鼠血样中葡萄糖的氧化,可获得非常好的相关系数r值和斜率b值(Tab 2)。调整GOD和POD的浓度为2∶1或1∶2,对测定的结果影响不大(Tab 5)。至此,GOD和POD的浓度似应选择65 IU·ml-1或130 IU·ml-1以节省酶的用量。但继而进行的显色反应后OD测定时段的选择实验表明,65 IU·ml-1或130 IU·ml-1的GOD和POD浓度并不合适。这是因为显色反应后没有相对稳定的OD测定区间(Tab 3)。
对于一个样本数达到50~100管的血糖测定实验,在显色反应相对稳定的时段(即测定窗口,约需60~90 min)内进行OD测定,才能保证结果的准确性和组间可比性。当GOD和POD的浓度为130 IU·ml-1时,从0~300 min(室温静置时间)OD值一直在增加,时段CV值最小在5%以上,其中90~180 min时段的CV值高达14.3%(Tab 3),没有出现一个显色反应相对稳定区间以供测定。这可能由于酶量低与底物反应速度达到终点较慢所致。当GOD和POD的浓度为1 040 IU·ml-1时,90~180 min时段的 CV值最小(0.846% ±0.205%,n=3,见 Tab 4),这是一个时长为90 min的显色相对稳定区间,基本能满足较大样本的OD测定。这时的酶量较大,催化底物较快达到反应终点,因而出现显色相对稳定区间。这点与原法大不相同。原法要求在显色后室温放置60 min内比色完毕[4]。而本研究对高血糖样品测定表明,在GOD和POD的浓度为1 040IU·ml-1时,OD值在0~90 min内的CV高达9%以上(Tab 4),因此如果在显色后室温放置60 min内进行比色测定,则无法保证结果的准确性和组间可比性。其原因可能在于原法测定的是正常小鼠血糖,而改良法测定的是糖尿病模型大鼠血糖。这提示不同来源的血样,正常的或病理的,其中的葡萄糖含量不同,所需的GOD-POD浓度不同,测定窗口将随之发生变化。这也说明研究针对于不同动物(包括大鼠和小鼠、正常和病理)的血糖测定方法是有必要的。另外,在药理学研究方法的代表性专著[6-7]、相关文献报道以及市售血糖测定试剂盒说明书中,作者尚未见对血糖测定窗口的记述。因此本文对这一窗口的详细探索和确定,为血糖测定方法的完善提供了宝贵的资料。
方法学考查原法显示葡萄糖浓度在5~30 mg·dl-1范围相关系数r值达到0.999。改良法大大拓宽了线性范围,在3.75~480 mg·dl-1范围内线性关系良好,相关系数值达0.998(Fig 1);在3.75~720 mg·dl-1范围内,相关系数值略有降低,为0.966(Tab 2)。该浓度范围基本覆盖了糖尿病模型大鼠的高血糖水平。同时,改良法的血糖最低检测浓度可达3.75 mg·dl-1(Tab 1),日间变异小于4%,这些说明改良法具有较高的灵敏度和精确度。此外,改良法中模型大鼠血样中的葡萄糖值在5 d内基本稳定,GOD-POD溶液在14 d内稳定可用(4℃,结果未显示)。实测结果表明,改良法能满足糖尿病模型大鼠血糖测定的要求。这无疑将对糖尿病的防治和降糖药物的研发产生积极的作用。
[1]王连明,辛晓敏,刘晓民,等.血糖测定的影响因素研究[J].中国实验诊断学,2006,10(11):1345-7.
[1]Wang L M,Xin X M,Liu X M,et al.The study of inference factors on glucose determination[J].Chin J Labor Diagn,2006,10(11):1345-7.
[2]李凤华.葡萄糖氧化酶法与己糖激酶法测定血糖的比较[J].四川省卫生管理干部学院学报,1994,13(4):18-22.
[2]Li F H.A comparison of GOD-POD method and HK method for blood glucose measurement[J].J Sichuan Contin Educat Coll MS,1994,13(4):18-22.
[3]国家药典委员会.中华人民共和国药典(2005年版,二部)[S].北京:化学工业出版社,2005:附录104.
[3]Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia.2005,VolumeⅡ[S].Beijing:Chemical Industry Press,2005:Appendix 104.
[4]林志共,刘群丽,郭 红,等.用小鼠血糖法测定胰岛素生物效价的探讨-用葡萄糖氧化酶法测定小鼠血糖值[J].药物分析杂志,1985,5(6):333-5.
[4]Lin Z G,Liu Q L,Guo H,et al.Bioassay of insulin by the estimation of blood suger in mice[J].Chin J Pharm Analys,1985,5(6):333-5.
[5]周丽萍,姜旭淦,徐 军.葡萄糖脱氢酶法测定血清葡萄糖的方法学评价[J].江苏大学学报(医学版),2006,16(4):301-3,316.
[5]Zhou L P ,Jiang X G,Xu J.Evaluation of glucose dehydrogenase method for determination of serum glucose[J].J Jiangsu Univ(Med Ed),2006,16(4):301-3,316.
[6]乔凤霞.血糖与血脂测定[M]//张均田主编.现代药理实验方法..北京:北京医科大学中国协和医科大学联合出版社,1998:1000-3.
[6]Determination of blood glucose and lipid[M]//Zhang JT,chief editor.ModernMethods for Pharmacological Experiments.Beijing:Joint Press House of BMU& PUMC,1998:1000-3.
[7]林志彬.常用血糖测定法[M]//徐叔云,卞如濂,陈修主编.药理实验方法学.第3版.北京:人民卫生出版社,2005:1523-5.
[7]Lin Z B.Regular method for determination of blood glucose[M]//Xu S Y,Bian R L,Chen X,chief editors.Methodology of Pharmacological Experiments.3rd ed.Beijing:People′s Medical Publishing House,2005:1523-5.
