壳寡糖抗小鼠脑缺血/再灌注作用研究
2010-11-29孙雅煊戴雪伶高兆兰郑秋生姜招峰
孙雅煊,刘 婷,戴雪伶,高兆兰,魏 荣,郑秋生,姜招峰
壳寡糖(chitooligosaccharides,COS),系指由甲壳素或壳聚糖经水解后产生的一类聚合度低且可溶于水的氨基糖类化合物,可被机体吸收利用。壳寡糖不仅具有甲壳素和壳聚糖相似的性质,而且一些生理活性或功能更为明显,甚至显示出甲壳素和壳聚糖所不具备的生理活性[1]。
国内外研究表明,壳寡糖具有抗氧化、神经保护、抗肿瘤、抗炎、抗菌、抗感染等多种药理作用。虽已有多位学者证实[2-10]壳寡糖的神经保护活性,但绝大部分实验仅局限于细胞水平,很少有研究者在整体水平探讨其活性。壳寡糖能通过血脑屏障[11],而且脑缺血后血脑屏障的通透性增加[12],故我们推测壳寡糖能有效地进入大脑,治疗脑血管疾病。
本研究采用线栓法建立小鼠大脑中动脉栓塞模型,旨在验证灌胃给予壳寡糖是否具有抗脑缺血/再灌注损伤作用,并探讨其可能机制,为将壳寡糖开发成神经保护剂提供整体水平的依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 ♂ ICR小鼠,体质量25~28 g,北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-001。自然光照周期饲养,术前12 h禁食,自由饮水。
1.1.2 药品及试剂 壳寡糖(纯度≥90%,平均分子质量1 500,脱乙酰度≥90%):北京联合大学生物化学工程学院;红四氮唑(2,3,5-triphenyltetrazolium chloride,TTC):北京拜尔迪生物技术有限公司;丙二醛(MDA)、羰基、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽-过氧化物酶(GSH-Px)、考马斯亮兰试剂盒:南京建成生物工程研究所;其它试剂均为国产分析纯。
1.1.3 实验仪器 水浴锅:北京市长风仪器仪表公司;多功能酶标仪:Sigma公司;TGL 16M离心机:湖南凯达科学仪器有限公司;涡旋混合器:金坛市医疗器械厂。
1.2 方法
1.2.1 动物分组及给药 将小鼠随机分为6组,即假手术组、模型组、依达拉奉(3 mg·kg-1,阳性对照药)组及壳寡糖高、中、低剂量(200、100、50 mg·kg-1)组。药物用前溶于蒸馏水,按照10 ml·kg-1体质量灌胃给药,每天1次,连续7 d,末次给药后1 h制备脑缺血/再灌注模型。
1.2.2 局灶性脑缺血/再灌注模型的制备[13-15]采用线栓法制备小鼠左侧大脑中动脉栓塞模型。用4%水合氯醛(400 mg·kg-1)腹腔注射,麻醉小鼠,颈部皮肤去毛消毒后作正中切口,分离出左侧颈总动脉、颈内动脉和颈外动脉,结扎颈外动脉,在颈总动脉上开一小口,将一头端用硅橡胶包裹的直径为0.11 mm的鱼线沿颈总动脉,经颈内动脉向颅内插至大脑中动脉分叉处,插入深度约12~13 mm,结扎颈内动脉和颈总动脉,固定鱼线,缝合皮肤。缺血2 h后将鱼线拉出至颈内外动脉分叉处,即实现再灌注。假手术组仅分离颈总动脉、颈外动脉和颈内动脉,但不插入鱼线。小鼠苏醒后出现手术对侧肢体运动障碍即为模型制备成功。
1.2.3 神经功能缺陷评分 参照Longa的5分制评分标准进行神经功能缺陷评分。0分:正常,无神经损伤症状;l分:不能完全伸展对侧前爪;2分:提尾后向外侧转圈;3分:行走时向对侧倾倒;4分:不能自发行走或意识丧失。
1.2.4 脑梗死面积测定 缺血2 h再灌22 h后,迅速将小鼠断头,取出完整前脑,冠状切成1.5 mm厚的脑片,于0.5%TTC溶液中37℃水浴孵育15 min。然后置于10%的中性甲醛溶液中固定。对每脑片正反两面进行扫描,用图像分析软件Photoshop 6.0求出梗死区和非梗死区面积。
1.2.5 生化指标测定 小鼠断头取脑,去除嗅脑、脑干、小脑后将大脑分别置于匀浆器中,用冰生理盐水按质量与体积比为1∶9的比例冰浴下制备成体积分数为10%的脑组织匀浆,立即放入-20℃冰箱中保存。按照南京建成生物工程研究所提供的试剂盒说明书测定脑组织中MDA、羰基含量、SOD、CAT及GSH-Px活性。蛋白质含量采用考马斯亮蓝法测定。
1.2.6 统计学处理 采用 SPSS13.0 For Windows统计软件进行分析。实验数据均以±s表示,多组间数据比较采用单因素方差分析,两组间数据比较采用t检验。
2 结果
2.1 壳寡糖对脑缺血/再灌注小鼠神经功能缺陷评分和脑梗死面积的影响 从Fig 1及Fig 2可以得知,脑缺血/再灌注后,模型组和给药组小鼠显现出明显的神经功能缺陷症状、脑组织梗死。壳寡糖呈剂量依赖性地降低神经功能缺陷评分和脑梗死面积,尤其是壳寡糖高、中剂量(200、100 mg·kg-1)组与模型组差异有显著性(P<0.05或P<0.01)。
2.2 壳寡糖对脑缺血/再灌注小鼠MDA和羰基含量的影响 Fig 3和Fig 4中数据显示脑缺血/再灌注后,模型组MDA和羰基含量明显增多,与假手术组比较差异有显著性(P<0.01),表明脑组织遭受严重的氧化损伤。壳寡糖高、中剂量组的MDA和羰基含量减少,与模型组相比差异有显著性(P<0.05或P<0.01)。
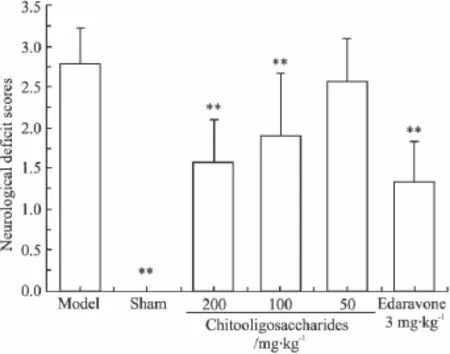
Fig 1 Effect of chitooligosaccharides on neurological deficit scores in mice subjected to cerebral ischemia/reperfusion(±s,n=9)**P <0.01 vs model group.
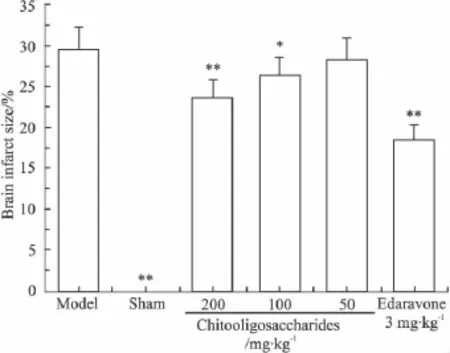
Fig 2 Effect of chitooligosaccharides on brain infarct size in mice subjected to cerebral ischemia/reperfusion(±s,n=9)*P <0.05,**P <0.01 vs model group.

Fig 3 Effect of chitooligosaccharides on MDA content in mice subjected to cerebral ischemia/reperfusion(±s,n=9)**P <0.01 vs model group.
2.3 壳寡糖对脑缺血/再灌注小鼠抗氧化物酶活性的影响 Tab 1中结果显示,模型组小鼠脑组织中SOD、CAT及GSH-Px活性低于假手术组,说明缺血/再灌注引起自由基过度增加,消耗更多的抗氧化物酶。壳寡糖高剂量(200 mg·kg-1)组与模型组比较,3种抗氧化物酶活性均增加,差异有显著性(P<0.01)。壳聚糖各剂量组与模型组相比较,3种抗氧化物酶活性呈剂量依赖性的上升。
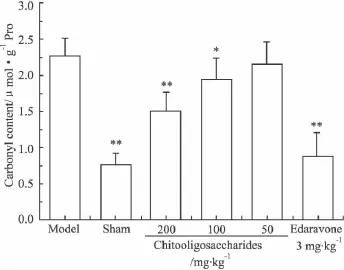
Fig 4 Effect of chitooligosaccharides on carbonyl content in mice subjected to cerebral ischemia/reperfusion±s,n=9)*P <0.05,**P <0.01 vs model group.
Tab 1 Effect of chitooligosaccharides on antioxidant enzyme activities in mice subjected to cerebral ischemia/reperfusion± s,n=9)
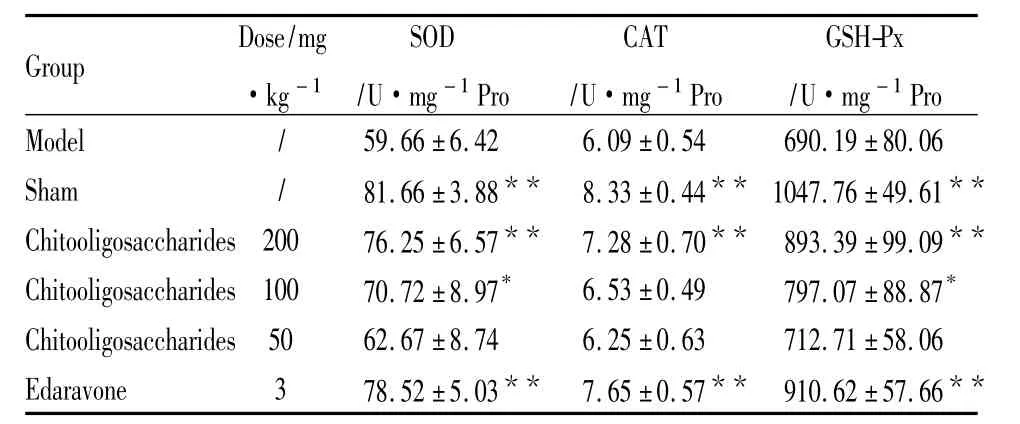
Tab 1 Effect of chitooligosaccharides on antioxidant enzyme activities in mice subjected to cerebral ischemia/reperfusion± s,n=9)
*P <0.05,**P<0.01 vs model group.
Group Dose/mg·kg-1 SOD/U·mg-1Pro CAT/U·mg-1Pro GSH-Px/U·mg-1Pro Model / 59.66 ±6.42 6.09 ±0.54 690.19 ±80.06 Sham / 81.66 ±3.88** 8.33 ±0.44** 1047.76±49.61**Chitooligosaccharides 200 76.25±6.57** 7.28±0.70** 893.39±99.09**Chitooligosaccharides 100 70.72 ±8.97* 6.53 ±0.49 797.07 ±88.87*Chitooligosaccharides 50 62.67 ±8.74 6.25 ±0.63 712.71 ±58.06 Edaravone 3 78.52±5.03** 7.65±0.57** 910.62±57.66**
3 讨论
脑血管疾病是人类三大死亡原因之一,严重危害人类的健康[16]。近年来,糖类物质被证实具有治疗脑血管疾病作用[17]。壳寡糖是天然糖中唯一大量存在的碱性氨基寡糖,水溶性好,安全无毒,容易被机体吸收,很有可能在抗脑缺血/再灌注损伤中有出色的表现[18]。本研究通过建立的小鼠局灶性脑缺血/再灌注模型,首先观察到壳寡糖高、中剂量(200、100 mg·kg-1)组明显改善小鼠神经功能缺陷,降低脑梗死面积,与模型组差异有显著性(P<0.05或P<0.01)。验证了壳寡糖能有效地通过血药屏障,发挥其神经保护作用。
脑缺血/再灌注可引起脑内氧化应激,造成脂质、蛋白质等生物大分子氧化损伤。本研究结果显示壳寡糖高、中剂量(200、100 mg·kg-1)组可降低脑缺血/再灌注小鼠脑组织中氧化产物MDA和羰基的含量,与模型组相比差异有显著性(P<0.05或P<0.01),原因可归于以下几点。
壳寡糖能有效地清除脑组织内的羟自由基、超氧阴离子及过氧化氢等自由基,一是因为壳寡糖能提供正电子与自由基反应,将自由基转化为更为稳定的产物,从而终止自由基链式反应;二是由于壳寡糖形成分子内氢键能力较弱,羟基和氨基容易被激活,有利于清除自由基[19-21]。
脑缺血过程中,局部脑组织金属离子沉积引起活性氧生成增多[22]。由于壳寡糖分子中羟基、氨基及酰氨基等基团的存在,它可以依靠氢键或盐碱形成具有类似网状结构的笼形分子,从而能有效地螯合金属离子,抑制金属离子催化自由基的生成[23]。徐魏等[11]就曾报道壳寡糖能螯合Cu等过渡态金属离子,并能清除人体自由基。此外,本实验数据表明,与模型组相比,壳寡糖高剂量(200 mg·kg-1)组可明显提高脑缺血/再灌注小鼠脑组织内SOD、CAT和GSH-Px活性(P<0.01)。这3种抗氧化酶作为体内第一道抗氧化防御系统,其活性的上调可催化更多的自由基转化为非毒性物质。
综上所述,壳寡糖对脑缺血/再灌注损伤具有拮抗作用,与其抗氧化活性有关。
本实验仅在体内初步证实了壳寡糖能减轻脑缺血所致氧化损伤,至于壳寡糖如何通过血脑屏障,壳寡糖在脑内的分布以及筛选合适分子量的壳寡糖等工作,还有待进一步开展。
[1]魏新林,夏文水.甲壳低聚糖的生理活性研究进展[J].中国药理学通报,2003,19(6):614 -7.
[1]Wei X L,Xia W S.Research development of chitooligosaccharides physiological activities[J].Chin Pharmacol Bull,2003,19(6):614-7.
[2]Sun R,Yao Q,Zhou D,et al.Antioxidant activity of N-carboxymethyl chitosan oligosaccharides[J].Bioorg Med Chem Lett,2008,18(21):5774-6.
[3]Khodagholi F,Eftekharzadeh B,Maghsoudi N,et al.Chitosan prevents oxidative stress-induced amyloid beta formation and cytotoxicity in NT2 neurons:involvement of transcription factors Nrf2 and NF-kappaB[J].Mol Cell Biochem,2010,337(1 -2):39 -51.
[4]Jiang M,Zhuge X,Yang Y,et al.The promotion of peripheral nerve regeneration by chitooligosacharides in the rat nerve crush injury model[J].Neurosci Lett,2009,454(3):236 -43.
[5]Yang Y,Liu M,Gu Y,et al.Effect of chitooligosaccharide on neuronal differentiation of PC-12 cells[J].Cell Biol Int,2009,33(3):352-6.
[6]Shen K T,Chen M H,Chan H Y,et al.Inhibitory effects of chitooligosaccharides on tumor growth and metastasis[J].Food Chem Toxicol,2009,47(8):1864 -71.
[7]Yoon H J,Moon M E,Park H S,et al.Chitosan oligosaccharide(COS)inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J].Biochem Biophys Res Commun,2007,358(3):954-9.
[8]Lee B C,Kim M S,Choi S H,et al.In vitro and in vivo antimicrobial activity of water-soluble chitosan oligosaccharides against vibrio vulnificus[J].Int J Mol Med,2009,24(3):327 -33.
[9]Moon J S,Kim H K,Koo H C,et al.The antibacterial and immunostimulative effect of chitosan-oligosaccharides against infection by staphylococcus aureus isolated from bovine mastitis[J].Appl Microbiol Biotechnol,2007,75(5):989 - 98.
[10]Zhou S,Yang Y,Gu X,et al.Chitooligosaccharides protect cultured hippocampal neurons against glutamate-induced neurotoxicity[J].Neurosci lett,2008,444(3):270 - 4.
[11]徐 魏,戴雪伶,黄汉昌,等.壳寡糖与Aβ-Cu复合物相互作用的研究方法[J].北京联合大学学报(自然科学版),2009,23(4):47-51.
[11]Xu W,Dai X L,Huang H C,et al.Chitooligosaccharides remove Cu from Alzheimer amyloid β peptides-Cu comples:experimental methods[J].J Beijing Union Univ(Nat Sci),2009,23(4):47 -51.
[12]雷军荣,秦 军,张 晶,等.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响[J].中国药理学通报,2010,26(1):120-3.
[12]Lei J R,Qin J,Zhang J,et al.Effects of curcumin on inflammatory reaction and blood-brain barrier permeability in rats following cerebral ischemic injury[J].Chin Pharmacol Bull,2010,26(1):120-3.
[13]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[14]杨立朝,杨武双,周 宇,等.油酰乙醇胺对小鼠局灶性脑缺血的保护作用[J].中国药理学通报,2009,25(9):1219 -23.
[14]Yang L C,Yang W S,Zhou Y,et al.Protective effect of oleoylethanolamide on focal cerebral ischemia in mice[J].Chin Pharmacol Bull,2009,25(9):1219 -23.
[15]刘珊丽,刘宗文,卢沛琦,等.儿茶素对大鼠脑缺血/再灌注损伤的保护作用及机制[J].中国药理学通报,2010,26(2):255-7.
[15]Liu S L,Liu C W,Lu P Q,et al.Protective effects of catech in cerebral ischem ia-reperfusion injury in rats and its mechanism[J].Chin Pharmacol Bull,2010,26(2):255 -7.
[16]Graham S M,McCullough L D,Murphy S J.Animal models of ischemic stroke:balancing experimental aims and animal care[J].Comp Med,2004,54(5):486 -96.
[17]黄忠仕,焦 杨,张士军,等.龙眼参多糖对SAMP8鼠脑组织痴呆相关基因表达的影响[J].中国药理学通报,2008,24(4):509-12.
[17]Huang Z S,Jiao Y,Zhang S J,et al.Effect of LYS polysaccharides on dementia-related gene expressions in SAMP8 mouse brain[J].Chin Pharmacol Bull,2008,24(4):509 -12.
[18]乔 莹,白雪芳,杜昱光.壳寡糖医药保健功能的研究进展[J].中国生化药物杂志,2008,29(3):210 -3.
[18]Qiao Y,Bai X F,Du Y G,et al.Research advances of chitosan oligosaccharides on keeping healthy[J].Chin J Biochem Pharmaceu,2008,29(3):210 -3.
[19]Feng T,Du Y,Li J,et al.Antioxidant acitivity of half N-acetylated water-soluble chitosan in vitro[J].Eur Food Res Technol,2007,225:133-8.
[20]Je J Y,Park P J,Kim S K.Radical scavenging activity of hetero-chitooligosaccharides[J].Eur Food Res Technol,2004,219:60 - 5.
[21]Sun T,Zhou D X,Xie J L,et al.Preparation of chitosan oligomers and their antioxidant activity[J].Eur Food Res Technol,2007,225:451-6.
[22]马慧娟,王立轩,马会杰,等.三羟异黄酮抑制大鼠脑缺血铜蓝蛋白的时相变化[J].中国药理学通报,2009,25(9):1164 -7.
[22]Ma H J,Wang L X,Ma H J,et al.Genistein inhibits the time coursed expression changes of ceruloplasmin in rats of focal cerebral ischemia[J].Chin Pharmacol Bull,2009,25(9):1164 -7.
[23]雷永亮,孙 伟,王海玉.低分子量水溶性壳聚糖与Cu(Ⅱ)、Zn(Ⅱ)配合物的光谱分析[J].青岛科技大学学报,2003,24(1):31-3.
[23]Lei Y L,Sun W,Wang H Y.Spectrum studies of the water-soluble low-molecular weight chitosan complexes with copper(Ⅱ)and zinc(Ⅱ)[J].J Qingdao Univ Sci Technol,2003,24(1):31 -3.
