鹿茸血肽疏水性分离及抗氧化和ACE抑制作用的研究
2010-11-24任建东施用晖1乐国伟1马立芹尹晓平
任建东,施用晖1,,乐国伟1,*,马立芹,尹晓平,姜 红
1江南大学食品科学与技术国家重点实验室;2江南大学食品学院营养与食品安全研究所,无锡 214122
鹿茸血肽疏水性分离及抗氧化和ACE抑制作用的研究
任建东2,施用晖1,2,乐国伟1,2*,马立芹2,尹晓平2,姜 红2
1江南大学食品科学与技术国家重点实验室;2江南大学食品学院营养与食品安全研究所,无锡 214122
实验采用DA201-C型大孔吸附树脂对 Alcalase蛋白酶水解鹿茸血 3 h的水解液进行吸附,采用 25%、50%、75%、100%乙醇分级洗脱,收集各组分进行氨基酸组成分析,发现各洗脱组分具有不同疏水性值,同时测定各组分的血管紧张素转化酶(ACE)抑制活性和二苯代苦味肼基自由基 (DPPH·)清除活性:75%乙醇洗脱组分的ACE抑制活性最高,为 54.71%,且ACE抑制活性与组分疏水性值显著相关;100%乙醇洗脱组分的 DPPH ˙清除率最高。
鹿茸血;大孔吸附树脂;疏水性;ACE抑制活性;DPPH自由基
大孔树脂分离纯化技术是 20世纪 60年代末发展起来的一类新型非离子型高分子吸附剂,具有分离条件温和、设备简单、操作方便、容易再生等特点,已广泛应用于环保、化工、医药等行业。关于大孔吸附树脂用于制药及天然植物中活性成分如皂苷、黄酮、内脂、生物碱等大分子化合物的提取分离已有大量报道[1],而近年来程云辉[2]、钟芳[3]、过振宇[4]、Cheison[5]等利用大孔吸附树脂分级纯化大豆肽、麦胚肽、家蝇抗菌肽、乳清蛋白水解物,得到不同生物活性的组分,将大孔吸附树脂的应用拓展到新的领域。
大孔吸附树脂主要通过分子间作用力如范德华力或氢键等对溶液中的分子进行吸附,吸附剂表面的亲水性或者疏水性决定了其具有不同的吸附特性;同时本身的多孔性结构亦决定了其具有一定的分子筛作用。因此根据大孔树脂的极性、孔径等吸附特性,配合不同极性的洗脱剂洗脱,可以分离纯化得到不同极性,即不同疏水性的组分[2-5],这对于生物活性肽的分离制备具有重要意义,因为目前已知大部分多肽的生物活性均与疏水性氨基酸密切相关[5]。因此,本实验采用具有多种生物活性的鹿茸血[7]酶解物经DA201-C型大孔吸附树脂,以乙醇为洗脱剂进行梯度洗脱,计算各组分疏水性值并研究其与抗氧化和ACE抑制活性的关系。
1 材料与方法
1.1 仪器与试剂
鹿茸血 (新疆特丰药业集团);Alcalase FG 2.4L (Novo公司);DA201-C型大孔吸附树脂 (江苏苏青水处理工程集团有限公司);ACE(sigma公司); Multiskan MK3酶标仪 (美国 Thermo公司);Agilent1100型氨基酸自动分析仪(美国安捷伦公司)。
1.2 鹿茸血肽的制备
在鹿茸血中加入适量蒸馏水,配制成 50 mg/mL底物,于沸水浴加热 10 min,冷却至 60℃,用 2 mol/ L NaOH溶液调节 pH值等于 9.0,按照 30μL/g底物蛋白的比例加入 Alcalase蛋白酶酶液进行反应, Alcalase蛋白酶活力为 1.10×104U/mL。不断滴加2 mol/L NaOH溶液维持 pH值稳定。水解过程在酶解器中进行,保持温度稳定在 60℃。3 h后停止反应,沸水浴 10 min后迅速冷却灭酶,4000 rpm离心20 min取上清液备用。最终水解度为 13.80%。
1.3 DA201-C大孔树脂分级洗脱上样浓度和流速的确定
将一定量的树脂用无水乙醇浸泡 24 h,然后用无水乙醇洗至 220 nm无吸收峰,再用去离子水洗净,装满 2.6 cm×30 cm的层析柱。
不同流速对 DA201-C大孔树脂吸附性能的影响:室温条件下,用浓度为 10 mg/mL的水解液以0.5、1、2 BV/h的速度流经层析柱,用紫外检测器检测流出液的A220 nm,以A220 nm=0.05为穿透点,比较不同流速时的穿透体积。
不同浓度对DA201-C大孔树脂吸附性能的影响:用浓度为 10、30、50 mg/mL的水解液以 0.5 BV/ h的速度流经层析柱,用紫外检测器检测流出液的A220 nm,以A220 nm=0.05为穿透点,比较不同流速时的穿透体积。
1.4 鹿茸血肽的大孔吸附树脂动态乙醇分级洗脱
室温条件下,用浓度为 50 mg/mL的鹿茸血肽以0.5 BV/h的流速流经层析柱,用紫外检测器检测流出液的A220 nm,以A220 nm=0.05为穿透点,停止上样。用去离子水洗去未吸附的物质,之后分别用25%、50%、75%、100%的乙醇以 2 BV/h的流速流经层析柱,当 A220 nm吸光值小于 0.05的时候停止洗脱。收集各洗脱峰。旋转蒸发后冷冻干燥,测定各组分的ACE抑制活性及DPPH·清除活性。
1.5 DPPH·清除活性的测定
取样品 0.4 mL,加入 1×10-4mol/L DPPH·无水乙醇 2.8 mL混匀,避光反应 20 min,4000 rpm离心 10 min,取上清夜在 517 nm测吸光度,样品的吸光度为Ai;空白组用等体积的无水乙醇代替 DPPH ·无水乙醇溶液,吸光度为 Aj;对照组用等体积的蒸馏水代替样品,吸光度为Ao。

1.6 ACE抑制率的测定
采用 Guang-Hong L等[8]人的马尿酸直接比色法。
1.7 氨基酸组成分析
氨基酸自动分析仪法,按照国家标准进行测定。
1.8 蛋白质或多肽疏水值的计算[9]
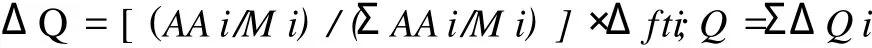
式中:AAi为 100 g蛋白质中各种氨基酸的含量(g);M i为各种氨基酸的摩尔质量 (g/mol);ΣAAi/ M i为 100 g蛋白质中氨基酸的总摩尔数 (mol);Δfti为氨基酸侧链疏水性值 (kJ/mol);ΔQ为蛋白质的疏水性值。
1.9 统计分析
将分级洗脱各组分的疏水性值,抗氧化和ACE抑制活性输入 SPSS10.0软件,分别对疏水性值与DPPH·清除率,以及疏水性值与 ACE抑制率进行相关性分析。
2 结果与讨论
2.1 DA201-C大孔树脂分级洗脱上样浓度和流速的确定
本实验采用的 DA201-C型大孔吸附树脂是一种比表面积较大的非极性吸附树脂,在多肽的分离中应用较为广泛[2-4,9]。实验首先讨论了上样流速和浓度对树脂吸附量的影响,结果见表 1和 2。

表 1 不同流速的穿透点通液量Table 1 Volume of brokethrough point at different flow rates

表 2 不同浓度的穿透点通量Table 2 Volume of brokethrough point at different concentrations
对同一浓度的上样溶液,若吸附流速过大,被吸附物质来不及扩散到树脂的内表面就提早泄露,而造成样品的流失,树脂的吸附量就会下降;但吸附流速过小,吸附时间就会延长。确定最佳的吸附流速通常应综合考虑树脂的吸附效果和工作效率。由表1可看出,随着上样流速由 0.5 BV/h提高到 2 BV/ h,通液量明显降低,树脂的吸附量也会随之降低,故本试验确定 0.5 BV/h为上样流速。表 2结果显示,大孔吸附树脂的穿透点通液量随着被吸附物的浓度提高而增大,在不超过大孔树脂吸附容量的情况下,可以适当提高上样浓度来增大动态吸附量。本试验中,选择 50 mg/mL浓度上样。
2.2 DA201-C大孔吸附树脂分级洗脱及活性测定
蛋白的酶解使得原先埋藏在蛋白质分子内部的疏水性氨基酸暴露出来,从而使酶解得到的多肽可以从水相通过疏水相互作用吸附到树脂的疏水表面。不同浓度的乙醇疏水性不同,与不同疏水性的肽段亲和力也就不同,因此可利用不同极性的洗脱剂对多肽按照疏水性进行分级纯化,这对生物活性肽的分离制备具有重要意义,因为已知大部分生物活性肽的活性都与疏水性氨基酸有关。如对于ACE抑制肽,疏水性氨基酸残基占 60%以上,且 C末端的氨基酸为芳香族或疏水性氨基酸残基的多肽具有更强的抑制活性[11]。程云辉[2]用 DA201-C型大孔树脂对麦胚肽进行分级洗脱,钟芳[3]用DA201-C型大孔树脂对大豆肽进行分级洗脱,均得到不同疏水性和不同生物活性的肽段。
本实验在浓度 50 mg/mL、0.5 BV/h条件下上样,用水洗去未吸附的物质,后依次采用 25%、50%、75%和 100%的乙醇作为洗脱剂,对鹿茸血肽进行分级洗脱,分别收集各组分并测其得率,结果见表3。

表 3 不同浓度乙醇洗脱组分的得率Table 3 Percentages of different concentrations of ethanol delute fractions
从表 3中数据可以看出,大部分多肽在 25%和50%的乙醇浓度下被洗脱,这说明大孔树脂和鹿茸血肽之间的疏水性吸附较弱,很容易便被低浓度的乙醇洗脱下来。随着乙醇浓度增大,被洗脱的多肽含量显著下降。实验对不同浓度乙醇洗脱组分进行了氨基酸组成分析,并计算了各组分的疏水性值,结果见表4。

表 4 水解液及梯度洗脱各组分的氨基酸组成 (g/100 g蛋白)Table 4 Amino acid compositions of hydrolysate and ethanol delute fractions(g/100 g protein)
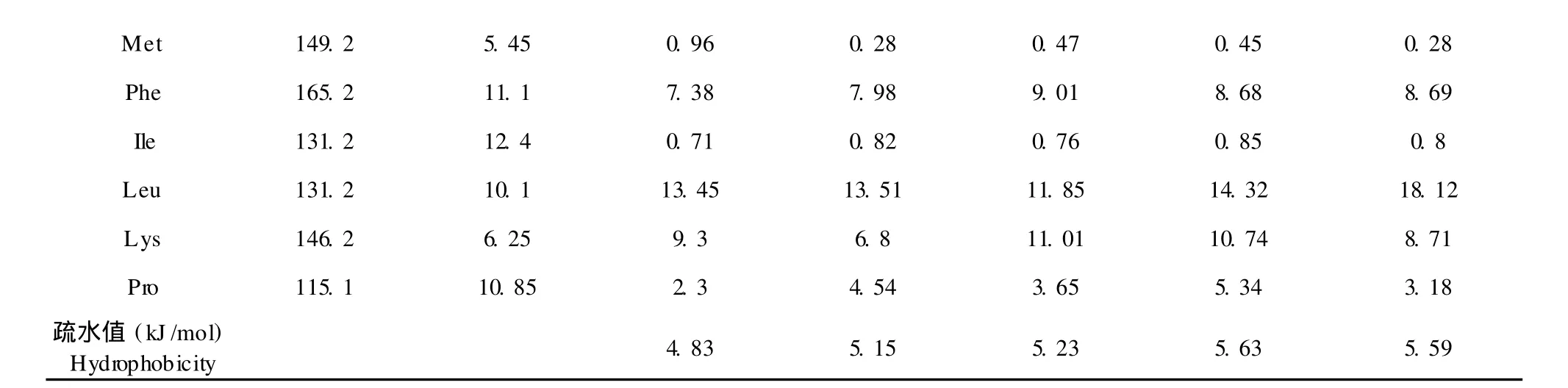
注:未包含色氨酸含量,氨基酸侧链疏水值来源于文献[9]Note:The contentwithout tryptophan,the value of hydrophobicity refer to reference 9
由表 4分析结果可知,随着洗脱剂浓度提高,洗脱组分的疏水值也在升高,75%乙醇洗脱组分具有最高的疏水值为 5.63 kJ/mol、100%乙醇洗脱组分的疏水值虽稍有降低,但相对于乙醇浓度较低的几个组分,仍保持在一个较高水平上。与未分离的鹿茸血肽相比,侧链疏水值 10以上的氨基酸含量均有明显提高。


按照设想,100%乙醇疏水性最强,其洗脱组分应具有最高的疏水值,但实际 100%乙醇洗脱得到的组分疏水值为 5.59 kJ/mol,略低于 75%乙醇洗脱组分的疏水值。其原因可能为某些疏水性多肽在无水乙醇中的溶解性降低,以致其疏水值降低。实验发现[2],75%乙醇解吸效果好于 95%乙醇,这说明某些肽段无法溶解于高浓度的乙醇,其疏水值有可能降低。
本实验进一步考察了各洗脱组分的ACE抑制活性,抗氧化活性及其与肽段疏水性的关系。各洗脱组分的ACE抑制活性和DPPH·清除活性测定结果见图 1、2(测定活性时样品浓度均为 0.2 mg/ mL),疏水性值与ACE抑制活性和抗氧化活性的相关性分析结果见表 5。由图 1、2和表 5结果可知,相对于分离前的水解液,各组分ACE抑制活性和抗氧化活性均有较大提高;ACE抑制活性与肽段疏水性值存在显著相关性,ACE抑制率随着肽段疏水性的升高而升高,75%乙醇洗脱得到的肽段具有最高的ACE抑制率,为 54.71%,但 100%乙醇洗脱组分的ACE抑制活性却稍有降低,这与钟芳[3]的研究结果一致;而肽段疏水性值与DPPH˙清除率之间并无显著相关,DPPH˙清除率随洗脱剂浓度的升高而一直升高,100%乙醇洗脱组分具有最高清除率,为9.84%。
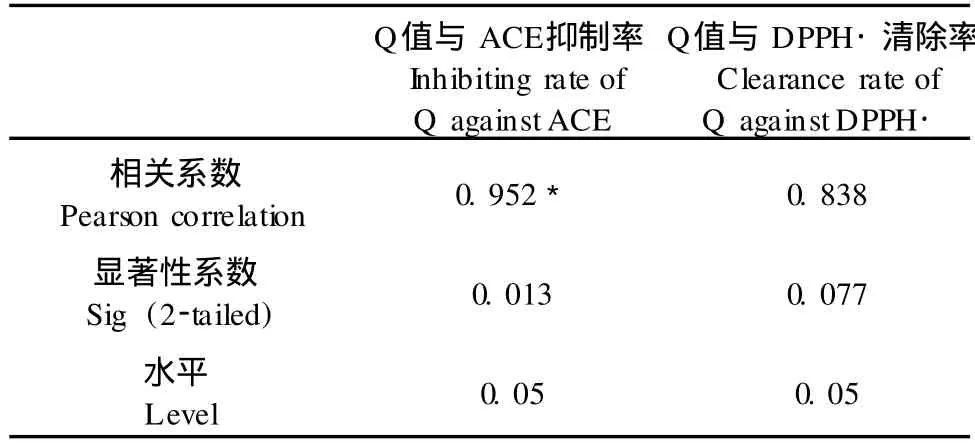
表 5 疏水性值与ACE抑制活性和抗氧化活性的关系Table 5 The relationship between hydrophobicity and ACE inhibitory activity and antioxidative activity
3 结论
综上所述,实验采用DA201-C型大孔吸附树脂对鹿茸血肽进行分级洗脱,氨基酸组成和疏水性值计算结果说明大孔树脂可按疏水性不同对蛋白或多肽进行分离。同时测定 ACE抑制活性和抗氧化活性,结果显示各组分疏水性值与ACE抑制活性显著相关。大孔吸附树脂可作为对生物活性肽进行初步分离的简单有效手段。
1 Pu Y(浦玉),Wang ZX(王芝祥).Adsorbent resins and their application in natural products and antibiotics.Chin J Phar m aceuticals(中国医药工业杂志),2003,36:636-644.
2 Chen YH(程云辉),Wang Z(王璋),Xu SY(许时婴). Study on adsorption and separation of macroporous resin for wheat ger m peptide.Food and M achinery(食品与机械), 2005,21:7-1.
3 Zhong F(钟芳),Zhang XM(张晓梅),Ma JG(麻建国).I-solation and identification of ACE inhibition peptides from soy hydrolytesfraction with macroporous adsorption resin and gelfiltration.Food and M achinery(食品与机械),2006,22: 25-28.
4 GUO ZY(过振宇),SH I YH(施用晖),LE G W(乐国伟). Adsorption and separation ofMusca domestica antimicrobial peptide withmacroporous adsorption Resin.Nat Prod ResDev (天然产物研究与开发),2008,20:969-973.
5 Cheison SC,Wang Z(王璋),Xu SY(许时婴).Use of macroporous adsorption resin for simultaneous desalting and debitter ofwhey protein hydrolysates.Food Sci(食品科学), 2006,27:103-107.
6 Li GH,Le G W,Shi YH,et al.Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and phamacological effects.Nutri Res,2004, 24:469-486.
7 Wang SB(王守本),Sun DS(孙德水),Zhou SR(周淑荣). A survey of the research on utilization of red deer blood and antler blood.Special W ild Econom ic Animal and Plant Res (特产研究),1999,1:51-56.
8 Li GH,Liu H,Shi YH,et al.Direct spectrophotomertic measurementof angiotensin I-converting enzyme inhibitory activity for screening bioactivepeptides.J Pham aceutical and B iomedical Analysis,2005,67:219-224.
9 Jens AN.Enzymic Hydrolysis of Food Proteins.New York: ElsevierApplied Science Publishers,1986.57-109.
10 YangWG(杨万根),Zhang Y(张煜),Xu SY(许时婴),et al.Study on the adsorption attributes of eggwhite protein hydrolysate onmacroporous adsorption resin.Food andM achinery(食品与机械),2007,23:62-65.
11 Cheung HS,Wang FL,OndettiMA,et al.Binding of peptide substrates and inhibitors of angiotensin-converting enzyme.J B iological Chem istry,1980,255:401-407.
Study on the Hydrophobic Separation,ACE Inhibitory Activity and Antioxidative Activity of Red Deer Antler Blood Hydrolysate Peptides
REN Jian-dong2,SH I Yong-hui1,2,LE Guo-wei1,2*,MA Li-qin2,Y IN Xiao-ping2,J IANG Hong21State Key Laboratory of Food Science and Technology,Jiangnan University;2Institute of Nutrition and Food Safety,School of Food Science and Technology,Jiangnan University,W uxi 214122,China
Red deer antler blood hydrolysateswere prepared by enzymatic hydrolysiswith Alcalase for 3 h.Macroporous adsorption resin were used for the fractionation of hydrophobic peptides from the hydrolysates by gradient ethanol elution.Amino acid analysis results suggested that different ethanol elution fractions have different hydrophobicities.75% ethanol fraction showed the highest inhibitory activityof angiotensin I-converting enzyme(ACE),and theACE inhibitory activity has a significant correlation with hydrophobicity.While 100%ethanol delute fraction has the highest DPPH· clearance rate.
red deer antler blood;macroporous adsorption resin;hydrophobic;ACE inhibitory activity;DPPH·
1001-6880(2010)02-0302-05
2008-03-31 接受日期:2008-08-01
国家自然科学基金项目(30571347);863项目(2007AA10Z325)
*通讯作者 Tel:86-510-85917789;E-mail:lgw@jiangnan.edu.cn
Q516;S825
A
