酮戊二酸改性壳聚糖微球的制备及其对来氟米特的缓释
2010-11-24龚兰新郭梅菊
曾 涵,龚兰新,涂 翔,郭梅菊
新疆师范大学生命科学与化学学院,乌鲁木齐 830054
酮戊二酸改性壳聚糖微球的制备及其对来氟米特的缓释
曾 涵*,龚兰新,涂 翔,郭梅菊
新疆师范大学生命科学与化学学院,乌鲁木齐 830054
采用反相悬浮法制备交联壳聚糖微球,再与α-酮戊二酸反应生成 Schiff碱,以NaBH4还原制得改性壳聚糖微球。用 FT-I R,SEM和 XRD进行表征。并以来氟米特 (LEF)为模型药物,考察了其缓释效果。结果显示:微球对药物的最大包封率为 94%,载药量为 62%,在缓释初期 2 h内微球平均释放药量的 16%,后期则呈现缓慢释放的趋势。本论文采用的微粒的药物承载量和释放速度既保证了药物的药效又降低了药物释放速率过快引起的对人体的不良反应。
壳聚糖;微球;来氟米特;缓释
来氟米特(LEF)是新型的具有抗炎及免疫抑制作用的异恶唑类衍生物,是一种治疗类风湿性关节炎(RA)为主的新免疫调节剂。体外试验显示其作用于细胞的二氢乳清酸去氢酶 (DHODH),使核内的尿嘧啶核苷单磷酸(rUMP)的合成受到抑制,从而使活化的的 T淋巴细胞生长受到抑制,降低自身免疫反应,对 RA有一定疗效[1]。但来氟米特的不良反应也较多,特别是药物释放初期速率较快时有较大概率发生下列不良反应[2]:胃肠道反应 (如腹泻、恶呕、腹痛、口腔溃疡、消化不良等)、皮疹、可逆性脱发、体重下降、一过性肝酶升高、间质性肺炎。为提高其在炎性关节局部的药物浓度,增强抗炎作用,减少全身给药引起的不良反应,文献[3]将来氟米特制成贴片,并对其含量进行了测定,研究了其体外释放度及释放药物特性。但仍然存在短时间内释药量较大,释放药物速率偏快,再加之才用的药物载体及抗氧化剂等对生物体不友好,生物相容性较差,从而使其实际应用受到一定限制。壳聚糖(CTS)由于其无毒,可生物降解,生物相容性较好,被广泛用于药物载体的制备[4-5]。壳聚糖在酸性较大介质中易于溶解而造成流失,对其进行化学改性以提高 CTS的耐酸性能和载药量,降低药物释放初期的释放量和释放速度 (特别是对人体有较大毒副作用的药物)是目前研究的热点之一[6]。本文采用反相悬浮法制备酮戊二酸改性 CTS微球,反应式如图 1所示,并研究其对 LEF的缓释效果。制备的改性 CTS微球耐酸性能优于未改性的壳聚糖[7],载药量 62%高于文献[3]报道的 34%,在缓释初期 2 h内微球平均释放载药量的 16%,较文献[3]报道的相同时间内微球平均释放药量 36%有相当幅度的下降,拓宽了壳聚糖的的使用范围也改进了LEF的进药方式,有效降低了药物对人体的毒副作用。

图 1 修饰壳聚糖微球的合成Fig.1 Synthesis of the modified Chitosan microsphers
1 实验部分
1.1 仪器与试剂
壳聚糖(CTS):购自浙江玉环海洋生物化学有限公司,脱乙酰度 94.3%,黏度 86 mPa.s;α-酮戊二酸,硼氢化钠均购自中国医药集团上海化学试剂公司;聚乙二醇 (PEG)2000,液体石蜡,环氧氯丙烷, Span80购自广东汕头市西陇化工厂,以上试剂均为分析纯,文中其余试剂如非特殊说明也为分析纯。
UV2100紫外可见分光光度仪 (日本岛津公司);NEXUS470型傅里叶变换红外光谱仪 (美国Nicolet);Y4Q型 X-射线衍射仪(中国丹东射线仪器公司);S3500N扫描电镜 (日本 Hitachi);安科 TGL-16B型高速台式离心机;FD-1B-50型冷冻干燥机。
1.2 α-酮戊二酸改性 CTS微球的制备
将 25 g CTS溶于 3.5%的乙酸溶液,放置过夜。加入少量 PEG2000,搅拌均匀,倾倒入液体石蜡中。加入 Span80乳化 30 min,加入甲醛反应 1 h。将反应液倒入乙醇-10%NaOH溶液的混合液中,静置分层,抽滤,用石油醚、乙醇和水洗涤。NaOH溶液碱化,加入环氧氯丙烷溶液 75℃反应 2 h,抽滤,水洗,乙醇洗涤。在稀HCl溶液中65℃反应8 h,抽滤,水洗,10%NaOH溶液洗,再用水洗至中性。在 3.5%的乙酸溶液加入α-酮戊二酸直到溶液 pH值达到4.7。在此 pH值下于 39℃反应 10 h。用 10% NaOH溶液调节 pH在 6.0左右,滴加 10%NaBH4溶液还原,继续搅拌 2 h。静置过滤,水洗,乙醇洗,最后以乙醇索氏提取 50 h,于 45℃真空干燥,得α-酮戊二酸改性CTS微球。
1.3 缓释效果测定
1.3.1 α-酮戊二酸改性 CTS包封LEF微球的制备
将 10 g酮戊二酸改性 CTS加入 50 mL HCl溶液 (HCl浓度1.0 mol/L)使其被溶胀,然后持续磁力搅拌下再加入等体积不同浓度的LEF甲醇溶液(甲醇质量浓度为 5.0 g/L),继续搅拌30 min,LEF即包封于微球之中。
1.3.2 样品中LEF含量的测定
按文献[8]方法,由于来氟米特在波长 260 nm处有最大吸收,空白基质没有干扰,故选用此波长为测定波长。采取文献[8]所述的标准加入法测定样品中LEF含量。
1.3.3 LEF在改性 CTS微球中的包封率及 LEF载药量的测定
将 1.3.1中所提到的等体积不同浓度的 LEF甲醇溶液于 2℃,以 15000 r/min超离心 30 min,取上清液用紫外分光光度计于 260 nm处测定游离的LEF浓度,按下列公式计算包封率。而空白微球采用同样方法制备,经冷冻干燥后用于计算载药量。
微球对LEF的包封率 (%)=(总 LEF的量 -游离LEF的量)/总LEF量 ×100%
微球对LEF的载药量 (%)=(总 LEF的量 -游离LEF的量)/微球质量 ×100%
1.3.4 包封LEF的修饰 CTS微球LEF体外释放度测定
于 5 g载药微球中加入 8 mL磷酸氢二钠-磷酸二氢钾缓冲溶液(pH 7.4),于 39℃中速振荡,定时取样后以缓冲溶液补充。取出的样品于 2℃,以15000 r/min超离心 30 min,取上清液用紫外分光光度计于 260 nm处测定游离的 LEF浓度,计算释放药量,检测缓释效果。参照文献[8]方法测定包封来氟米特的修饰 CTS微球的体外释放度。
2 结果与讨论
2.1 改性 CTS微球的 FT-IR分析
采用 KBr压片法,测得原料 CTS和改性微球的红外光谱图如图 2。图中 b为酮戊二酸改性 CTS微球的红外吸收图,与母体 CTS相比,由于氨基被酰胺基取代,1596 cm-1的 N-H强吸收峰减弱,1654 cm-1为脂肪酸中 C=O伸缩吸收峰,3200~3500 cm-1范围的O-H和N-H伸缩振动的吸收峰变宽,说明分子中存在羧基。在 1030~1350 cm-1的吸收峰变宽,说明这是-OH与C-O-C弯曲振动吸收峰的混合峰。

图 2 壳聚糖(a)和修饰微球(b)的 FT-IR谱图Fig.2 FT-IR spectra of(a)Chitosan and(b)modified microsphere
2.2 改性 CTS微球的 XRD分析
图 3为CTS和改性 CTS微球的 X射线衍射谱图,扫描范围 5~30°,扫描速率 2°/min,CuKα辐射,管压40 kV,管流 40 mA。可见,CTS在2θ为11.6°、20.2°处有两个结晶峰。而改性 CTS微球在 11.6°附近的衍射峰几乎完全消失,20.2°附近的衍射峰明显减弱,无定型面积反而相对增加。以上现象说明α-酮戊二酸改性 CTS微球破坏了原有壳聚糖母体分子的二级结构,导致母体分子结晶度大为降低,利于与LEF作用而形成包封的药物微球。

图 3 (a)壳聚糖和(b)修饰壳聚糖微球的 XRD图谱Fig.3 XRD diagramsof(a)Chitosan and(b)modified Chitosan microspheres
2.3 改性 CTS微球的 SEM观察及粒径
图 4为α-酮戊二酸改性 CTS微球的扫描电镜图。可见制得的产物为较为均匀的球形结构。随机测量 20个微球的粒径,求其平均值,得出改性 CTS微球的平均粒径为60μm。
2.4 改性 CTS微球的溶胀性
称取一定量改性 CTS微球树脂,在不同 pH值的缓冲溶液中浸泡 6 h。过滤后称量,计算溶胀率:溶胀率 =(湿树脂质量 -干树脂质量)/干树脂质量。结果表明,随着 pH值的升高,溶胀率先降后升,在 pH 9.6附近有最小值。改性 CTS微球为两性聚电解质,于强酸和强碱条件下的溶胀性都较大,而在等电点时溶胀性最小,可以看出,改性 CTS微球的等电点大约为 9.6。

图 4 修饰壳聚糖微球的 SEM照片Fig.4 SEM image ofmodified Chitosan microspheres
2.5 LEF浓度对包封率的影响
由图 5可见,随着LEF在甲醇溶液中浓度的增大(溶液中都含有 2 g修饰 CTS微球树脂),LEF的包封率初始大体不变,随着 LEF浓度的进一步加大,包封率逐渐下降,这是因为来氟米特的空间位阻很大,当浓度较大时,分子间的排斥力会增强,先包裹与微球内部或吸附于修饰壳聚糖微粒表面的LEF分子会阻止更多的分子与微球作用并将其排斥出去。在LEF浓度为 4.0 g/L时,测得的包封率为94.3%。

图 5 LEF浓度变化对包封率的影响Fig.5 Effect of LEF concentrations on LEF encapsulation efficiency
2.6 修饰 CTS微球载药量
图 6是 LEF在甲醇溶液中的初始质量浓度对修饰 CTS微球载药量的影响 (溶液中都含有 2 g修饰 CTS微球树脂)。从图中可以看出,随着 LEF浓度的增大,微球对LEF的载药量会增加。当LEF浓度为 6.0 g/L时,微球对 LEF的载药量能达到62.4%,高于文献[3]报道的 34%。LEF浓度的加大,与修饰 CTS微球发生吸附作用的LEF总量会加大,故载药量会增大,但LEF达到一定浓度之后,由于空间位阻和修饰壳聚糖微球表面吸附位饱和的双重因素作用使得当LEF浓度进一步加大之后,载药量不会再增加,甚至略有下降。
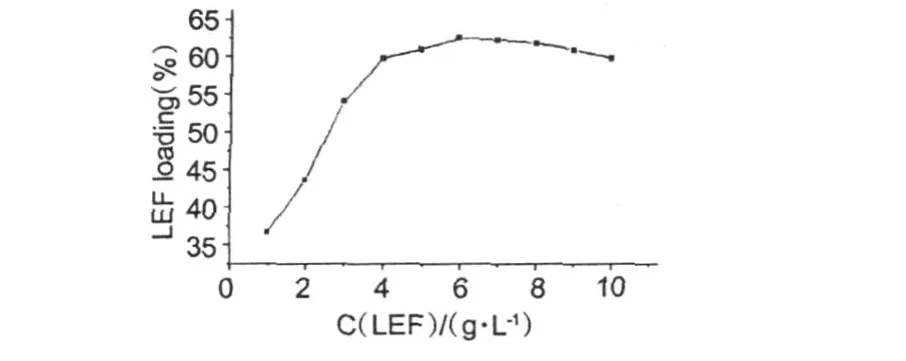
图 6 LEF质量浓度变化对载药量的影响Fig.6 Effect ofLEF concentration on LEF loading
2.7 体外释放度测定
采用前述文献[9]采用的溶出度测定法进行包封来氟米特药物的修饰 CTS微球的 LEF体外释放度测定(溶液中都含有2 g修饰CTS微球树脂)。图7列出了不同载药量微球在缓冲液中的释放效果。图中可见:随着载药量的增加,修饰 CTS微球在药物释放的最初 2 h内释放的药量从 8%上升到24%,在后期则均呈缓慢释放,36 h内释放的药量超过60%。

图 7 不同载药微球的释药曲线ig.7 LEF released of differentLEF loading in microspheres C(LEF):g/L:B.6.0;C.8.0;D.10.0
1 Hu JH(胡晋红),Lv SF(吕随峰),Liu JY(刘继勇).Research progress on cure effect of leflunomide for RA.J Chin New Pham(中国新药杂志),2001,10:294-297.
2 Smolen JS,Kalden JR,Scott DL.Efficacy and safety of Leflunomide compared with placebo and sulphasalazine in active RA:a double-blind,randomized,multicenter trial.Lancet,1999,53(9149):259.
3 XiW(奚炜),Hu JH(胡晋红),ZhuQG(朱全钢),Liu JY (刘继勇).Preparation of leflunomide patch and its release characteristicsin vitro.Phar m Care&Res(药学服务与研究),2004,4:240-242.
4 Harish Prashanth KV,Tharanathan RN.Controlled release of alpha-lipoic acid through incorporation into natural polysaccharide-based gel beads.Food Sci&Tech,2006,10:1-6.
5 Xin JY(辛嘉英),Zhang FS(张复升)Li D(李冬).The synthesis of chitosan microspheres microspheres for macromolecular drugs slow—release.Nat Prod Res Dev(天然产物研究与开发),1996,8(3):92-95.
6 Yang T,Chou C.Hydrocolloids as emulsifiers and emulsion stabilizers.Food M icrobio,2005,(97):237-242.
7 Wu XF(武雪芬),Hu JM(胡建梅),Hou Y M(侯益民),etal.Preparation of chitosan-g-salicylic acid polymer.Journ Chin-M ed Univ(中国医科大学学报),2006,19:503-506.
8 Castro P,Nasser H,Abrahão A,et al.Aspirin and indomethacin reduce lung inflammation of mice exposed to cigarette smoke.B io Phar m,2009,77:1029-1039.
9 Xie Y(谢宇),Shang XX(尚晓娴),Yan LS(颜流水). Preparation of hydroxypropyl-chitosan nanospheres and their controlled release in vitro.J Appl Chem(应用化学),2009, 26:195-197.
Preparation of Chitosan M icrospheresM odified byα-Ketoglutaric Acid and Their Controlled Releasein vitro
ZENG Han1*,GONGLan-xin1,TU Xiang1,GUO Mei-jv1
Academy of Life Science and Chem istry,Xinjiang Nor mal University,U rum uqi 830054,China
Chitosan microsphereswere prepared by inverse phase suspension method.The Chitosan was modified by reducing Schiff’s bases formed from the reaction ofα-ketoglutaric acid Chitosan.The structure ofmicrosphereswas characterized by FT-I R,SEM and XRD.Leflunomide(LEF)was taken as the typical drug to determine the controlled release in vitro.Results from tests indicate the highest encapsulation efficiency and load of LEF reached to 94%and 62%respectively.Modified Chitosan microspheres released 16%ofLEF in average within initial 2 h,and it continuously release the entrapped drugwith a slower rate.Load ofmicrospheres and amount of drug release ofmicrospheres adopted in this article ensure drug’s efficacy and reduce the unfavorable effect induced by over-fast release rate.
Chitosan;microsphere;leflunomide(LEF);controlled release
1001-6880(2010)02-0289-04
2009-03-16 接受日期:2009-05-25
*通讯作者 Tel:86-991-4332417;E-mail:zenghan1289@163.com
R285;Q58;0629
A
