巨噬细胞移动抑制因子在大鼠急性坏死性胰腺炎肺损伤中的作用
2010-11-24赵小勇程雪燕田新邵磊石书伟莫小华
赵小勇 程雪燕 田新 邵磊 石书伟 莫小华
·论著·
巨噬细胞移动抑制因子在大鼠急性坏死性胰腺炎肺损伤中的作用
赵小勇 程雪燕 田新 邵磊 石书伟 莫小华
目的检测急性坏死性胰腺炎(severe acute pancreatitis, ANP)大鼠肺组织巨噬细胞移动抑制因子(MIF)mRAN表达及TNF-α含量,探讨它们在ANP肺损伤中的作用机制。方法40只SD大鼠随机分成对照组及ANP 3、6、12 h组。采用5%牛磺胆酸钠(0.1 ml/100 g体重)胆胰管逆行注射方法制备ANP模型。取血检测血清淀粉酶。取胰腺组织和肺组织行病理学检查,并称重计算其湿/干重比。采用RT-PCR法检测肺组织MIF mRNA表达,放免法测定肺组织TNF-α含量。结果ANP 组血淀粉酶、胰腺和肺组织湿/干重比显著升高,病理损伤随时间延长逐渐加重。ANP 3、6、12 h组肺组织TNF-α含量分别为(0.69±0.07)ng/ml、(1.64±0.10)ng/ml和(0.92±0.11)ng/ml;MIF mRNA表达量分别为1.97±0.09、2.55±0.23、3.29±0.26,均显著高于对照组的(0.19±0.06)ng/ml和1.21±0.34(P值均lt;0.01)。肺组织MIFmRNA表达与肺组织病理损伤、肺湿/干重比、TNF-α含量均呈正相关,相关系数分别为r=0.637、r=0.684、r=0.858,P值均lt;0.01。肺组织TNF-α含量与肺损伤、肺湿/干重比均呈正相关,相关系数分别为r=0.540和r=0.421,P值均lt;0.01。结论ANP大鼠肺组织MIFmRNA过表达,TNF-α含量显著增加,它们共同参与肺损伤的发生。
胰腺炎,急性坏死性; 肺损伤; 巨噬细胞游走抑制因子; 肿瘤坏死因子α
约1/3的重症急性胰腺炎(SAP)患者会发展到急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory dysfunction syndrome,ARDS),约60%的患者在SAP发病的第一周因ALI/ARDS病死[1]。因此,探讨SAP并发ALI/ARDS的发病机制对于降低SAP患者病死率有重要意义。
巨噬细胞移动抑制因子( macrophage migration inhibitory factor,MIF)广泛分布于脑垂体、肺脏、肝脏、肾上腺、子宫等部位,其主要功能是抑制巨噬细胞游走,促进其在炎症局部浸润,并分泌多种细胞因子。它也是糖皮质激素抗炎作用的内源性拮抗物[2],在ALI/ARDS的发病过程中起重要作用[3]。因此,本实验检测急性坏死性胰腺炎(ANP)大鼠肺组织MIF基因表达,探讨其在ANP并发ALI/ARDS发病机制中的作用。
材料与方法
一、实验动物与分组
成年SD大鼠40只,体重250~300 g,清洁级,雌雄不限,购自昆明医学院实验动物中心。按数字表法随机分为对照(3 h)组,ANP 3、6、12 h组,每组10只。采用胆胰管逆行注射5%牛磺胆酸钠(Sigma公司)0.1 ml/100 g体重方法制备ANP模型。对照组仅翻动胰腺后关腹。按各时间点处死大鼠,取血,并取胰腺和肺组织。
二、观察指标及方法
1.血清淀粉酶:采用全自动生化分析仪。
2.胰腺和肺组织湿/干重比:取胰腺体部和右肺下叶组织用电子称称其湿重,置于80℃烘箱烘烤24 h后称其干重,计算胰腺、肺组织的湿/干重比。
3.胰腺和肺脏组织病理学检查:取胰尾、右肺中叶组织,常规切片、HE染色。由病理科医师阅片,并参考Schimidt等[4]标准对胰腺进行评分,参考 Osman等[5]的标准对肺组织评分。
4.肺组织TNF-α测定:取左肺新鲜组织,吸去血迹,称重约400 mg,放入生理盐水研磨制成匀浆,离心,取上清液于-20℃保存。采用TNF-α放射免疫试剂盒(天津九鼎医学生物工程有限公司)检测。
5.肺组织MIF mRNA检测:取新鲜肺组织,在液氮中研磨成粉末,应用RNA抽提试剂盒(上海华舜生物工程有限公司)抽取总RNA。应用RT-PCR方法检测MIF mRNA表达。MIF上游引物 5′-ATG-CCTATGTTCATCGTGAAC-3′,下游引物5′-GGC-TCAAGCGAAGGTGGAAC-3′,扩增片断341 bp;内参β-actin上游引物5′-TGGAATCCTGTGGCATCCATG-3′,下游引物5′-TAAAACGCAGCTCAGTAACAG-3′,扩增片断349 bp。引物由上海生工生物工程技术服务公司合成。先采用Revert AidTM First Strand CDNA Systhesis Kit(Fermentas公司)逆转录成cDNA。PCR反应: 95℃ 3 min,94℃ 30 s、53℃ 30 s、72℃ 30 s,33个循环,最后72℃ 7 min。产物经电泳分离,图像自动捕获系统扫描,以MIF与β-actin电泳带灰度值之比作为mRNA表达的相对值。
三、统计学处理
结 果
一、血清淀粉酶活性变化
对照组血淀粉酶活性为(524.10±122.92)U/L,ANP 3、6、12 h组分别为(4365.20±884.37)U/L、(9019.70±7383.15)U/L和(11534.90±7165.35)U/L,较正常对照组显著升高(Plt;0.01)。
二、腹水量、胰腺湿/干重比及病理组织学改变
ANP 3、6、12 h组大鼠腹水量为(6.44±2.35)ml、(8.96±3.63)ml和(13.19±9.21)ml,均显著多于对照组的(0.51±1.10)ml(P值均lt;0.01);胰腺湿/干重比为6.53±0.73、8.25±0.83、10.44±0.96,均显著高于对照组的4.36±0.36(P值均lt;0.01)。
对照组胰腺肉眼无明显变化,光镜见胰腺组织结构清晰,细胞形态正常(图1a)。ANP 3 h组胰腺肿胀明显,出现点片状紫褐色坏死区;光镜见腺泡间质水肿,小叶间隙增大,有点灶状坏死区,有少量炎细胞浸润(图1b)。6 h组胰腺质地变硬,可见散在分布的皂化斑;光镜见腺泡破坏,坏死区扩大,有凝固性、脂肪性坏死(图1c)。12 h胰腺有大片坏死灶,大网膜、肠系膜、腹后壁、肠壁可见大量黄色皂化斑;光镜见腺泡小叶结构破坏,血管破裂出血,坏死区有大量中性单核巨噬细胞浸润(图1d)。对照组和ANP 3、6、12 h组的胰腺病理评分分别为0.15±0.34、2.75±1.27、6.35±1.23、8.95±2.24,ANP各时间点组均较对照组显著增加(Plt;0.01)。
三、肺组织湿/干重比及病理改变
对照组和ANP 3、6、12 h组的肺组织湿/干重比分别为4.24±0.25、5.61±9.62、6.90±0.53、8.45±0.80,ANP各组均较对照组显著增加(Plt;0.01)。对照组肺组织结构清晰,肺泡壁完整 ,肺间质无渗出(图2a)。ANP 3 h组肺脏体积稍增大;镜下见肺间质增宽,充血水肿,有少量炎性细胞浸润(图2b)。6 h后肺体积增大更为显著;光镜下间质明显增宽,炎性细胞浸润明显增多,肺泡腔出血(图2c)。12 h后肺间隔增宽,大量炎症细胞浸润,肺泡腔内大量渗出物,肺泡腔塌陷,局灶性实变等(图2d)。对照组和ANP 3、6、12 h组的肺病理评分分别为0.25±0.35、3.65±0.47、3.80±1.01、4.60±1.84,ANP各组均较对照组显著增加(Plt;0.01)。
四、肺组织MIF mRNA表达
对照组肺MIF mRNA低水平表达,表达量为1.21±0.34。ANP 3、6、12 h的MIF mRNA,表达量分别为1.97±0.09、2.55±0.23、3.29±0.26,均较对照组显著增加(P值均lt;0.01,图3)。
五、肺组织TNF-α含量
对照组和ANP 3、6、12 h组肺组织TNF-α含量分别为(0.19±0.06)ng/ml、(0.69±0.07)ng/ml、(1.64±0.10) ng/ml和(0.92±0.11 )ng/ml,ANP各组较对照组显著增加(P值均lt;0.01)。
六、相关性分析
肺组织MIF mRNA表达与肺组织病理损伤、肺湿/干重比、TNF-α含量均呈正相关,相关系数分别为r=0.637、r=0.684、r=0.858,P值均lt;0.01。肺组织TNF-α含量与肺损伤,肺湿/干重比均呈正相关,相关系数分别为r=0.540和r=0.421,P值均lt;0.01。
讨 论
大量研究显示,在急性胰腺炎发病早期即存在炎性细胞因子过度释放和失控的全身炎症反应。TNF-α是ANP发病后较早产生的细胞因子,其升高的程度与胰腺损伤程度直接相关联[6]。它也是引起ALI的启动因子[7]。徐军等[8]和Norman等[9]报道ANP大鼠肺TNF-α含量随制模时间延长不断升高。Winder等[10]用TNF-α拮抗剂治疗可明显减轻肺水肿。本实验提示,ANP组肺组织TNF-α水平明显高于对照组,于6 h达到高峰,后略有下降,且肺组织TNF-α水平与肺的损伤程度呈正相关,提示肺组织TNF-α参与肺损伤的发生。
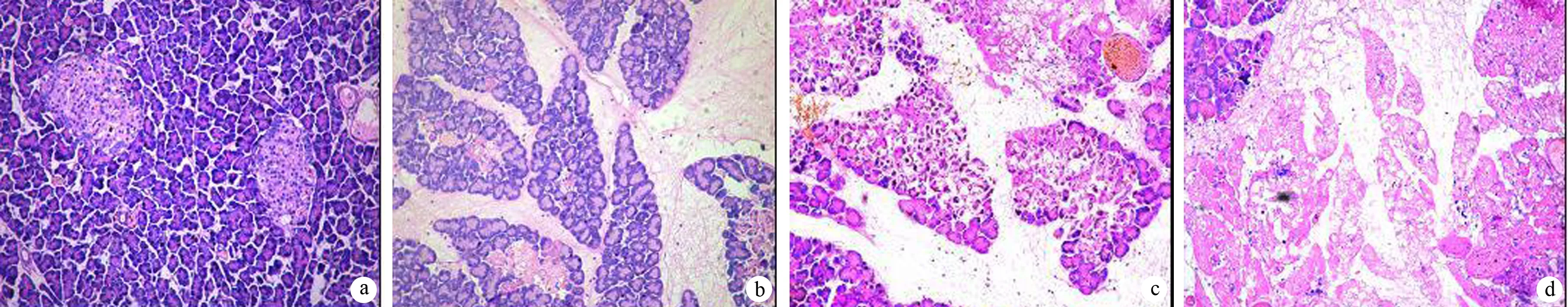
图1 对照组(a)和ANP 3(b)、6(c)、12 h(d)组胰腺组织病理改变(HE ×100)

图2 对照组(a)和ANP 3(b)、6(c)、12 h(d)组肺组织病理改变(HE ×100)
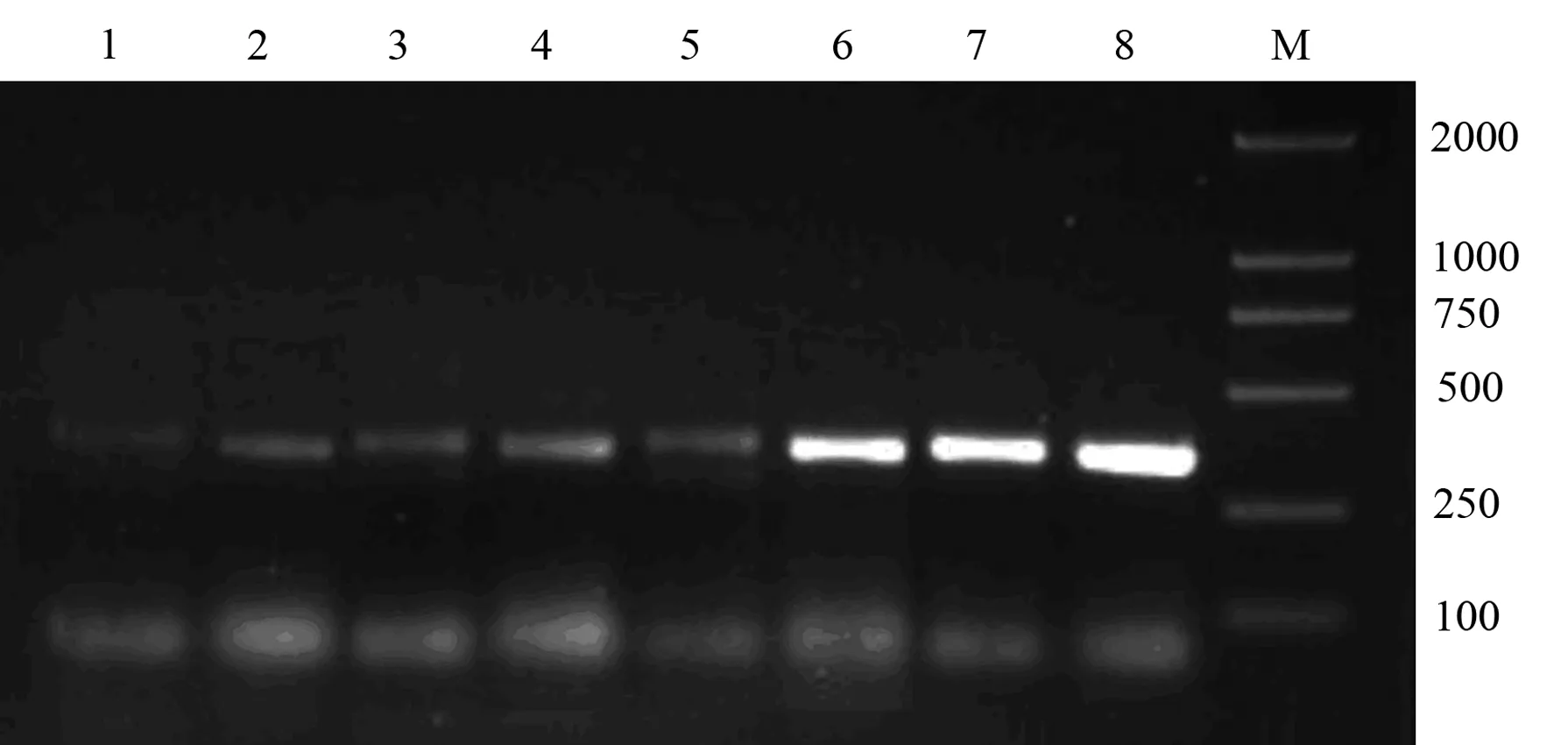
图3 对照组(1,2)及ANP 3 h(3,4)、6 h(5,6)、12 h(7.8)组肺组织β-actin mRNA和MIF mRNA的表达
巨噬细胞移动抑制因子(MIF)作为一种炎性细胞因子,一种神经内分泌激素和一种催化酶,在炎症反应和免疫调节中发挥着重要作用。MIF能抑制巨噬细胞游走,促进巨噬细胞在炎症局部浸润、增生、激活及分泌一些细胞因子。ANP时,炎症介质、细胞因子刺激肺脏巨噬细胞活化,释放MIF,MIF可刺激单核巨噬细胞释放各种细胞因子和炎症介质,导致ALI/ARDS。本实验结果显示,随着胰腺病变的加重,肺组织出现中性粒细胞、单核巨噬细胞浸润,MIF mRNA表达增加,并与肺损伤程度呈正相关,提示MIF介导了巨噬细胞在肺组织的浸润,同时巨噬细胞可产生MIF,形成正反馈,加重肺的损伤,与Donnelly等[11]的结果一致。Bernhagen等[12]用TNF-α诱导巨噬细胞释放MIF,观察到MIF反过来刺激巨噬细胞释放TNF-α,使用抗MIF抗体则可降低腹膜炎鼠血浆TNF-α水平,提示TNF-α和MIF协同作用于前炎症反应环路,致病情加重,预后不良。本组肺组织MIFmRNA表达与TNF-α水平同步升高,呈显著正相关,也表明它们共同促进ALI发生。
[1] Shield CJ,Winter DC, Redmond HP.Lung injury injury in acute pancreatitis:mechanisms,prevention and therapy.Curr Opin Crit Care,2002,8:158-163.
[2] Maxime V,Fitting C,Annane D,et al.Corticoids normalize leukocyte production of macrophage migration inhibitory factor in septic shock.J Infect Dis,2005,191:138-144.
[3] Bacher M,Metz CN,Calandra T,et al.An essential regulatory role for macrophage migration inhibitory factor in T-cell activation.Proc Natl Acad Sci USA,1996,93:7849-7854.
[4] Schmidt J,Lewandrowsi K,Warshaw AL,et al.Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol,1992,12:41-51.
[5] Osman MO,Kristense JU,Jacoben NO,et al.A monoclonal anti-interleukin 8 anti-body(WS-4) inhibits cytokine response and acute lung injury in experimental acute necrotising pancreatitis in rabbits.Gut,1998,43:232-239.
[6] Bhatia M,Brady M,Shokuhi S,et al.Inflammatory mediators in acute pancreatitis.J Pathol,2000,190:117-125.
[7] Tsukahara Y,Morisaki T,Horita Y,et al.Phospholipase A2 mediates nitric oxide production by alveolar macrophages and acute lung injury in pancreatitis.Ann Surg,1999,229:385-392.
[8] 徐军,张梅,刘学民,等.TNF-α基因表达在大鼠急性重症胰腺炎肺损伤中的作用.西安交通大学学报(医学版),2004,25:388-390.
[9] Norman JG,Fink GW,Denham W.Tissne-specific cytokine production during experimental acute pancreatitis.A probale mechanism for distant organ disfunction.Dig Dis Sci,1997,42:1783-1788.
[10] Winder AC,Mullen PG,Walsh CJ,et al.Delayed tumor necrosis factor a blockade attenuates pulmonary dysfunction and metabolic acidosis associated with experimental gram-negative sepsis.Arch Surg,1994,129:80-89.
[11] Donnelly SC,Haslett C,Reid RT,et al.Regulatory role for macrophage migration inhibitory factor in acute respiratory diseases syndrome.Nat Med,1997,3:320-323.
[12] Bernhagen J,Mitchell RA,Calandra T,et al.Purification,bioactivity,and secondary structure analysis of mouse and human macrophage migration inhibitory factor(MIF).Biochemistry,1994,33:14144-14155.
2009-03-06)
(本文编辑:吕芳萍)
RoleofintrapulmonaryexpressionofMIFmRNAinacutelunginjuryofratswithacutenecrotizingpancreatitis
ZHAOXiao-yong,CHENGXue-yan,TIANXin,SHAOLei,SHIShu-wei,MOXiao-hua.
DepartmentofPancreaticSurgery,PeoplesHospitalofJiaozuo,Jiaozuo454002,China
MOXiao-hua,Email:mxh580@yahoo.com.cn
ObjectiveTo investigate the relationship between the expression of MIF mRNA and TNF-α in the lung tissue of rats with acute necrotizing pancreatitis (ANP) and explore their mechanism of action in acute lung injury during the course of ANP.MethodsA total of 40 Sprague-Dawley rats were randomly divided into four groups (n=10 in each group): the sham operation (SO) group, ANP 3h group, 6h group, 12h group. The model of ANP was induced by retrograde injection of 5% sodium taurocholate (0.1 ml/100 g) into the biliary and pancreatic duct. The level of serum amylase was determined; pancreatic and lung tissues were harvested for pathological examination, and wet/dry weight ratios were estimated. Intrapulmonary expression of MIF mRNA was assayed by semi-quantitative RT-PCR. TNF-α in pulmonary homogenate was measured by immunoradiometric assay.ResultsSerum amylase, wet/dry weight ratios of pancreatic and lung tissues all significantly increased, and pathological injuries aggravated with time in ANP groups. Levels of TNF-α in ANP 3h, 6h, 12h group were (0.69±0.107) ng/ml, (1.64±0.10) ng/ml and (0.92±0.11)ng/ml, and expression of MIF mRNA were 1.97±0.09, 2.55±0.23, 3.29±0.26, which were significantly higher than those in control group [(0.19±0.06)ng/ml, 1.21±0.34,Plt;0.01]. Intrapulmonary expression of MIF mRNA was positively associated with lung pathological injuries, wet/dry weight ratio, and TNF-α(r=0.637,r=0.684,r=0.858,Plt;0.01). Intrapulmonary levels of TNF-α was positively associated with lung pathological injuries, wet/dry weight ratio (r=0.540,r=0.421,Plt;0.01).ConclusionsMIF mRNA was over-expressed and level of TNF-α was significantly increased in pulmonary tissue in rats with ANP, and this may be one of the mechanisms in the pathogenesis of lung injury in ANP.
Pancreatitis,acute necrotizing; Lung injury; Macrophage migration-inhibitory factors; Tumor necrosis factor-alpha
10.3760/cma.j.issn.1674-1935.2010.02.012
云南省教育厅科研基金资助项目(5Z0314C)
454002 焦作,河南省焦作市人民医院胰腺外科(赵小勇、程雪燕、田新、邵磊、石书伟);云南省昆明医学院第二附属医院腹部微创外科(莫小华)
莫小华,Email:mxh580@yahoo.com
