荧光光谱法分析花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用
2010-11-18赵金莲曾佑炜彭永宏
赵金莲, 曾佑炜,2, 李 宽, 彭永宏,3*
(1.华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631;2.广东轻工职业技术学院食品与生物工程系,广东广州 510300;3.惠州学院生命科学系,广东惠州 516007)
荧光光谱法分析花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用
赵金莲1, 曾佑炜1,2, 李 宽1, 彭永宏1,3*
(1.华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631;2.广东轻工职业技术学院食品与生物工程系,广东广州 510300;3.惠州学院生命科学系,广东惠州 516007)
采用荧光光谱扫描法定性定量研究了6种花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用.结果表明:桂花茶、复合花茶、绿茶和芍药花茶的保护作用要优于红玫瑰花茶和金莲花茶,且各花茶的保护作用在0~1 mg/mL范围内均随质量浓度的增加而增强. 该方法的稳定性和重复性都较好.
花茶; DNA氧化损伤; 荧光光谱扫描
在一定条件下,自由基可使DNA的碱基和脱氧核糖发生化学变化,引起碱基改变、破坏或脱落,脱氧核糖分解,磷酸二脂键断裂以及DNA核苷酸链的单链和双链断裂,DNA与附近蛋白质可能形成DNA-蛋白质交联,甚至DNA同一条链内和相邻2条链间核苷酸可能发生链内交联与链间交联.在活性氧(Reactive Oxygen Species, ROS)自由基中,·OH因其化学性质最活泼,能在产生部位与其他物质发生连锁反应.·OH与DNA碱基的反应类型主要为氢抽提、加成和电子转移[1].所以,本文采用循环产生·OH的体系对大肠杆菌质粒DNA造成氧化损伤.
溴化乙啶(ethidium bromide,EB)是一共轭平面分子,和DNA一样仅有很弱的荧光,当其以共价键专一性地插入DNA双螺旋或三螺旋内部的碱基对之间后,两者间发生能量传递.EB吸收能量后,荧光强度大大增加,在580 nm附近有最大发射,但当引入羟自由基(·OH)时,其对DNA会造成损伤,影响EB与DNA的嵌合,造成EB荧光强度下降.抗氧化物质具有较强的清除自由基能力,对DNA的氧化损伤具有保护作用,在一定程度上可以缓解·OH诱导的EB荧光强度的下降[2-3].
现代研究表明,茶叶中的许多化学成分可以清除自由基,延缓人体的衰老[4-5].茶多酚作为一种广泛使用的天然抗氧化剂,对DNA的氧化损伤具有较强的保护能力.花茶(Scented tea)又称熏花茶、香花茶、香片,其或由花朵简单干燥而成,不经其他环节,或由精制茶坯(如绿茶、红茶、乌龙茶茶坯)与符合食用需求、具有香气的鲜花拌和,通过一定的加工方法,促使茶叶吸附鲜花的芬芳香气而成[6].在我国,花茶作为一种特殊的茶类,其食用保健的功效越来越受到人们的喜爱,许多花卉是药食同源保健食品的原料.关于茶(主要是绿茶、红茶)和某些药物与DNA的相互作用已有很多研究,但少见有文献报道采用荧光光谱法研究花茶对DNA氧化损伤的保护作用,本文旨在用荧光光谱法分析6种花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用.
1 材料与方法
1.1材料
花茶:上海育贻工贸有限公司产品(GB9679-88,GB6192);绿茶:立顿黄牌精选绿茶(标准号Q/TNBE 103);复合花茶:本实验室复配自制(金莲花茶∶芍药花茶∶绿茶∶红玫瑰花茶∶桂花茶=3∶4∶5∶0.5∶1);袋泡茶专用包装纸:市售,符合GB11680食品包装纸卫生标准.
1.2试剂与仪器
试剂:大肠杆菌(DH5α)质粒DNA,EB(sigma公司),其它试剂均为国产分析纯.
仪器:Cary Eclipse荧光分光光度计(东南化学仪器有限公司);手提式不锈钢蒸汽消毒器(上海三申医疗器械有限公司);2-16K冷冻离心机(sigma公司);HN101-电热鼓风干燥箱(南通沪南科学仪器有限公司);BS124S型电子天平(北京赛多利斯仪器系统有限公司).
1.3方法
1.3.1 花茶冲泡方法 将各种花茶烘干、研磨,过0.425 mm筛,准确称取2.00 g,装入袋泡茶专用包装纸,密封,放入杯中,用150 mL沸水浸提10 min.取出茶袋,茶汤冷却10 min,抽滤3~5 min,15 000 r/min常温离心10 min,取上清液在室温条件下进行定性试验.
另同法提取各花茶袋泡剂,茶汤置于电热鼓风干燥箱内,50 ℃下烘干至恒质量,配成不同质量浓度的溶液进行定量试验.
1.3.2 荧光扫描方法 在40 μL荧光杯中,依次加入2 μL DNA、1 μL 0.1 mol/L的(NH4)2Fe(SO4)2溶液、1 μL EDTA(0.5 mol/L,用时再稀释3倍)、1 μL H2O2(体积分数为0.3%,用时再稀释20倍)、1 μL 10 mg/mL Vc(维生素c)、1 μL待测样品、32 μL 1×TE和0.5 μL EB,混匀,静置5 min后在Cary Eclipse荧光分光光度计进行荧光强度的测定.测定条件为:狭缝Ex=5 nm,Em=5 nm,激发波长为520 nm,混合液所发射的荧光扫描范围为550~800 nm[2-3].
(NH4)2Fe(SO4)2、EDTA、H2O2和VC为循环产生·OH的体系:
Fe2+-EDTA+H2O2→Fe3+-EDTA+·OH+OH-,
Fe3+-EDTA+VC→Fe2+-EDTA+Oxidized Ascorbate.
1.3.3 稳定性试验方法 按照1.3.2的方法,同一样品在一定时间内每间隔2 min扫描1次,共扫描5次.
1.3.4 重复性试验方法 按照1.3.2的方法,同一花茶制备3次样品,进行扫描.
2 结果与分析
2.1定性试验
按照1.3.2的方法,测定EB-DNA体系、·OH诱导的DNA损伤体系及加入各花茶样品的DNA损伤体系的荧光强度,结果如图1所示.各花茶茶汤用时稀释20倍.
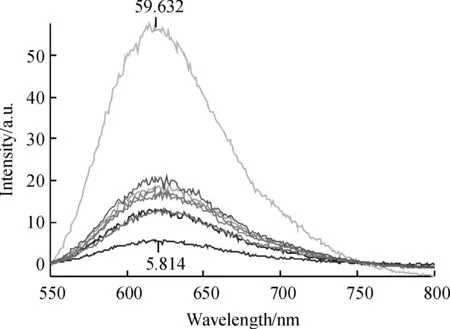
图谱从上至下依次为:EB-DNA→桂花茶→复合花茶→绿茶→芍药花茶→红玫瑰花茶→金莲花茶→EB-DNA+·OH
图1 花茶茶汤对羟自由基(·OH)诱导的DNA氧化损伤保护作用的荧光光谱
Fig.1 Fluorescent spectrum of the protection of flower tea water on ·OH -induced DNA damage
从图1可以看出,在本试验条件下,EB-DNA在625 nm附近有最大发射光谱,在无羟自由基诱导DNA损伤时,其荧光强度为59.63 a.u.;当有产生·OH的体系存在时,EB-DNA的荧光强度仅为5.81 a.u.,这表明·OH对DNA的确造成了损伤,影响了其与EB的嵌合而导致荧光强度下降.在·OH诱导的DNA损伤体系中加入花茶茶汤后,其荧光强度较损伤的EB-DNA体系有所增加,表明花茶对羟自由基(·OH)诱导的DNA氧化损伤具有一定的保护作用.
2.2定量试验
复合花茶对羟自由基(·OH)诱导的DNA氧化损伤保护作用的定量试验结果见表1.
从表1可以看出,复合花茶质量浓度分别为0.25、0.40、0.50、1.00 mg/mL时,荧光强度分别为17.13、36.65、43.54、45.11 a.u.,均极显著高于·OH诱导的DNA损伤体系的荧光强度(5.84 a.u.),这表明随着复合花茶质量浓度的增加,混合液体系(EB-DNA+·OH+样品)的荧光强度增加,且达到极显著水平,也说明了在试验范围内,复合花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用随质量浓度的增加而增强.
其他花茶(不同质量浓度)对羟自由基(·OH)诱导的DNA氧化损伤的保护作用亦表现出与复合花茶同样的趋势,其一次荧光光谱扫描图见图2,各花茶按2 μL DNA+1 μL Fe2++1 μL EDTA +1 μL H2O2+1 μL VC +1 μL样品+32 μL TE+0.5 μL EB加样,反应5 min后进行荧光扫描.
2.3不同花茶对羟自由基(·OH)诱导的DNA氧化损伤保护作用的比较
不同花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用均随着质量浓度的增加而增强,本文比较了6种花茶保护作用的强弱,结果见图3.
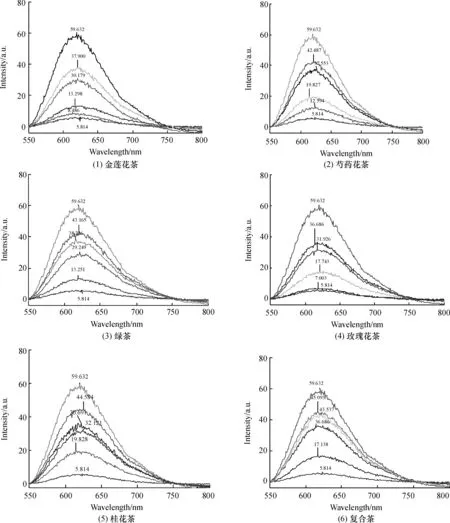
各图谱从上至下依次为:EB-DNA→EB-DNA+·OH +1.00 mg/mL样品→EB-DNA+·OH +0.50 mg/mL样品→EB-DNA+·OH +0.40 mg/mL样品→EB-DNA+·OH +0.25 mg/mL样品→EB-DNA+·OH.
图2 不同花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用的一次荧光光谱图
Fig.2 Fluorescent spectrums of the protection of 6 different flower teas with different concentration on ·OH-induced DNA damage
表1不同质量浓度的复合花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用
Tab.1 Results of the protection of mixed flower tea at different concentration on ·OH -induced DNA damage
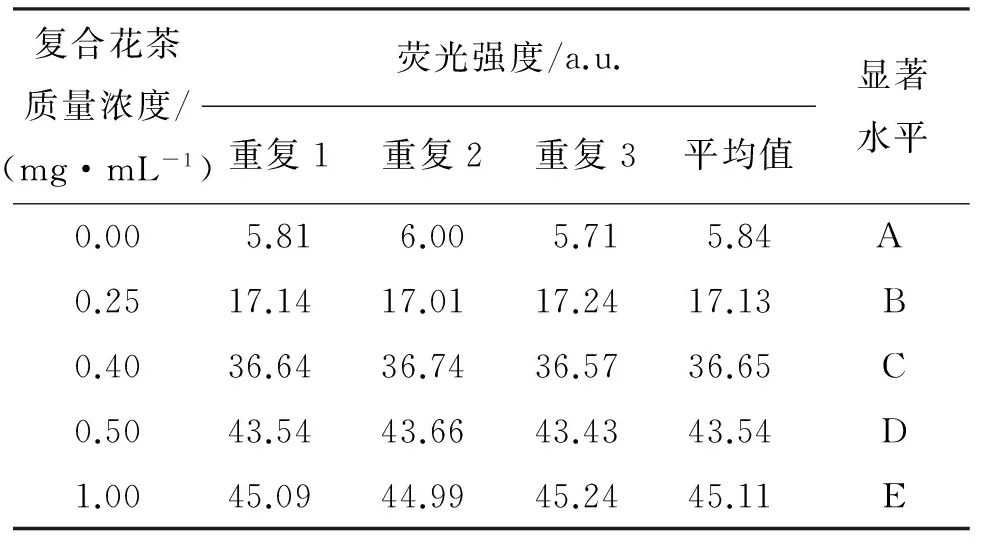
复合花茶质量浓度/(mg·mL-1)荧光强度/a.u.重复1重复2重复3平均值显著水平0.005.816.005.715.84A0.2517.1417.0117.2417.13B0.4036.6436.7436.5736.65C0.5043.5443.6643.4343.54D1.0045.0944.9945.2445.11E
注:数据采用DPS数据处理软件进行显著性差异分析,大写字母表示1%显著水平.
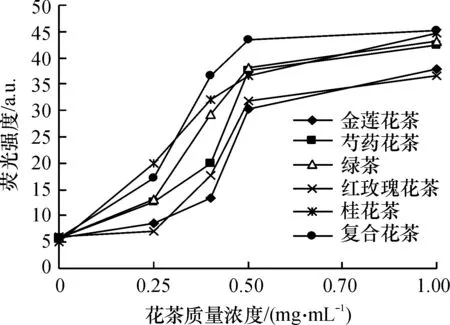
图3 不同花茶对羟自由基诱导的DNA氧化损伤保护作用的比较
Fig.3 Comparison of the protection of flower tea on ·OH -induced DNA damage
从图2可以看出,在试验设计浓度范围内,低质量浓度时(0~0.25 mg/mL),复合花茶对羟自由基诱导的DNA氧化损伤的保护作用优于绿茶、芍药花茶、金莲花茶和红玫瑰花茶,但小于桂花茶;0.40 mg/mL以上的各质量浓度下,复合花茶的保护作用在6种花茶中均为最好,其次是绿茶、桂花茶和芍药花茶,再次是红玫瑰花茶和金莲花茶.
2.4稳定性试验
EB-DNA体系、·OH诱导的DNA损伤体系及加入各花茶样品的DNA损伤体系荧光光谱的稳定性直接影响到试验的结果,为此本文考察了各体系在8 min内的稳定性,结果如表2所示.
一般来说,RSD越小表示多次测定所得结果之间越接近.从表2可以看出,在本试验条件下,各个体系的RSD分别为0.28%、1.69%、1.97%、1.12%、2.89%、2.57%、1.85%、0.48%,表明各体系5个测定值之间接近程度好,亦说明EB-DNA体系、·OH诱导的DNA损伤体系及加入各花茶茶汤的DNA损伤体系在8 min内荧光光谱稳定.
2.5重现性试验
EB-DNA体系、·OH诱导的DNA损伤体系及加入各花茶样品的DNA损伤体系荧光光谱的重现性对试验结果亦产生不可忽视的影响,本文考察了各体系的重现性,结果见表3.
从表3可以看出,在本试验条件下,各个体系的RSD分别为0.79%、1.68%、2.17%、3.97%、4.23%、1.68%、2.70%、2.93%,表明各体系3次测定值之间接近程度较好,EB-DNA体系、·OH诱导的DNA损伤体系及加入各花茶茶汤的DNA损伤体系的荧光光谱重现性较好.
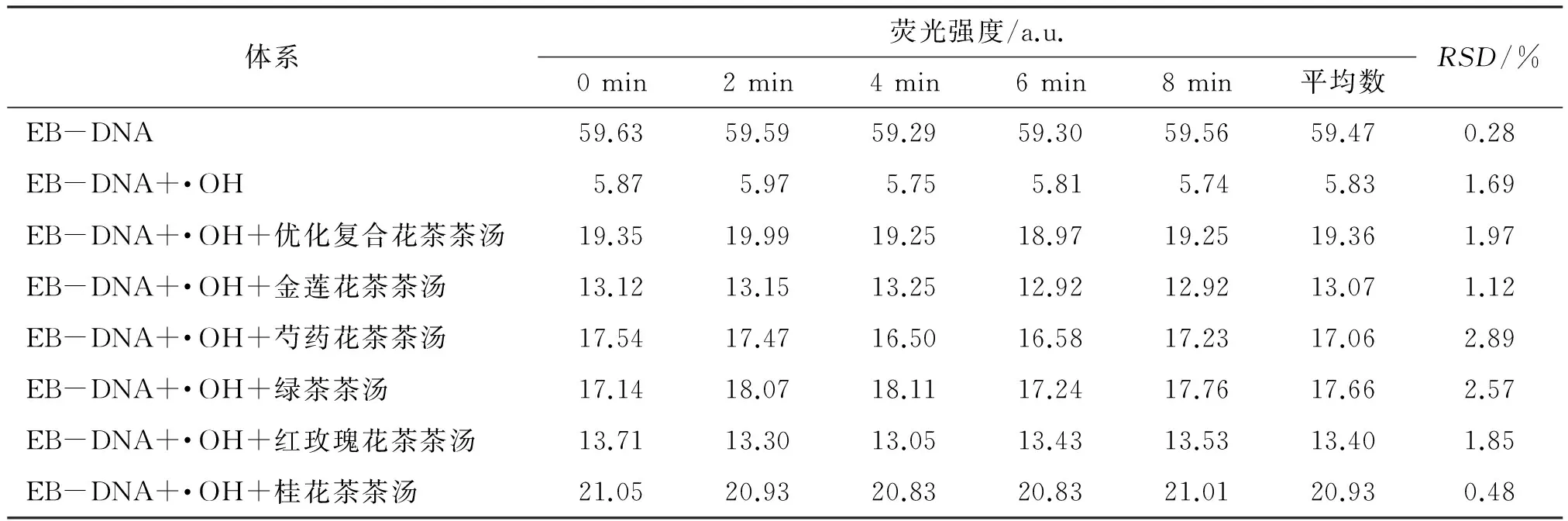
表2 荧光光谱稳定性试验结果
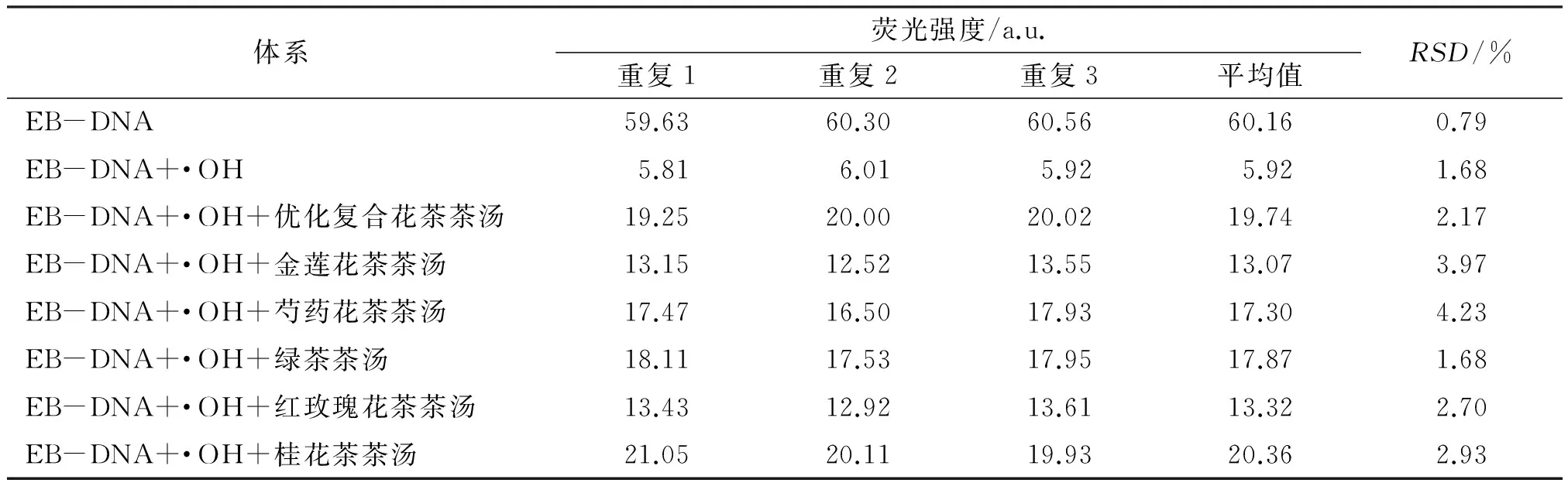
表3 荧光光谱重现性试验结果
3 讨论
核酸与许多物质发生可逆相互作用,其作用方式基本有3种,第1种是静电作用;第2种是与DNA沟槽的相互作用;第3种是嵌入作用[8].EB可以以第1和第3等2种方式与DNA结合.有研究指出,当EB与能发生相似嵌合作用的物质分子共存时,这些分子就会和EB共同竞争DNA的结合位点,影响EB与DNA的结合,使EB-DNA复合体系的荧光发生变化[9].本文中花茶与DNA相互作用机理有待深入研究,推测是花茶清除·OH自由基和花茶与EB竞争DNA结合位点2种机理共同作用的结果.
有关DNA氧化损伤保护作用的研究已有很多报道,多采用动物实验法[10]、化学发光法[11-12]和分光光度法[13].动物实验法周期较长,步骤繁琐;化学发光法的反应条件比较严格,反应体系比较脆弱,干扰大;分光光度计测量结果误差较大,准确度相对不高.本文采用荧光光谱扫描法分析了6种花茶对羟自由基(·OH)诱导的DNA氧化损伤的保护作用,结果表明花茶对DNA的氧化损伤确能起到一定的保护作用,且该方法的稳定性和重复性都较好.荧光光谱分析是利用某些物质分子受光照射时所发生的荧光的特性和强度,进行物质的定性分析或定量分析的方法.当物质分子吸收了特征频率的光子,就由原来的基态能级跃迁至电子激发态的各个不同振动能级.激发态分子经与周围分子撞击而消耗了部分能量,迅速下降至第一电子激发态的最低振动能级,并停留约9~10 s之后,直接以光的形式释放出多余的能量,下降至电子基态的各个不同振动能级,此时所发射的光即是荧光.使激发光的波长和强度保持不变,而让荧光物质所发出的荧光通过发射单色器照射于检测器上,亦即进行扫描,以荧光波长为横坐标,以荧光强度为纵坐标作图,即为荧光光谱,又称荧光发射光谱.荧光法灵敏度高、快速准确、简单易操作,被广泛用于生物化学、生理医学和临床医学等研究工作中.
[1] 张德莉,朱圣姬,罗光富,等. 自由基与DNA氧化损伤的研究进展[J]. 三峡大学学报:自然科学版,2004,26(6):563-567.
ZHANG Deli, ZHU Shengji, DUO Guangfu et al. Development of free radical- induced oxidative damage to DNA [J]. Journal of China Three Gorges University: Natural Sciences Edition, 2004,26(6):563-567.
[2] 蔡志强,杨广花,赵希岳,等. 天然抗氧化剂与DNA的相互作用的研究[J]. 中国药科大学学报,2005,36(1):56-58.
CAI Zhiqiang, YANG Guanghua, ZHAO Xiyue et al. Studies on the interaction between natural antioxidants and DNA [J]. Journal of China Pharmaceutical University, 2005,36(1):56-58.
[3] 哈木拉提·吾甫尔,阿布都热依木·玉素甫,阿布都艾尼·阿布力米提. 羟自由基引发的DNA氧化损伤机理的研究进展[J]. 新疆医科大学学报,2000,23(3):273-275.
[4] DUFRESNE C J, FARNWORTH E R. A review of latest research findings on the health promotion properties of tea[J]. Journal of Nutritional Biochemistry, 2001, 12: 404-421.
[5] 杨贤强. 茶多酚化学[M].上海:上海科学技术出版社,2003.
[6] 李永菊,庞晓莉,司辉清. 不同等级花茶精油吸附性能分析[J]. 西南园艺,2006,34(2):45-46.
[7] HONG L I, ROBRT W B. A ssociation of redox-active iron bound to high molecular weight structures in nuclei with inhibition of cell growth by H2O2[J]. Free Radic Biol Med, 1999, 26:49.
[8] 陈勇,李元宗,常文保,等.核酸分子嵌入剂[J]. 分析科学学报, 1994,10(1):67-74.
CHEN Yong, LI Yuanzong, CHANG Wenbao, et al. Intercalators of nucleic acids[J]. Journal of Analytical Science, 1994, 10(1):67-74.
[9] 宫霞,施用晖,乐国伟. 荧光光谱分析家蝇幼虫抗菌肽与大肠杆菌染色体DNA作用机理[J].光谱学与光谱分析,2005,25(3):420-423.
GONG Xia, SHI Yuanhui, LE Guowei. Study on the interaction mechanism of antibacterial peptide MDL-1 in Musca DomesticaLandE. coli DNA by fluorescence spectra [J]. Spectroscopy and Spectral Analysis, 2005,25(3):420-423.
[10] 潘洪志,那立欣,石刚,等. 番茄红素对大鼠细胞DNA氧化损伤修复的影响[J]. 卫生研究,2004,33(2): 189-191.
PAN Hongzhi, NA Lixin, SHI Gang, et al. Effect of lycopene on DNA oxidative damage of cells in rats[J]. Journal of Hygiene Research, 2004, 33(2):189-191.
[11] 裴凌鹏,惠伯棣,张帅,等.葛根黄酮对DNA氧化损伤的保护研究[J]. 食品科学,2005,26(4):236-238.
PEI Lingpeng, Hui Bodi, ZHANG Shuai, et al. Study on protection against DNA damage by flavones from Puerarea willaohwi[J]. Food Science, 2005, 26(4):236-238.
[12] 米生权,赵晓红,刘璇,等. 几种植物化学物粗提物体外抗DNA氧化损伤功能的检测[J]. 北京联合大学学报:自然科学版, 2009,23(1):14-17.
MI Shengquan, ZHAO Xiaohong, LIU Xuan, et al. Investigation on the effect of some phytochemical crude extractions on resisting DNA oxidization in vitro [J]. Journal of Beijing Union University: Natural Sciences Edition, 2009, 23(1):14-17.
[13] 曹炜,陈卫军,郑晓晖,等. 一种评价天然抗氧化剂对羟自由基致 DNA 损伤保护作用的改进方法[J]. 营养学报,2008,30(1): 74-77.
CAO Wei, CHEN Weijun, ZHENG Xiaohui, et al. Modified method to evaluate the protection of the antioxidants against hydroxyl radical-mediated DNA damage[J]. Acta Nutrimenta Sinica, 2008, 30(1):74-77.
Keywords: flower tea; DNA oxidated damage; fluorescent spectrum scanning
【责任编辑 成 文】
STUDYONPROTECTIONOFFLOWERTEAON·OH-INDUCEDDNADAMAGETHROUGHFLUORESCENTSPECTRUMSCANNING
ZHAO Jinlian1, ZENG Youwei1,2, LI Kuan1, PENG Yonghong1,3*
(1. School of Life Science, Guangdong Key Lab of Biotechnology for Plant Development, South China Normal University, Guangzhou 510631, China;2. Department of Food and Bio-engineering, Guangdong Light Industry Technical College, Guangzhou 510300, Guangdong China;3. Department of Life Science, Huizhou University, Huizhou, Guangdong 516007, China)
The protection functions of six types of flower tea on ·OH-induced DNA damage were researched qualitatively and quantitatively through fluorescent spectrum scanning. Result showed that the protection functions of osmanthus fragrans tea, mixed flower tea, green tea and paenoia albiflora tea are better than that of rosa rugosa (red) and tropaeolum majus tea, and the protection functions of six types of flower tea are all enhanced with the improvement of concentration (0~1 mg/mL). The stability and repeat of fluorescent spectrum scanning are both good.
2009-12-25
广东省自然科学基金资助项目(915063201000018);惠州市科技计划资助项目(2008P58)
赵金莲(1982—),女,湖北孝感人,华南师范大学2006级硕士研究生, Email:yjdai5925@163.com;彭永宏(1966—),男,湖南涟源人,博士,华南师范大学教授,主要研究方向:植物天然产物研究与开发,Email:pengyh@scnu.edu.cn.
*通讯作者
1000-5463(2010)03-0092-06
Q503
A
