含油污水中苯系物的处理
2010-11-10严叶卫王文成任德龙邱贤锋
严叶卫, 王文成, 任德龙, 邱贤锋
(上海船舶运输科学研究所环境分所,上海200135)
0 前 言
油、固体杂质、悬浮物和呈溶解状态的有毒有害物质是船舶含油污水的主要污染物。目前含油污水处理工艺分为初级处理和二级处理[1-3]。船舶含油污水经两级处理后,可有效去除油、固体杂质和悬浮物,但不能有效处理呈溶解状态的有毒有害物质。尤其是我国推广无铅汽油后,为了提高油品的辛烷值,越来越多的油品中添加了苯系物,少量的苯系物在船舶含油污水中呈溶解状态,目前的处理工艺不能有效降低其含量。船舶含油污水处理后出水中的苯系物浓度呈逐年增加的趋势,寻找有效方法去除船舶含油污水中苯系物的课题显得越来越紧迫。
本研究尝试采用Fenton试剂对模拟含油污水中的苯系物进行氧化处理,分析了不同实验因子对Fenton试剂氧化苯系物的影响。同时探讨了吸附剂对污水中苯系物的吸附能力,分析了吸附剂对苯系物的吸附容量和吸附去除能力。
1 实验部分
1.1 主要试剂
苯(分析纯),甲苯(分析纯),二甲苯(化学纯),H 2O2(30%),FeSO4·7H2 O(分析纯),某有机吸附材料SP-1000(浙江某环境技术公司),粉末活性炭。
1.2 Fenton试剂氧化实验
用蒸馏水溶解一定量的氯化钠和氯化镁,配制氯离子的浓度为10 000 mg/L模拟海水,然后分别加入等质量比的苯、甲苯和二甲苯,最终配制成苯系物浓度为45 mg/L的模拟水样(该水样苯系物含量数值为监测的营口港船舶油污水苯系物浓度平均值)。取上述模拟水样400 mL于锥形瓶中,调节p H值到一定范围,向溶液中加入一定量的FeSO4·7H 2O,搅拌溶解,然后再加入一定量的H2 O2,继续搅拌使混合溶液在不同组合工艺下进行反应。反应一段时间后取出一定量的溶液,采用气相色谱测定苯系物的浓度,并计算苯系物的去除率。
1.3 静态吸附实验
蒸馏水中分别加入等质量比的苯、甲苯和二甲苯,配制成浓度为90 mg/L苯系物模拟水样。取0.1~0.2 g洗净的吸附剂(活性炭或SP-1000)于蒸馏水中浸泡2 h以上,去除吸附剂中的空气。取500 ml模拟水样于锥形瓶中,加入浸泡过的吸附剂,在摇床上以一定的转速振荡反应12 h。静置取一定量水样,测定吸附平衡后溶液的苯系物浓度(Ce),并计算吸附剂对苯系物的吸附容量Q(mg/g)。
吸附容量计算公式为
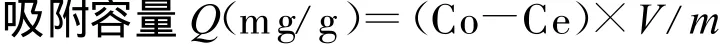
式中:Co和Ce分别为反应前、后苯系物的浓度,mg/L;V为溶液体积,L;m为吸附剂的用量,g。
2 结果与讨论
2.1 各种因子对Fenton试剂氧化苯系物的影响
2.1.1 p H值对苯系物去除率的影响
配制45 mg/L的模拟苯系物水样,与Fenton试剂反应,其中[Fe2+]=0.6 mmol/L,[H2O2]=6 mmol/L,反应30 min。调节不同的pH值,反应结果如图1所示。
从图1中可以看出,pH值大小对Fenton试剂氧化苯系物有着显著影响。p H=3时,Fenton试剂的氧化能力最强,随着p H的增大,Fenton试剂对有机物的降解能力有明显下降。这是由于pH值较大时,Fe2+容易形成铁的氢氧化物,这些铁的氢氧化物可能形成羟基铁络合物,导致溶液中铁离子浓度降低,因此,产生的·OH相对较低,氧化活性降低[4-5]。而且,当p H值偏碱性时,H 2O2在溶液中非常不稳定,会分解成氧气和水而丧失氧化能力。当p H<2时,Fenton试剂的氧化能力也会降低,由于p H值很低时,H 2O2不能和Fe2+反应生成羟基自由基。在强酸性溶液中,H2O2俘获一个质子形成了H3O+2,而H3O+2使H2O2呈现亲电子性,减少了H2O2和Fe2+之间的反应,增强了H2O2的稳定性。因此,pH值控制在2.5~3.5为宜。
2.1.2 H2O2浓度对苯系物去除率的影响
配制45 mg/L的模拟苯系物水样,与Fenton试剂反应,其中[Fe2+]=0.6 mmol/L,调节水样的p H值为3,反应30 min。加入不同量的H 2 O2,反应结果如图2所示。

图1 pH值对Fenton试剂氧化苯系物的影响

图2 H2O2浓度对Fenton试剂氧化苯系物的影响
从图2中可以看出,H 2O2的投加量对Fenton试剂氧化苯系物有着显著影响。随着H 2O2投加量的增加苯系物的去除率先增大,当达到5 mmol/L时,去除率达到82.3%最大值,而后出现一定量的下降趋势。这是因为H2O2的浓度较低时,H2O2的浓度增加,产生的·OH量增加;当H2O2的浓度过高时,过量的H2O2不但不能通过分解产生更多的·OH,反而把Fe2+氧化为Fe3+,这样既消耗了H2O2又抑制了·OH的产生[6]。
2.1.3 FeSO4浓度对苯系物去除率的影响
配制45 mg/L的模拟苯系物水样,与Fenton试剂反应,其中,[H 2 O2]=6 mmol/L,调节水样的pH值为3,反应30 min。加入不同量的FeSO4,反应结果如图3所示。
投加量较低时,苯系物的去除率随着FeSO4浓度的增加而升高。Fe2+对Fenton试剂的氧化反应起催化作用。Fe2+浓度较低时,H2 O2的分解速度很慢,Fe2+浓度增加会使Fenton试剂释放出更多的羟基自由基,氧化活性提高。当[Fe2+]=0.7 mmol/L时,去除率达到80.7%最高值。当Fe2+浓度再增加时,H2 O2分解过快,单位时间内产生的·OH会大大增加,使得·OH没有和有机物发生氧化还原反应就转变成O2释放出去,从而发生无效分解,使得氧化去除率会有所下降。
2.1.4 反应时间对苯系物去除率的影响
配制45 mg/L的模拟苯系物水样,与Fenton试剂反应,其中[Fe2+]=0.6 mmol/L,[H2O2]=6 mmol/L,调节水样的pH值为3,反应30 min。调节不同的p H值,反应结果如图4所示。

图3 FeSO4浓度对Fenton试剂氧化苯系物的影响

图4 反应时间对Fenton试剂氧化苯系物的影响
随着反应时间的增加苯系物的去除率增大。但反应到30 min之后,Fenton试剂对苯系物氧化能力达到最大值,反应趋于平缓。这是由于水样中的H 2O2和FeSO4都已经反应完毕,不能再产生新的羟基自由基,从而丧失氧化有机物的能力。
2.2 吸附剂对苯系物的静态吸附实验
将0.1~0.2 g活性炭或SP-1000吸附剂加入500 ml苯、甲苯和二甲苯模拟水样,静态吸附反应12 h后,实验结果如图5。
由图5可以看出,2种吸附剂活性炭和SP-1000对苯系物有较大的吸附能力,吸附剂的吸附容量Q可以达到约330 mg/g。只要控制在一定的实验条件下,吸附剂可以将污水中的苯系物浓度降到2 mg/L以下,较好实现污水的深度处理。

图5 静态吸附等温线
3 结 论
通过分析不同实验因子(pH值、H2 O2浓度、FeSO4浓度和反应时间)对Fenton试剂氧化苯系物的影响,确定了Fenton试剂氧化降解苯系物模拟水样的最佳条件为:[Fe2+]=0.6 mmol/L,[H 2O2]=5 mmol/L,pH=3,反应30 min,苯系物去除率可达81%。船舶油污水中的苯系物经过Fenton试剂氧化处理后,大部分已被去除。由于Fenton试剂极不稳定,在实际工程操作中药品保存、配制和投加都有一定的困难,需要进一步研究满足工程实践的处理工艺。为了进一步降低油污水苯系物的含量,可采用吸附剂进行深度处理。经分析发现活性炭和SP-1000对苯系物的吸附容量均可达到约330 mg/L,只要控制在一定的实验条件下,就可以将油污水中苯系物的浓度控制在较低的水平。
[1] 姬钰.浅析船舶油污水的危害及处理方法[J].船舶,2009,20(2):31-37.
[2] 周培德.谈谈船舶油污水处理[J].航海,1995(6):40-40.
[3] 许海梁,熊德琪,殷佩海.航船油污水处理技术进展[J].交通环保,2000,21(3):21-24.
[4] 陈传好,谢波,任源,等.Fenton试剂处理废水中各影响因子的作用机制[J].环境科学,2000,21(3):93-96.
[5] 陈胜兵,何少华,娄金生,等.Fenton试剂的氧化作用机理及其应用[J].环境科学与技术,2004,27(3):105-107.
[6] 王春敏.Fenton试剂法处理含酚废水的实验研究[D].沈阳:沈阳建筑大学,2005.
