黑曲霉β2葡萄糖苷酶基因在大肠杆菌中的克隆与表达
2010-11-04周晓明莫隽颖付水林
周晓明,莫隽颖,陶 冶,付水林,宫 衡
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
黑曲霉β2葡萄糖苷酶基因在大肠杆菌中的克隆与表达
周晓明,莫隽颖,陶 冶,付水林,宫 衡
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
根据 GenBank报道的黑曲霉β2葡萄糖苷酶基因序列设计两对特异性引物,分别以黑曲霉 H7总 RNA及基因组DNA为模板,扩增出β2葡萄糖苷酶基因bg l全长及活性中心所在的外显子5序列E5,分别将其连接到pMD182T载体并转化到大肠杆菌DH5α测序。结果表明,bg l序列全长2583 bp,与β2葡萄糖苷酶基因(XM 001398779.1)核苷酸序列同源性为99%,氨基酸序列同源性为99%,E5与bg l外显子5区域同源性为100%。进一步构建表达质粒p ET32a(+)2bg l、p ET32a(+)2E5、p ET28a(+)2E5,转化大肠杆菌BL 21(DE3)诱导表达,并进行 SDS2PAGE电泳分析。
黑曲霉;β2葡萄糖苷酶;序列分析;蛋白表达
β2葡萄糖苷酶(EC3.2.1.21)属于糖苷水解酶家族3,是纤维素酶系的重要组成部分,但其含量最低,不足1%,且活性普遍偏低,是纤维素酶解转化的瓶颈[1]。因此许多国内外学者正致力于β2葡萄糖苷酶分子生物学方面的研究,以期改善纤维素酶的催化效率,实现纤维素资源的高效生物转化。研究表明,黑曲霉是β2葡萄糖苷酶酶活较高的菌株[2,3],但关于黑曲霉β2葡萄糖苷酶基因的研究报道仍然较少[4~7]。作者在此分别以黑曲霉(A.niger)H7总RNA及基因组DNA为模板,扩增β2葡萄糖苷酶基因bg l全长以及活性中心所在的外显子5序列E5,并分别将两段序列构建到表达载体p ET32a(+)及p ET28a(+)上,转化大肠杆菌BL21(DE3)进行诱导表达,为研究黑曲霉β2葡萄糖苷酶的重组表达奠定基础。
1 实验
1.1 菌株与质粒
A.nigerH 7,自行筛选;E.coliDH 5α、E.coliBL 21(DE3)、p ET32a(+)、p ET28a(+),自行保存 ;克隆载体pMD182T,大连宝生物公司。
1.2 工具酶及主要试剂
总RNA提取试剂、焦碳酸二乙酯(DEPC)、DNA MarkerⅢ、质粒小量抽提试剂盒、琼脂糖凝胶回收试剂盒,北京天根公司;ExTaq DNA聚合酶、X2Gal、IPTG、PrimeScrip t RT Reagent试剂盒,大连宝生物公司;T4连接酶、BamH I、N otI限制性内切酶,Fer2 mentas公司;其它试剂均为国产分析纯。
1.3 培养基
PDA培养基:马铃薯200 g·L-1(将马铃薯切成1 cm3方块,置于1000 mL水中煮沸,过滤收集液体,即得),葡萄糖20 g·L-1,琼脂粉 15 g·L-1。
1.4 黑曲霉总 RNA及基因组DNA的抽提
黑曲霉总RNA抽提采用 Trizol法,起始菌体量为500 mg,具体步骤参照说明书。抽提结束后用紫外分光光度计测定其OD230、OD260、OD280,并进行琼脂糖凝胶电泳。
黑曲霉基因组DNA抽提采用CTAB法,具体步骤参照文献[8]。
1.5 引物设计
以 GenBank上已经发表的黑曲霉β2葡萄糖苷酶基因序列bgl 1(登录号为AJ132386)为模板设计两对特异性引物,扩增bg l全长的上游引物为 bgl2F:5′2 CGGGA TCC A TGAGGTTCACTTTGA TCGAGGC2 3′,下游引 物为 bgl2R:5′2A TTTGCGGCCGC AGT2 GAACA GTAGGCA GAGACGCC23′,采用的限制性酶切位点(划线部分)分别为上游BamHI和下游NotI。扩增外显子 5的上游引物为 E52F:5′2CGG2 GA TCCTCCGACTACAACTCTGCTTTCCCT23′,下游 引 物 为 E52R:5′2A TTTGCGGCCGCTGGCG2 GTCTTAGCAAGCGCCTCAA T23′。引物由上海生工公司合成。
1.6 目的片段的扩增
cDNA第一条链的合成:冰上取总 RNA 5μL、Oligo d T 0.5μL、Random Primer 1μL、RNase2free H2O 3.5μL于65℃保温10 min,加入5×RT Buffer 4μL、RNase2free H2O 5μL、AMV 逆转录酶 1μL,于42℃保温1 h后85℃灭活5 min。将20μL体系用dd H2O稀释至50μL,于-20℃保存。
PCR扩增全长(50μL体系):10×ExTaq Buffer 5.0μL,dN TP 4.0μL,上游引物 1.0μL,下游引物1.0μL,cDNA第一条链 10.0μL,TaKaRaExTaq HS Enzyme 0.5μL,ddH2O 28.5μL补足。反应条件为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸 3 min,35个循环;最后 72℃延伸 10 min。E5片段扩增方法同上,采用基因组DNA为模板,退火温度为59℃,延伸90 s。
将PCR产物进行1%琼脂糖凝胶电泳检测,并对目的条带进行胶回收。
1.7 TA克隆
将上述纯化的PCR扩增产物与Ta KaRa pMD182 T载体连接,10μL连接体系如下:1μL pMD182T载体,4μL目的片段、5μL Solution I,16℃连接过夜,转化大肠杆菌DH5α感受态细胞,用含有 X2Gal、IPTG和100μg·m L-1Amp的LB平板筛选阳性克隆,对筛选到的转化子抽提质粒并进行PCR或双酶切验证。对鉴定正确的克隆进行测序,测序结果登陆NCB I网站进行BLAST比对分析。
1.8 重组表达质粒的构建
将上述测序正确的质粒用BamH I和N otI双酶切后,与同样双酶切的表达载体连接,采用 T4 DNA连接酶,连接体系为:表达载体3.0μL,目的片段9.0 μL,5×Ligase Buffer 4.0μL,T4 DNA Ligase 1.0 μL,ddH2O 3.0μL补足至20.0μL。22℃连接6 h后转化大肠杆菌DH5α感受态细胞,并用含有100μg·m L-1Amp的LB平板进行筛选。对阳性转化子进行双酶切鉴定,将鉴定正确的阳性克隆分别命名为p ET32a(+)2bg l、p ET32a(+)2E5、p ET28a(+)2E5,并转化到大肠杆菌BL 21(DE3)感受态细胞中。
1.9 目的蛋白的诱导表达
从新鲜的LB平板上挑取重组菌菌落,接种于25 m L带有相应抗性的 LB培养基中,37℃、200 r·min-1过夜培养,以1%的比例接种到30 m L抗性LB培养基,37℃、200 r·m in-1培养至OD600约为0.4~0.5时,加入终浓度为1 mmol·L-1的 IPTG,30℃诱导表达约4 h。取1 m L菌液,12 000 r·min-1离心2 min,收集菌体,用 PBS缓冲溶液(p H值7.0)洗涤沉淀1~2次,并最终将其溶于500μL相同缓冲溶液中。超声破碎细胞:功率200 W,每超声2 s间隔4 s,共60次。4℃、12 000 r·min-1离心30 min,分别取上清与沉淀溶于相同的缓冲溶液中,以诱导前的重组菌株为对照进行SDS2PAGE电泳,分析重组蛋白表达情况。
2 结果与讨论
2.1 黑曲霉总 RNA及基因组DNA的提取(图1)
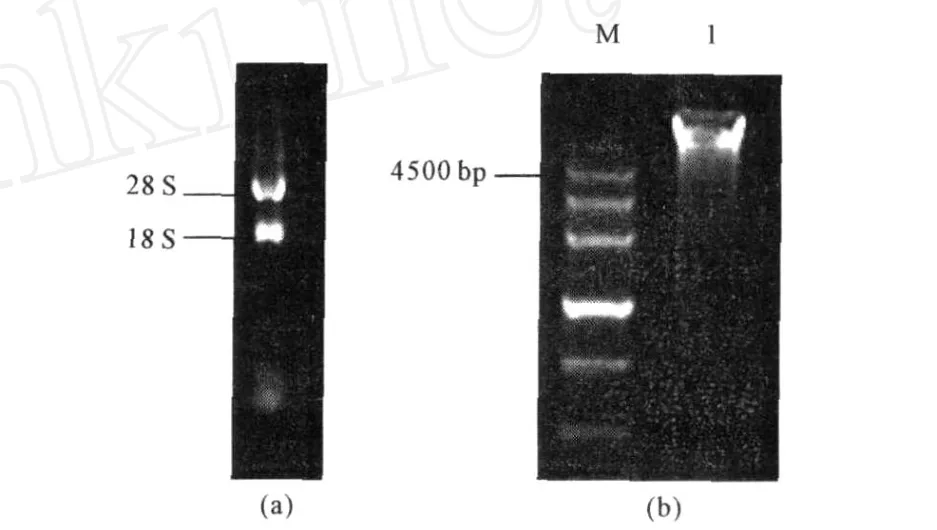
图1 黑曲霉总 RNA(a)和黑曲霉基因组DNA(b)Fig.1 Total RNA(a)and Genome DNA(b)of Aspergillus niger H7
由图1可以看出,抽提的黑曲霉总 RNA经电泳后28 S和18 S条带清晰,无拖尾,5 S部分降解较少,说明RNA完整性好,且28 S亮度比18 S略高,虽不能完全达到2∶1的比例,但仍可作为模板进行后续的逆转录实验。经紫外分光光度计检测,RNA样品的OD260/OD280均值为 1.942、OD260/OD230均值为2.061,说明抽提的总RNA完整性较好,纯度高,虽然有少量被降解的迹象,仍然能够满足后续RT2PCR的要求。
2.2 目的片段的扩增(图2)

图2 RT2PCR扩增 bg l(a)和PCR扩增 E5(b)Fig.2 RT2PCRamplification of bgl(a)and PCR product of E5(b)
由图2可以看出,扩增出的bg l片段大小约为2600 bp,E5片段大小约为1200 bp,分别与理论值2583 bp及1192 bp相符,初步认定是目的基因。
2.3 重组克隆载体的鉴定(图3)
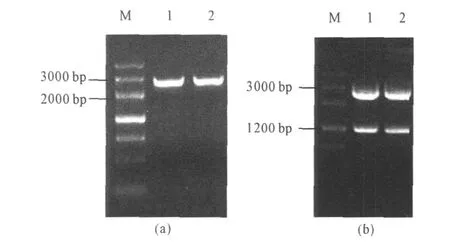
图3 pMD182T2bgl的 PCR验证(a)和pMD182T2E5的双酶切验证(b)Fig.3 Identification of pMD182T2bgl by PCR(a)and pMD182T2E5 by double digestion(b)
由图3可以看出,经 PCR扩增后,pMD182T2bgl能够得到与目的片段大小相符的特异性条带,pMD182T2E5双酶切后产生的两个条带分别与载体及目的片段大小相对应,表明bgl与E5已经成功克隆至 T载体。
2.4 bgl基因的序列测定及分析
对鉴定正确的重组菌株进行测序,结果显示bg l片段大小为2583 bp,其中 A 543个、T 579个、C 705个、G 756个、G+C为 56.56%。登录 NCB I进行BLAST比对,结果显示目的基因与4个分别来源于Aspergillus nigerNRRL3135(登录号 FN430671.1)、A s3.350(DQ 655704.1)、zju22(FJ262991.1),CBS513.88(XM 001398779.1)菌株及一个Aspergil2lus niger未知菌株(EU 233788.1)的β2葡萄糖苷酶m RNA序列同源性高达99%,氨基酸序列同源性为99%。与CBS513.88相比,bg l核苷酸序列共有18处碱基不同,其中12处对应的氨基酸序列未发生改变。
Bause等[9]提出糖苷水解酶家族3中成熟肽的第261位氨基酸A sp(D261)作为该酶的催化亲核位点是高度保守的,并且其周围氨基酸VM SDW也是高度保守序列。以DNA为模板扩增的E5序列正是包含该活性位点的区域,测序结果表明其氨基酸序列特征与上述报道完全一致,将其与全长测序结果比对,外显子5区域同源性达100%。
第三个研究问题旨在探索把英语作为二语或外语学习的大学生的词汇量与语言能力之间的相关性。相关性分析结果表明,除中高级水平受试者的控制产出性词汇知识量与其语言能力存在相关性以外,其它各变量间并无显著相关性。对此有两种可能的解释:一种可能性是测量工具本身,可能还没有在不同的层次之间进行足够的区分。另一种可能是因为学生的词汇量非常接近。因此,这一结论排除了将词汇量测试作为独立评估工具,来作为我们这样的教学背景下语言能力水平指标的可能性。然而,词汇量测试的结果也可用于教学目的。通过调查学生的二语或外语词汇知识,将为学生提供一个更合适的教学计划,以提高他们的词汇能力。
在 PROSITE数据库中(http://www.expasy.o rg/p rosite)搜索目的蛋白功能结构位点,结果表明其成熟肽(去除1~19信号肽序列)247~264位序列为LL KAELGFQGFVM SDWAA,其中第 261位为 A sp(D),与文献报道相一致,进一步表明该酶是糖苷水解酶家族3成员。在线采用 PROTPARAM程序(ht2 tp://expasy.org/cgi2bin/p rotparam)预测其编码蛋白的理化性质,结果表明其可编码860个氨基酸的蛋白质,目的蛋白大小预计为93.3 kD,理论p I值为4.60,酸性氨基酸残基总数(A sp+Glu)为100,碱性氨基酸(A rg+Lys)为60,表明其为酸性蛋白质。20种氨基酸中甘氨酸(Gly)含量最高,为10.5%;丙氨酸(A la)次之,为9.7%。
2.5 重组表达载体的酶切鉴定(图4)
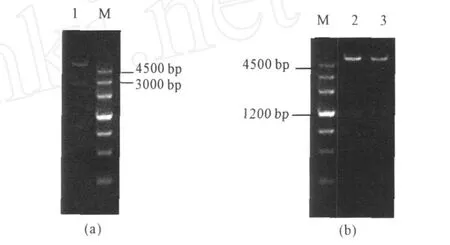
图 4 pET32a(+)2bgl(a)和 pET32a(+)2E5、pET28a(+)2E5(b)的双酶切验证Fig.4 Identification of pET32a(+)2bgl(a)and pET32a(+)2E5,pET28a(+)2E5(b)by double digestion
由图4可以看出,经BamH I及N otI双酶切后,三个重组质粒均能获得两个特异性条带,大小分别与目的片段及载体相符,表明目的基因已成功构建到表达载体。
2.6 重组蛋白的表达
经优化表达条件,最终获得目的蛋白最优诱导表达条件为:20℃下用0.5 mmol·L-1IPTG诱导表达12 h。SDS2PAGE电泳结果显示,含有p ET32a(+)2bg l、p ET32a(+)2E5、p ET28a(+)2E5 的重组菌能够产生特异性条带,形成分子量约为114 kD、63 kD及48.9 kD的目的蛋白,与理论值93.3 kD和43.6 kD有差异,这是由于p ET32a(+)、p ET28a(+)质粒本身分别带有 Trx和/或 His标签序列,其编码的蛋白与目的蛋白融合表达的结果。而未经诱导的重组菌并没有目的蛋白的表达。经 Gel2p ro软件分析,BGL目的蛋白含量约占总蛋白的32.14%。
经超声破碎之后,BGL蛋白大部分以包涵体形式存在于沉淀中,上清中只有少量蛋白表达,见图5。
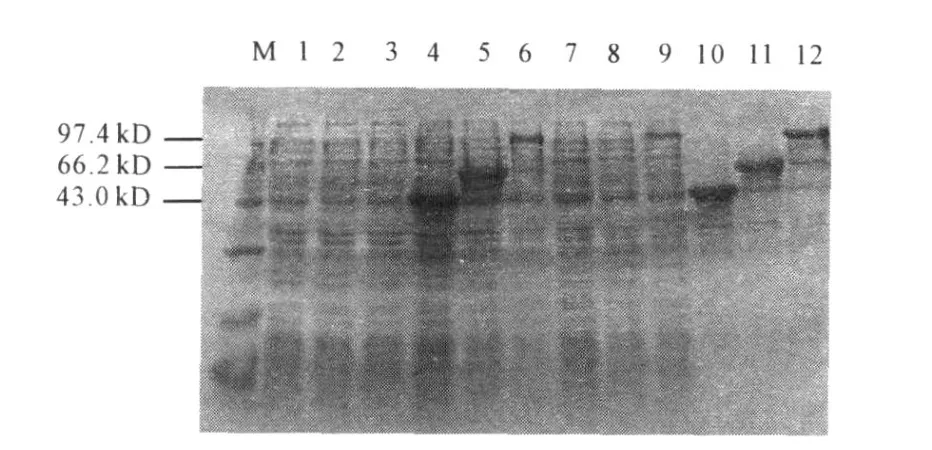
M.Molecular massmarker 1,4,7,10.p ET28a(+)2E5诱导前及诱导后全菌体、上清、沉淀 2,5,8,11.p ET32a(+)2E5诱导前及诱导后全菌体、上清、沉淀 3,6,9,12.p ET32a(+)2bg l诱导前及诱导后全菌体、上清、沉淀
3 结论
(2)测序结果表明,bg l全长2583 bp,推测其可编码一个860个氨基酸的蛋白质,与β2葡萄糖苷酶基因(XM 001398779.1)核苷酸序列同源性为99%,氨基酸序列同源性为99%,属于糖苷水解酶家族3,DNA上E5序列与bg l外显子5部分同源性达100%。
(3)将重组质粒在大肠杆菌中诱导表达,能够成功获得与预期大小相一致的融合蛋白。经超声破碎后,BGL蛋白大多以包涵体形式存在,上清中仅有少量蛋白,E5蛋白则完全以包涵体形式存在于沉淀中。
[1] Takashima S,Nakamura A,Hidaka M,et al.Molecular cloning and exp ression of the novel fungalβ2glucosidase genes fromHu2m icola griseaandTrichoderma reesei[J].J Biochem,1999,125(4):7282736.
[2] Iwashita K,Nagahara T,Kimura H,et al.ThebglAgene ofAs2pergillus kaw achiiencodes both extracellular and cellw all2boundβ2glucosidases[J].Applied and Environmental Microbiology,1999,65(12):554625553.
[3] Dharmawardhana D P,Ellis B E,Carlson J E.cDNA cloning and heterologous exp ression of coniferinβ2glucosidase[J].Plant Mo2 lecular Biology,1999,40(8):3652372.
[4] Dan S,Marton I,Dekel M,et al.Cloning,exp ression,characteriza2 tion and nucleophile identification of family 3,Aspergillus niger β2glucosidase[J].The Journal of Biologicai Chemistry,2000,275(7):497324980.
[5] 闫会平,吴兴泉,陈士华,等.黑曲霉β2葡萄糖苷酶的基因克隆[J].河南工业大学学报(自然科学版),2006,27(1):39242.
[6] 赵林果,周谭澈,李迅,等.黑曲霉β2葡萄糖苷酶基因的克隆及序列分析[J].化学与生物工程,2007,24(11):53257.
[7] 祝长青,李艳红,周辉,等.黑曲霉β2葡萄糖苷酶基因的分离[J].华中师范大学学报(自然科学版),2007,41(1):1022107.
[8] Dellaporta S L,Wood J,Hicks J B.A plant DNA minip repara2 tion:VersionⅡ[J].Plant Molecular Biology Repo rter,1983,1(4):19221.
[9] Bause E,Legler G.Isolation and amino acid sequence of a hexade2 capep tide from the active site ofβ2glucosidase A 3 fromAspergil2lusw entii[J].Hoppe Seylers Z Physiol Chem,1974,355(4):4382 442.
Clon ing and Expression of Aspergillus N igerβ2Glucosidase Gene in Escherichia Coli
ZHOU Xiao2m ing,MO Jun2ying,TAO Ye,FU Shui2lin,GONG Heng(State Key L ab of B ioreactor Engineering,East China University of Science and Technology,Shanghai200237,China)
Acco rding to the sequence ofAspergillus nigerβ2glucosidase gene published in GenBank,two pairs of specific p rimers were designed and synthesized.Using the total RNA and genome DNA ofAspergillus nigerH7 as template,bg lgene and exon 5 sequence were amp lified.PCR p roduct were then cloned into pMD182T vector and sequenced,the results showed the nucleoside sequence ofbg lwas2583 bp,the homology of target gene and its deduced am ino acid sequence to the published could reach 99%and 99%,respectively.E5 sequence w as 100%identical to the exon 5 region ofbg l.Then the exp ression vecto rs p ET32a(+)2bg l,p ET32a(+)2E5,p ET28a(+)2E5 w ere constructed and transfo rmed intoEscherichia coliBL 21(DE3).The recom bi2 nant strains w ere induced by 1 mmo l·L-1IPTG and the target p roteins w ere analyzed by SDS2PA GE.
Aspergillus niger;β2glucosidase;sequence analysis;p rotein exp ression
Q 786
A
1672-5425(2010)06-0050-04
2010-04-12
周晓明(1985-),女,江苏连云港人,硕士研究生,研究方向:分子生物学;通讯作者:宫衡,教授。E2mail:gongheng@ec2 ust.edu.cn。
