棉花脱氢抗坏血酸还原酶基因的克隆、原核表达与纯化
2010-10-28李学宁杜军伟李鸿彬
李学宁,杜军伟,李鸿彬
(1石河子大学生命科学学院/石河子大学农业生物技术重点实验室,石河子832003;2石河子大学动物科技学院,石河子832003)
棉花脱氢抗坏血酸还原酶基因的克隆、原核表达与纯化
李学宁1,杜军伟2,李鸿彬1
(1石河子大学生命科学学院/石河子大学农业生物技术重点实验室,石河子832003;2石河子大学动物科技学院,石河子832003)
为进一步探讨脱氢抗坏血酸还原酶的生物学功能,克隆棉花的脱氢抗坏血酸还原酶基因,对该基因进行了原核表达,并对重组蛋白进行纯化和分析。通过RT-PCR方法扩增脱氢抗坏血酸还原酶基因全长,利用BamH I和Xhol I酶切位点将其克隆至组氨酸(histidine,His)融合蛋白表达载体pET28a中,转化大肠杆菌BL21(DE3)后,经异丙基硫代-β-D-半乳糖苷(isopropy-β-D-5-thiogalactoside,IPTG)诱导表达,用 SDS-PAGE鉴定表达产物,并用亲和层析柱纯化重组表达的pET28a-DHAR蛋白。结果表明:重组体PET28a-DHAR经测序和酶切鉴定证实构建成功。导入大肠杆菌BL21进行表达,SDS-PAGE分析目的蛋白高效表达,相对分子量为26 kD左右,并获得了纯化的 His-DHAR融合蛋白。
棉花;脱氢抗坏血酸还原酶基因;克隆;原核表达
Abstract:A cotton dehydroascorbate reductase gene was cloned,and expression was performed using prokaryotic expression vector.The full-length cDNA of GhDHAR was cloned by RT-PCR,and then was constructed into pET28a vector containing histidine.Recombinant pET28a-DHAR plasmid was obtained after digestion using BamH I and Xhol I restriction endonuclease sites.Recombinant fusion protein was produced after transformation into E.coli BL21(DE3)with subsequent IPTGinduction,and was purified utilizing a histrap chromatogram column.SDSPAGE identification was also used to analysis the recombinant protein expression,and a particular 26 kD protein band visualized successfully.The results establish a basis for further functional research of DHAR gene and molecular mechanism elucidation of ascorbate participating cotton fiber fast elongation.
Key words:cotton;dehydroascorbate reductase gene;cloning;prokaryotic expression
纤维长度是棉花纤维品质最重要的参考指标之一,纤维的最终长度由细胞快速伸长发育时期所决定。当前的研究热点主要集中在激素对纤维的伸长发育的促进作用,如赤霉素、油菜素内酯、乙烯等[1-2];此外,已经发现很多基因参与纤维细胞的快速伸长发育,如与细胞骨架相关的 GhPFN1、GhACT1、GhTUB1,糖代谢相关的 GhSusy 等[3-6]。抗坏血酸(ascorbate acid,AsA)是普遍存在于植物组织的一种十分重要的抗氧化小分子物质,在细胞分裂旺盛的组织中含量较高。不仅对于保持细胞的还原状态有重要作用,还参与植物生长发育、分化、防卫和其它的许多生理过程,并且与应答胁迫条件的抗逆性密切相关[7]。目前,关于高等植物AsA功能和水平调控的生理机制及分子机制的研究,多集中于拟南芥、烟草等少数模式植物[8]。
脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR),是维持AsA浓度和保证细胞处于还原状态的限速酶,对于控制细胞内AsA的总量具有十分重要的作用。目前鲜有关于抗坏血酸与纤维伸长发育的报道。本试验旨在通过克隆与抗坏血酸合成密切相关的脱氢抗坏血酸还原酶基因,构建该基因的原核表达载体,并诱导表达获得较高纯度的蛋白,以期为进一步分析该蛋白活性,解析抗坏血酸参与棉花纤维细胞伸长发育的机制以及进一步的基因工程改良棉花纤维品质奠定良好的基础。
1 材料与方法
1.1 材料
陆地棉徐-142由本实验室培养;原核表达载体pET28a、大肠杆菌 DH5α、BL21由本实验室保存;凝胶回收试剂盒、质粒提取微量试剂盒购自 TIANGEN公司;RNA反转录试剂盒、限制性内切酶BamH I、Xhol I、T4连接酶购自大连宝生物公司;亲和层析柱购自 GE公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 棉花叶片总RNA的提取
采用改良CTAB法[9]提取棉花叶片总RNA:1)称取100 mg棉花幼嫩叶片,迅速放入液氮研磨呈粉末状,转入1.5 mL离心管内,加入预热65℃提取液 700μLβ-巯基乙醇,65℃温浴并震荡 20 min;2)加入等体积的氯仿∶异丙醇(24∶1)混匀,4℃12000 r/min离心10 min;3)吸上清装入新的离心管里,加入1/4体积的10 mol/L LiCl混匀后,-20℃过夜沉淀;4)4℃12000 r/min离心15 min,弃上清液,75%乙醇洗涤;5)4℃12000 r/min离心10 min,弃上清,空气干燥 10 min后加入 20μL DEPC水,1.0%琼脂糖凝胶电泳检测总RNA。
1.2.2 反转录cDNA及DHAR基因的PCR扩增
DHAR的核酸序列通过比对 Genebank中棉花纤维大量EST获得,根据DHAR基因编码序列设计引物扩增目的基因(包含BamH I和Xho I酶切位点,下划线所示),引物序列分别为:上游5′-GGATCCATGGCTTTGGAGATCTGTG-3′;下游 5′-CTCGAGTC ATGCATTCACCTTAGG-3′。参照 RNA反转录试剂盒说明书进行棉花叶片总RNA的反转录,并以反转录的棉花叶片cDNA为模板,进行PCR[10],扩增产物经1.0%琼脂糖凝胶电泳检测。
1.2.3 pET28a-DHAR原核表达载体的构建
将DHAR凝胶回收产物和原核表达载体pET28a分别用BamH I和 Xhol I进行双酶切,酶切产物用1.0%琼脂糖凝胶回收纯化[11]。分别取回收后的目的片段及载体片段(目的片段∶载体片段=7∶1),16℃连接过夜,然后转化DH5α感受态细胞,均匀涂布于 Kan+抗性固体LB培养基,37℃温箱过夜,挑取阳性克隆,送上海生工生物工程技术服务有限公司测序。
1.2.4 DHAR重组蛋白的诱导表达及 SDS-PAGE鉴定
将构建成功的重组质粒pET28a-DHAR和空质粒pET28a转化DE3感受态细胞,涂布 Kan+抗性固体LB培养基37℃温箱过夜,分别挑取重组质粒和空质粒的单克隆菌落接种于10 mL含 Kan+的LB液体培养基中,37℃培养过夜。各取上述过夜菌100μL转接入10 mL含 Kan+的新鲜LB中,37℃振荡培养至OD600为0.4~0.6时,各取1 mL菌液记为0 h(对照),然后加入 IPTG至终浓度为1 mmol/L,继续振荡培养,分别取加入 IPTG后2、4、6 h菌液1 mL。将收取的菌液于5000 r/min离心10 min后收集沉淀,用100μL 0.01 mol/L冰 PBS混悬。各加入2×SDS上样缓冲液100μL,煮沸5 min,12000 r/min离心 2 min,取上清15μL进行SDS-PAGE电泳(5%积层胶,12%分离胶)[12],凝胶用考马斯亮蓝染色。
1.2.5 DH AR重组蛋白的纯化及SDS-PAGE鉴定
分别接种2 mL重组菌和空载体菌的过夜菌液至200 mL含 Kan+的新鲜LB中,37℃振荡培养至OD600为 0.4~0.6时,加入 IPTG至终浓度为 1 mmol/L,37℃继续振荡培养4 h,收集菌液4℃,5000 r/min离心10 min后收集沉淀,用10 mL 0.01 mol/L冰 PBS清洗1遍,加入4 mL Lysis Buffer(pH 8.0)震荡混匀,反复冻融2次(-196 ℃冻、42 ℃融),冰浴超声裂解。4℃,12000 r/min离心20 min,取上清用亲和层析柱纯化。取试验组纯化产物10μL加入2×SDS上样缓冲液10μL,煮沸5 min,12000 r/min离心2 min,取15μL SDS-PAGE电泳(5%浓缩胶,12%分离胶)检测,凝胶用考马斯亮蓝染色。
2 结果与分析
2.1 棉花叶片总RNA的提取
用改良的CTAB法提取棉花叶片的总RNA,1.0%的琼脂糖凝胶电泳检测,结果显示提取的总RNA呈现2条带(图1),RNA质量良好。
图1 棉花叶片RNAFig.1 Cotton leaf RNA extract
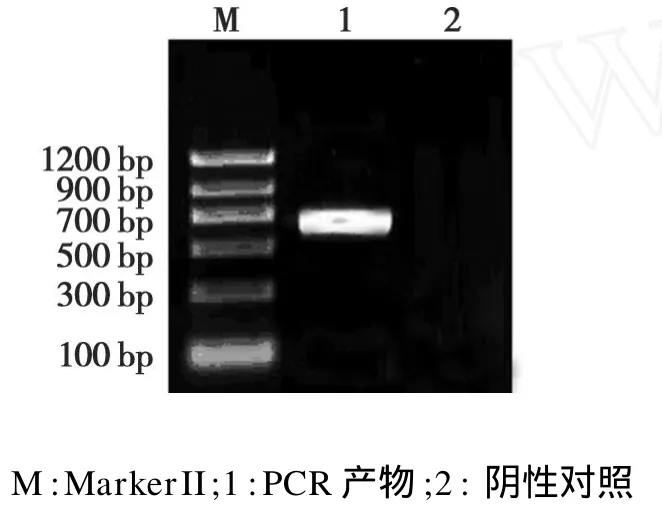
图2 DHAR基因的克隆Fig.2 PCR amplification of DHAR gene
2.2 DHAR基因的克隆
以反转录的棉花叶片cDNA为模板,通过PCR反应扩增DHAR基因,得到特异性片段,与预期的结果相符(图2)。棉花 GhDHAR基因包含639个核苷酸对,编码213个氨基酸的蛋白质,理论分子量为23.4 kD。
2.3 重组原核表达载体pET28a-DHAR的构建与鉴定
提取 pET28a-DHAR质粒,利用 BamH I和Xhol I进行双酶切,结果可见2条DNA条带,1条为载体片段,另1条为目的基因片段(图3)。经测序证实结果正确,表明原核表达载体构建成功。
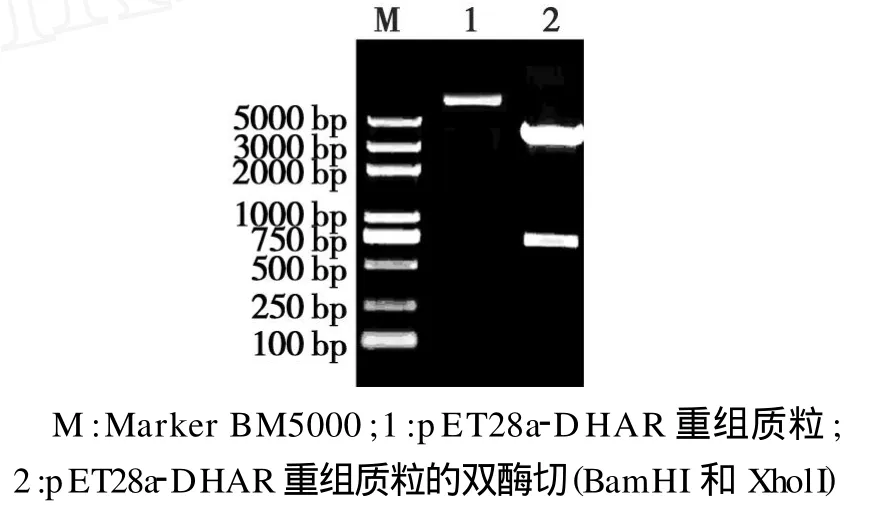
图3 pET28a-DHAR重组子的双酶切鉴定Fig.3 Identification of pET28a-DHAR recombinant plasmid by Bam HI and XhdI
2.4 重组蛋白的诱导表达纯化及 SDSPAGE鉴定
分别用 IPTG对pET28a-DHAR重组载体和pET28a空载体进行诱导表达,12%的SDS-PAGE电泳检测表达及纯化蛋白(图4),用亲和层析柱纯化(图5)。结果显示:在约 26 kD处得到与 His-DHAR融合蛋白相对分子质量相符的蛋白条带。
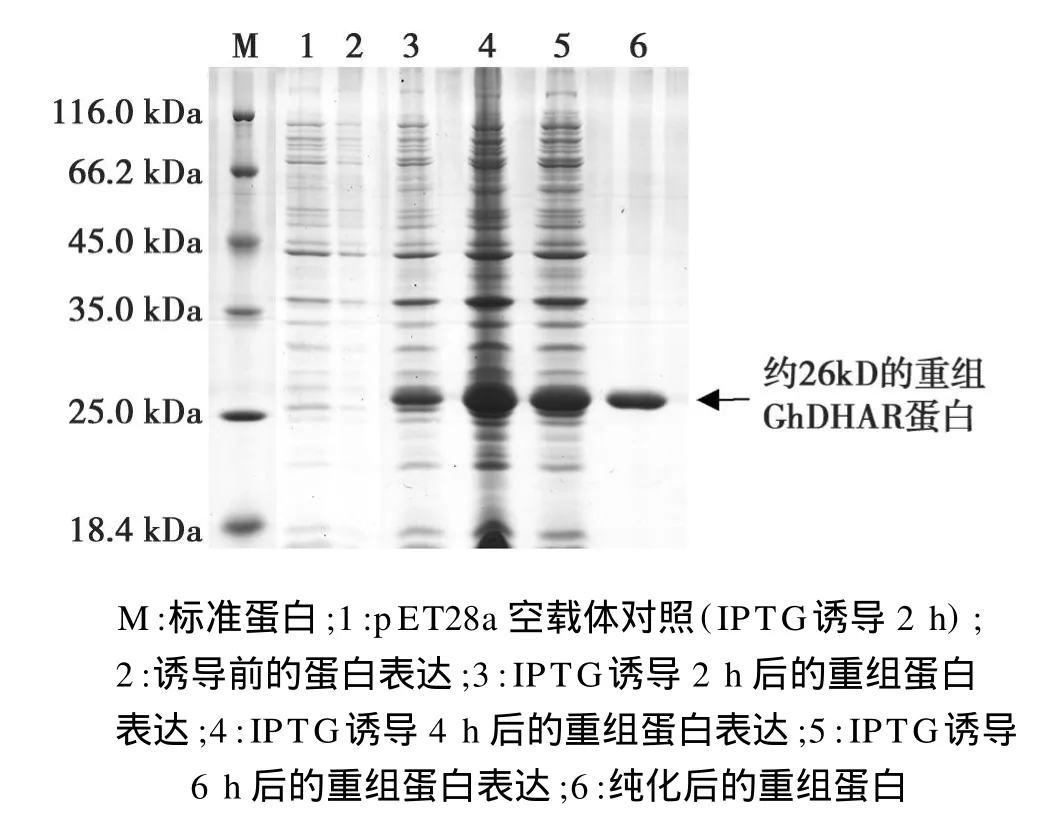
图4 重组GhDH AR蛋白的诱导表达与SDS-PAGE电泳分析Fig.4 Induced expression and SDS-PAGE analysis of recombinant GhDHAR protein
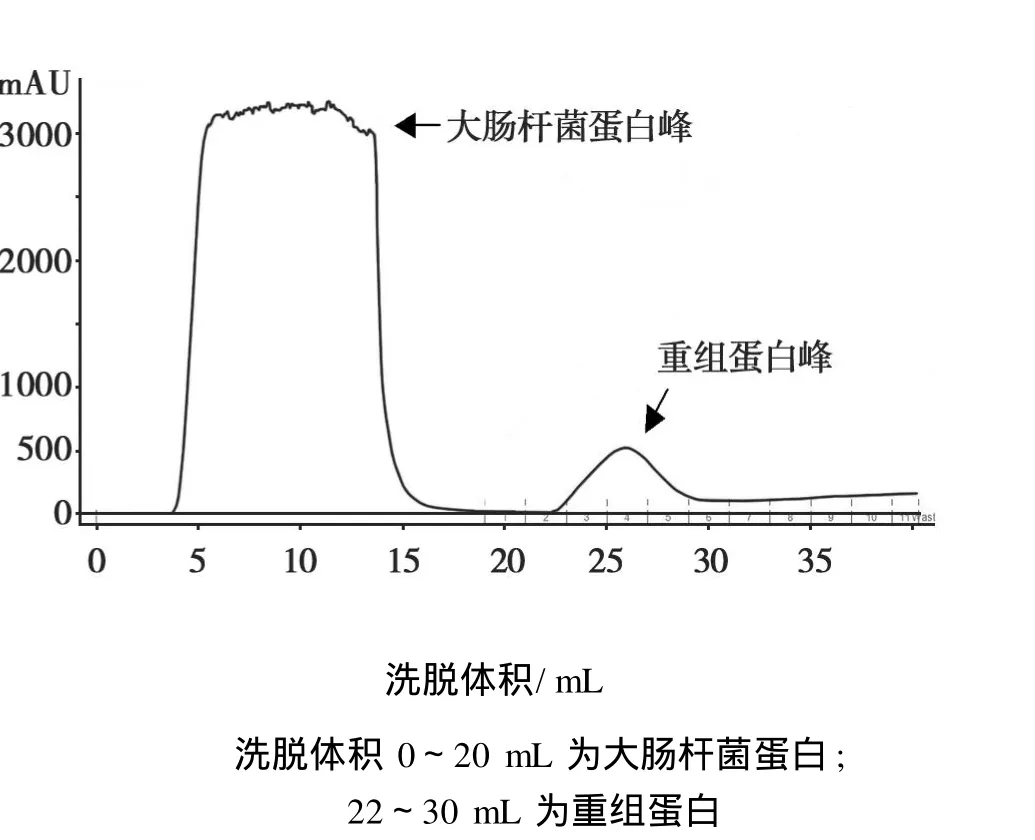
图5 重组 GhDHAR蛋白的纯化Fig.5 Purification of recombinant GhDHAR protein
3 讨论
在植物细胞中存在一个重要的谷胱甘肽-抗坏血酸循环,其作用是除去细胞中的活性氧[13]。这个循环由四种酶即抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHA)、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)催化。DHAR基因的过量表达可以提高植物体内还原性抗坏血酸的含量,使植物氧化还原系统功能明显增强[14],并且可以通过调节细胞内AsA的量参与细胞快速生长[15]。此外,AsA与细胞的伸长发育紧密相关,可能通过诱导使ROS产生的分泌型过氧化物酶的表达、抑制使细胞壁变硬的酶的表达和参与细胞壁胞外多糖的切割,使细胞壁膨胀疏松参与细胞伸长发育[16-18]。
本试验选用了pET28a原核表达载体,该载体带有 His标签蛋白,融合蛋白产物可通过亲和层析柱纯化快速、简便的纯化。本试验通过SDS-PAGE检测,表达的融合蛋白相对分子质量为26 kD,其为His和DHAR基因相对分子质量之和。结果表明pET28a-DHAR重组载体成功表达了 His-DHAR融合蛋白,并且还对该融合蛋白进行了初步纯化,为下一步继续探讨DHAR的生物学功能提供了必要条件,为基因工程改良棉花纤维品质奠定了基础,也为解析纤维发育的分子机制提供了参考依据。
[1]Shi Y H,Zhu S W,Mao X Z,et al.Transcriptome profiling,molecular biological,and physiological studies reveal a major role for ethylene in cotton fiber cell elongation[J].The Plant Cell,2006,18:651-664.
[2]Sun Y,Veerabomma S,Abdel-Mageed H A,et al.Brassinosteroid regulates fiber development on cultured cotton ovules[J].Plant Cell Physiol,2005,46:1384-1391.
[3]Wang H Y,Yu Y,Chen ZL,et al.Functional characterization of G ossypium hirsutum profilin 1 gene(GhPFN1)in tobacco suspension cells[J].Plant,2005,222:594-603.
[4]Li XB,Fan X P,Wang X L,et al.The cotton ACTIN1 gene is functionally expressed in fibers and participates in fiber elongation[J].The Plant Cell,2005,15:952-964.
[5]Li XB,Cai L,Cheng N H,et al.Molecular characterization of the cotton GhTUB1 gene that is preferentially expressed in fiber[J].The Plant Cell,2002,130:666-674.
[6]Ruan Y L,Chourey P S.A fiberless seed mutation in cotton is associated with lack of fiber cell initiation in ovule epidermis and alterations in sucrose synthase expression and carbon partitioning in developing seeds[J].Plant Physiol,1998,118:399-406.
[7]Shao H B,Chu L Y,Lu Z H,et al.Primary antioxidant free radical scavenging and redox signaling pathways in higher plant cells[J].Int J Biol Sci,2008,4:8-14.
[8]Chewo,Whelan J,Mhlarah.Molecular definition of the targeting of antioxidant defemes in plants[J].The Joumal of Biological Chemistry,2003,278:46869-46877.
[9]蒋建雄,张天真.利用CTAB/酸酚法提取棉花组织总RNA[J].棉花学报,2003,15(3):166-167.
[10]崔百明,封玲,王爱英,等.转基因棉 PCR与卡那霉素检测的比较[J].石河子大学学报:自然科学版,2000,4(2):103-106.
[11]赵红英,祝建波,王爱英,等.HARDY转录因子原核表达的研究[J].石河子大学学报:自然科学版,2009,27(4):397-400.
[12]彭晓明,王重,徐登献,等.天山雪莲 PsbO基因的克隆、原核表达及其烟草中的遗传转化[J].石河子大学学报:自然科学版,2008,26(4):397-401.
[13]Potters G,Horenans N,Bellone S,et al.Dehydroascorbate influences the plant cell cycle througha ghtathione independent reduction mechanism[J].Plant Physiol,2004,134:1479-1487.
[14]侯丙凯,夏光敏.植物基因工程表达载体的改进和优化策略[J].遗传,2001,23:492-497.
[15]Horemans,N,Potters,G,De Wilde,L,et al.Dehydroascorbate uptake activity correlates with cell growth and cell division of tobacco bright yellow-2 cell cultures[J].Plant Physiol,2003,133:361-367.
[16]Cordoba-Pedregosa Mdel,C Villalba,J M Cordoba F,et al.Changes in intracellular and apoplastic peroxidase activity,ascorbate redox status,and root elongation induced by enhanced ascorbate content inA llium cepa L.[J].J Exp Bot,2005,56:685-694.
[17]Miller J G,Fry S C.Characteristics of xyloglucan after attack by hydroxyl radicals[J].Carbohydr Res,2001,332:389-403.
[18]Pastori G M,Kiddle G,Antoniw J,et al.Leaf vitamin C contents modulate plant defense transcripts and regulate genes that control development through hormone signaling[J].The Plant Cell,2003,15:939-951.
Cloning,Prokaryotic Expression and Purification of a Cotton Dehydroascorbate Reductase Gene
LI Xuening1,DU Junwei2,LI Hongbin1
(1 College of Life Sciences/Key Laboratory of Agrobiotechnology,Shihezi University,Shihezi 832003,China;2 College of Animal Science and Technology,Shihezi University,Shihezi 832003,China)
S513
A
1007-7383(2010)05-0542-04
2009-11-27
国家自然科学基金项目(30860031)
李学宁(1984-),男,硕士生,专业方向为植物分子生物学;e-mail:lixuening2009@126.com。
李鸿彬(1980-),男,副教授,博士,从事植物分子生物学与基因工程研究;e-mail:lihb@shzu.edu.cn。
