早期胚胎发育期暴露1-辛基-3-甲基咪唑离子液体后对金鱼仔鱼的氧化损伤
2010-10-23李效宇皇培培王春雨
李效宇,皇培培,王春雨
河南师范大学生命科学学院,新乡453007
早期胚胎发育期暴露1-辛基-3-甲基咪唑离子液体后对金鱼仔鱼的氧化损伤
李效宇*,皇培培,王春雨
河南师范大学生命科学学院,新乡453007
离子液体的生物毒性受到越来越多关注,但目前该方面的研究报道很少.采用溴化1-辛基-3-甲基咪唑离子液体([C8mim]Br)处理金鱼胚胎,研究了金鱼早期胚胎发育期暴露离子液体后对金鱼仔鱼的氧化损伤.通过预实验获得金鱼胚胎(卵裂期)72小时半致死浓度(LC50)为209mg·L-1,根据该结果设计胚胎发育期离子液体的亚慢性暴露浓度为10.45mg·L-1、20.9mg·L-1、41.5mg·L-1、104.5mg·L-1.实验结果表明,与对照组相比,低浓度离子液体处理组(10.45mg·L-1和20.9mg·L-1)超氧化物歧化酶活性显著上升,高浓度处理组(41.55mg·L-1和104.55mg·L-1)极显著下降.谷胱苷肽过氧化物酶活性除10.455mg·L-1处理组为不显著上升外,其余3组均为显著下降.4个处理组丙二醛含量均比对照组显著增高,且呈现明显的剂量-效应关系.该实验结果表明,经过胚胎发育期暴露离子液体后,[C8mim]Br对金鱼仔鱼组织抗氧化系统仍产生较强的氧化损伤并引起脂质过氧化作用.因此,有必要研究离子液体对水生态系统中水生动物种群的影响,并对离子液体的生态安全做出科学评价.
离子液体;金鱼;氧化损伤
1 引言(Introduction)
传统的化学反应和化合物分离过程由于涉及大量易挥发有机溶剂,容易对环境造成严重污染.近年来,一种新型绿色溶剂——离子液体引起人们的高度重视,有望成为传统有机溶剂的替代者(顾浩等,2005).离子液体是指在室温下呈液态的、由离子构成的化学物质(Brennecke and Maginn,2001;Sheldon,2001;Gathergood et al.,2004;韩金玉等,2005).离子液体具有很多特殊的化学性质,如不挥发、不易燃、导电性强、性质稳定等(Suarez et al.,1998;Welton,1999;Brennecke and Maginn,2001;Gathergood et al.,2004).另外,离子液体对许多无机盐和有机物都有良好的溶解性(Gordon,2001;Couling et al.,2006).
虽然离子液体无挥发性不会造成大气污染,但它们极易溶于水,所以在合成和应用过程中不免会流失到水中并对水环境造成污染.迄今为止,关于离子液体的生物毒性及其毒理学研究资料还相当缺乏(Ranke et al.,2004;2007),国内外仅有少量的研究报道.Stepnowski等(1998)、Stock等(2004)首先研究了离子液体的生物毒性,证明离子液体对生物体及其细胞确实存在明显的毒性.Latala等(2005)初步研究了咪唑类离子液体对两种海藻(Oocystis submarina和Cyclotella meneghiniana)的毒性,发现在5~500μmol·L-1浓度范围内的离子液体处理均对海藻的个体生长、群体密度有很强的抑制作用.同时,Docherty和Kulpa(2005)通过实验研究发现离子液体对培养的微生物有极明显的生长抑制作用,而且其毒性影响随着离子液体碳链的延长而增强.Pretti等(2006)用15种应用广泛的离子液体对斑马鱼(Danio rerio)进行急性毒性处理,结果显示被测离子液体的毒性强于甲醇、丙酮等几种传统有机溶剂,且使斑马鱼产生了明显的畸形及行为异常.另外,近期Luo等(2008)、Li等(2009)还研究了离子液体对Daphnia和蛙的发育毒性.但总体看来,关于离子液体的生物毒性、毒性机理及其环境风险评价的研究仅有零星报道,多为离子液体的基础生物毒性研究工作.
烷基取代的阳离子离子液体作为离子液体中的一大类,因其独特的结构与性能而一直是研究的重点.其中溴化1-辛基-3-甲基咪唑([C8mim]Br)是目前国内外应用较广泛的一类离子液体(Gathergood et al.,2004;顾浩等,2005;Ranke et al.,2007).关于[C8mim]Br对鱼类胚胎和幼体的毒性及其机理方面的研究还未见相关报道.
金鱼(Carassius auratus)具有丰富的生物学背景资料,分布广泛而且易于饲养繁殖,胚胎收集方便.本实验用溴化1-辛基-3-甲基咪唑离子液体([C8mim]Br)处理金鱼胚胎,研究了金鱼早期胚胎发育期暴露离子液体后对金鱼仔鱼的氧化损伤并初步探讨[C8mim]Br对金鱼胚胎和幼鱼毒性的机理.
2 材料与方法(Materials and methods)
2.1 离子液体
本实验所用的离子液体为溴化1-辛基-3-甲基咪唑,呈淡黄色粘稠状,其结构如图1所示,由河南师范大学化学与环境科学学院提供.
2.2 金鱼卵
采集于新乡市近郊某金鱼养殖场,检测无背景干扰.金鱼卵为刚进行人工受精后吸水膨胀的受精卵,立即送到实验室用于毒性实验.
2.3 胚胎发育与孵化
金鱼卵在12cm×12cm培养皿中进行孵化,每皿100~120个,盛放无菌孵化液100mL,孵化液采用ISO(International Organization for Standardization,1999)推荐的人工配制稀释水(每升蒸馏水中加入294mg CaCl2·2H2O,123mg MgSO4·7H2O,65mg NaHCO3,6mg KCl),硬度为200mg·L-1(以CaCO3计),pH为7.8±0.2,孵化温度保持在20~22℃,溶氧不低于6mg·L-1,光暗比为16:8.孵化液每天更换1次.
2.4 暴露方法
通过预实验获得金鱼胚胎(卵裂期)72h半致死浓度(LC50)为209mg·L-1,根据该结果设计4个浓度组,分别为10.45、20.90、41.5和104.5mg·L-1,每组3个平行,每平行100枚胚胎,并设空白对照组(不含离子液体的无菌孵化液).在卵裂期开始进行毒物处理,待仔鱼孵出后(仔鱼出膜)立即停止染毒.收集孵出仔鱼,分别用自来水、蒸馏水和4℃磷酸缓冲液依次冲洗,将仔鱼装入离心管中,加入定量磷酸缓冲液,在冰浴条件下用内切式匀浆机进行匀浆,得到10%组织匀浆液.将匀浆液用冷冻离心机于4℃离心.取上清液保存于-20℃备用.
2.5 抗氧化酶活性与MDA含量测定
幼鱼组织SOD、GSH-Px活性,MDA、蛋白质含量均用试剂盒测定,测定方法按试剂盒说明和要求进行.试剂盒购自南京建成生物工程公司.SOD活性定义为每mg组织蛋白在1mL反应液中SOD活性抑制率达50%时所对应的SOD量为1个SOD活力单位(U·mgPr-1).GSH-Px活性定义为每mg蛋白质在每分钟扣除非酶促反应使GSH浓度降低1μmol·L-1为1个酶活力(U·mgPr-1).MDA的含量定义为每mg蛋白中含MDA的纳摩尔数.
2.6 统计学分析
所有数据均采用SPSS11.5 for Windows软件进行单因素方差分析(ANOVA),用最小显著差数法(LSD)进行多重比较,同时还利用了Excel 2003进行分析作图,数据结果用平均数±标准偏差表示.显著性差异以p值表示,p<0.05(*)表示差异显著;p<0.01(**)表示差异极显著.
3 结果(Results)
3.1 [C8mim]Br对金鱼仔鱼组织中SOD活性的影响
如图2所示,4个处理组与对照组相比,除10.45mg·L-1组为显著差异,其余3组均为极显著差异.SOD活性在10.45mg·L-1和20.9mg·L-1组

呈现稳步上升趋势.但当离子液体浓度上升到41.5mg·L-1时,SOD活性反而下降,高浓度组104.5mg·L-1下降极显著,呈明显的活性抑制状态.
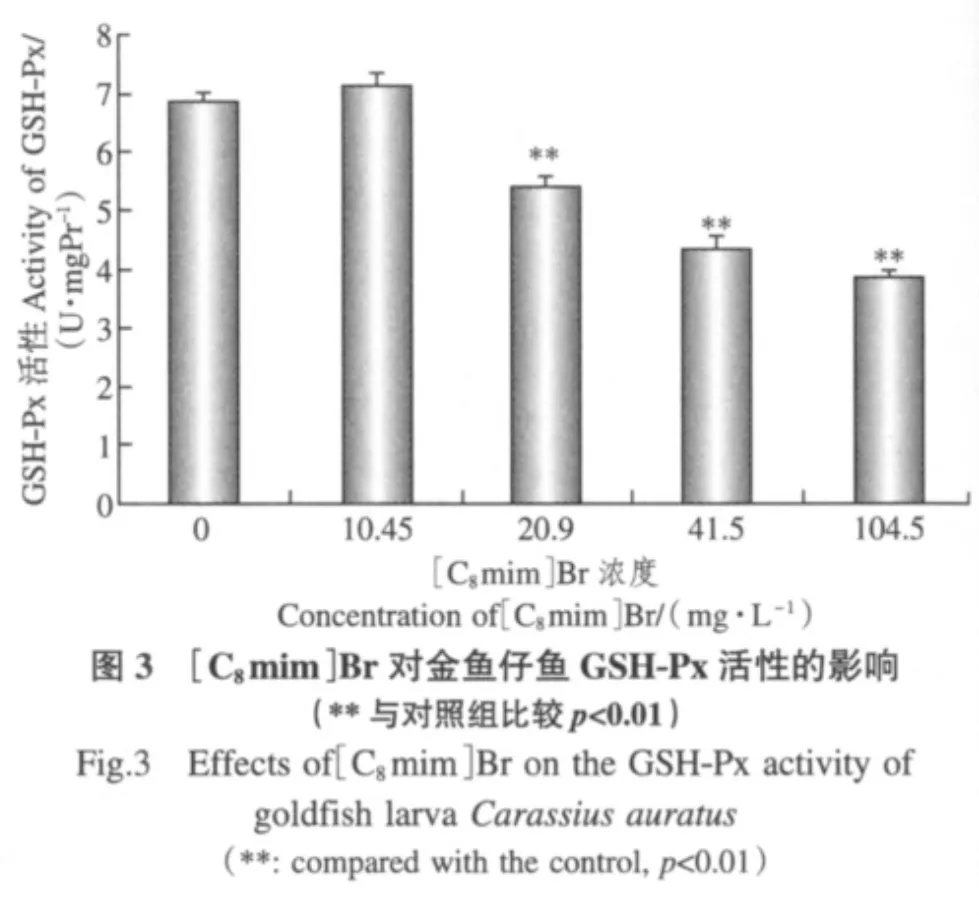
3.2 [C8mim]Br对金鱼仔鱼GSH-Px活性的影响
由图3可见,与对照组相比,10.45mg·L-1组为不显著上升,20.9mg·L-1、41.5mg·L-1和104.5mg·L-1组呈依次下降趋势,且均具有极显著差异.即随着离子液体处理浓度的升高,GSH-Px活性抑制率升高.
3.3 [C8mim]Br对金鱼仔鱼MDA含量的影响
与对照组相比,4个处理组金鱼仔鱼组织的MDA含量均呈现依次逐渐上升趋势,而且具有明显的剂量-效应关系.除10.45mg·L-1组为显著差异,其余3组均为极显著差异.说明[C8mim]Br对金鱼仔鱼产生了氧化损伤和脂质过氧化作用.

4 讨论(Discussion)
咪唑类离子液体作为良好的溶剂,对无机物、有机物和高分子聚合物都有较强的溶解性,它们已被应用于化学化工等研究和应用领域(张保芳等,2006).Ranke等(2004)研究了咪唑类离子液体对细菌Vibrio fischeri的毒性作用,比较了不同碳链长度和阴离子对毒性大小的影响,并与4种常用的传统溶剂甲醇、丙酮、乙腈和MTBE(甲基叔丁基醚)相应的EC50(半数效应浓度,Median Effect Concentration)值进行比较,结果发现离子液体对Vibrio fischer的毒性大于甲醇、丙酮和乙腈,毒性最小的离子液体其EC50与MTBE接近.
在长期的生物进化过程中,需氧生物发展了防御过氧化损害的系统——抗氧化防御系统(Antioxidant defense system),其组分包括抗氧化酶,如谷胱甘肽过氧化酶(GSH-Px)、超氧化物歧化酶(SOD),过氧化氢酶(CAT).抗氧化物,如谷胱甘肽(GSH)、维生素E(VE)、β-胡萝卜素.逆境或化学毒物可以诱发生物体产生大量的活性氧(Reactive oxygen species,ROS),当ROS不能及时被机体内抗氧化防御系统消除时,它们即可对生物体造成氧化损伤,如使细胞DNA链断裂、脂质过氧化、酶蛋白失活等,从而引起机体氧化胁迫(Oxidative stress)或氧毒性(孔繁翔,2000;陈瑗和周玫,2002).
SOD主要分布于细胞胞浆和线粒体的基质中,是催化超氧阴离子自由基(O2-)发生歧化反应的一类金属酶,是机体防御过氧化损害的关键酶之一.其基本功能是清除生物体内过高浓度的超氧阴离子自由基,保持体内自由基的代谢平衡.从而保持细胞正常的代谢不受破坏(陈瑗和周玫,2002).有研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高;而当受到重度胁迫时,SOD活性则将被抑制,使生物体内积累过量的ROS,从而导致对生物体的伤害(Liesivuori and Savolainen,1991;SkrzydlewskandFarbiszewski,1997).低浓度[C8mim]Br处理,诱导生物体内产生少量自由基,这对SOD的活性起到诱导作用,使SOD活性升高以清除这些少量过剩的自由基.高浓度的离子液体处理组(40.5mg·L-1和104.5mg·L-1)的SOD活性明显下降,可能是由于在高浓度[C8mim]Br的胁迫下,体内的抗氧化防御系统已经不能清除生物体内产生的过量自由基,从而引起机体的氧化损伤,进而抑制了SOD活性.
GSH-Px是以H2O2作为底物催化形成H2O,消除H2O2(陈瑗和周玫,2002).已有研究表明,GSHPx活性可被低剂量毒物诱导升高(Morales et al.,2004).本试验中10.45mg·L-1浓度组的GSH-Px活性升高,这是由于低浓度毒物的胁迫及诱导,使得GSH-Px活性升高以清除产生的自由基.其余浓度的GSH-Px活性都下降.这些结果与SOD活性变化基本相似.可以说明GSH-Px和SOD防御氧化胁迫的过程基本一致,而且二者通常协调配合消除自由基.
脂质过氧化过程是一个产生自由基和自由基参与的链式反应,丙二醛(MDA)是脂质过氧化的最终产物,常被用作脂质过氧化的指示指标(陈瑗和周玫,2002;Morales et al.,2004).本实验结果表明,丙二醛含量随着[C8mim]Br浓度的增加而逐步上升,呈现显著的剂量-效应关系.这说明随着毒物浓度升高,体内产生的ROS已经不能完全被机体的抗氧化防御系统消除,从而引起氧化损伤程度加剧,导致MDA含量急剧增加.
从本实验结果可见,[C8mim]Br在金鱼胚胎发育早期开始暴露,尽管孵化后脱离了该离子液体的暴露,但仍然对金鱼仔鱼组织的抗氧化系统产生较强的毒害作用,引起较严重的氧化损伤并引发脂质过氧化.本文实验结果说明,[C8mim]Br对金鱼胚胎和幼鱼具有一定的毒性,而且产生这种毒性的机制可能与离子液体诱导产生的氧化损伤有关.本实验结果也提示,一旦该类离子液体在合成或使用的过程中流失到水环境中去,将对水生生态系统构成一定的威胁.因此,有必要全面系统和深入地研究离子液体对水生动物的毒性,并依据这些毒理学实验结果对离子液体的环境风险做出科学的评价.
Brennecke J F,Maginn E J.2001.Ionic liquids:Innovative fluids for chemical processing[J].AIChE Journal,47(11):2384-2389
Chen Y,Zhou M.2002.Medicine and Pathology of Free Radical[M].Beijing:People Hygiene Press,8-167
Couling D J,Bernot R J,Docherty K M,Dixon J K,Maginn E J.2006.Assessing the factors responsible for ionic liquid toxicity to aquatic organisms via quantitative structure-property relationship modeling[J].Green Chemistry,8(1):82-90
Docherty K M,Kulpa C F.2005.Toxicity and antimicrobial activity of imidazolium and pyridinium ionic liquids[J].Green Chemistry,7(4):185-189
Gathergood N,Garcia M T,Scammells P J.2004.Biodegradable ionic liquids:Part I.Concept,preliminary targets and evaluation[J].Green Chemistry,6(3):166-175
Gordon C M.2001.New developments in catalysis using ionic liquids[J].Applied Catalysis A:General,222(1-2):101-117
Gu H,Fang Y X,Zhang K.2005.Property and application of room temperature ionic liquid[J].Fine and Specialty Chemicals,13(7):10-11(in Chinese)
Han J Y,Huang X,Wang H,Wang Z W.2005.Progress in aharacteristicandapplicationofionicliquidasgreensolvent[J].Chemical Industry and Engineering,22(1):62-66(in Chinese)
International Organization for Standardization(ISO).1999.ISO 12890 Water quality-Determination of toxicity to embryos and larvae of fresh water fish-semi-static method[S].USA:Multiple.Distributed through American National Standards Institute(ANSI)
KlaassenCD.2001.PrinciplesofToxicology[M].USA:McGraw-Hill Professional Publishing,11-32
Kong F X.2000.Environmental Biology[M].Beijing:Higher Education Press,72-74(in Chinese)
Latala A,Stepnowski P,Nedzi M,Mrozik W.2005.Marine toxicity assessment of imidazolium ionic liquids:Acute effects on the Baltic algae Oocystis submarina and Cyclotella meneghiniana[J].Aquatic Toxicology,73(1):91-98
Li X Y,Zhou J,Yu M,Wang J J,Pei Y C.2009.Toxic effects of 1-methyl-3-octylimidazolium bromide on the early embryonicdevelopmentofthefrogRananigromaculata[J].Ecotoxicology and Environmental Safety,72(1):552-556
LiesivuoriJ,SavolainenH.1991.Methanolandformicacid toxicity:biochemical mechanisms[J].Pharmacology&Toxicology,69(3):157-163
Luo Y R,Li X Y,Chen X X,Zhang B J,Sun Z J,Wang J J.2008.The developmental toxicity of 1-methyl-3-octylimidazolium bromide on Daphnia magna[J].Environmental Toxicology,23(6):736-744
MoralesAE,Pérez-JiménezA,HidalogMC,AbellánE,CardeneteG.2004.Oxidativestressandantioxidantdefenses after prolonged starvation in Dentex dentex liver[J].Comparative Biochemistry and Physiology.Toxicology&Pharmacology:CBP,139(1-3):153-161
Pretti C,Chiappe C,Pieraccini D,Gregori M,Abramo F,Monni G,Intorre L.2006.Acute toxicity of ionic liquids to the zebrafish(Danio rerio)[J].Green Chemistry,8(3):238-240
Ranke J,Mölter K,Stock F,Bottin-Weber U,Poczobutt J,Hoffmann J,Ondruschka B,Filser J,Jastorff B.2004.Biological effects of imidazolium ionic liquids with varying chain lengths in acuteVibriofischeriandWST-1cellviabilityassays[J].Ecotoxicology and Environmental Safety,58(3):396-404
Ranke J,Stolte S,Störmann R,Arning J,Jastorff B.2007.Design of sustainable chemical products-theexampleofionic liquids[J].Chemical Reviews,107(6):2183-2206
Sheldon R.2001.Catalytic reactions in ionic liquids[J].Chemical Communication,23:2399-2407
Skrzydlewsk E,Farbiszewski R.1997.Antioxidant status of liver,erythrocytes,and blood serum of rats in acute methanol intoxication[J].Alcohol,14(5):431-437
Stepnowski P,Skladanowski A C,Ludwiczak A,Laczyńska E.2004.Evaluating the cytotoxicity of ionic liquids using human cell line HeLa.[J].Human&Experimental Toxicology,23(11):513-517
Stock F,Hoffmann J,Ranke J,Störmann R,Ondruschka B,Jastorff B.2004.Effects of ionic liquids on the acetylcholinesterase:a structure-activity relationship consideration[J].Green Chemistry,6(6):286-290
Suarez P A Z,Einloft S,Dullius J E L,de Souza R F,Dupont J.1998.Synthesisandphysical-chemicalpropertiesofionic liquids based on 1-n-butyl-3-methylimidazolium cation[J].The Journal of Chemical Physics,95(7):1626-1639
Welton T.1999.Room-temperature ionic liquids.Solvents for synthesis and catalysis[J].Chemical Reviews,99(8):2071-2083
ZhangBF,PuM,ChenBH,LiuKH.2006.New environmental-friendmaterial-imidazoliumrbasedionicliquids[J].Journal of Materials Science and Engineering,24(1):165-168(in Chinese)
中文参考文献
陈瑗,周玫.2002.自由基医学基础与病理生理[M].北京:人民卫生出版社,8-167
顾浩,方岩雄,张焜.2005.室温离子液体的性质和应用[J].精细与专用化学品,13(7):10-11
韩金玉,黄鑫,王华,王占卫.2005.绿色溶剂离子液体的性质和应用研究进展[J].化学工业与工程,22(1):62-66
孔繁翔.2000.环境生物学[M].北京:高等教育出版社,72-74张保芳,蒲敏,陈标华,刘坤辉.2006.一类新型绿色环保的介质材料——咪唑类离子液体[J].材料科学与工程学报,24(1):165-168◆
Oxidative Stress of the Ionic Liquid 1-Octyl-3-Methylimidazolium Bromide on the Goldfish Larva Carassius auratus Hatching from the IL-treated Embryos
LI Xiao-yu*,HUANG Pei-pei,WANG Chun-yu
College of Life Science,Henan Normal University,Xinxiang 453007
The toxicity of ionic liquids(ILs)on organisms and environment has been concerned recently by scientists,but there have been only few reports available in literature until now.Oxidative stress of the ionic liquid 1-Octyl-3-methylimidazolium bromide([C8mim]Br)on Carassius auratus hatching from the treated embryos was evaluated in the present study.First,the 72h 50%lethal concentrations for[C8mim]Br in goldfish embryos Carassius auratus at the stage of cleavage were determined by preliminary acute toxicity tests.According to the results of acute toxicity tests,fish embryos at cleavage stage were exposed to 10.4,20.8,41.6 and 104mg·L-1of[C8mim]Br until their hatching stage.Superoxide dismutase,glutathione peroxidase and malondialdehyde content were examined.The results showed that superoxide dismutase activity of fish larva increased in the concentrations of 10.45mg·L-1and 20.9mg·L-1while it significantly decreased in the concentrations of 41.5mg·L-1and 104.5mg·L-1when compared with the control groups.Meanwhile,the activity of glutathione peroxidase was significantly decreased in all treatment groups except of the lowest concentration of 10.45mg·L-1.In addition,a persistent elevation of the malondialdehyde content in the treatment groups was noted with the increase of[C8mim]Br-exposure concentrations,showing a obvious dose-response relationship between the malondialdehyde content of fish larva and IL’s concentration.These results indicate that aqueous[C8mim]Br can cause impairment to Carassius auratus embryos and larva by inducing oxidative stress and the risk to aquatic ecosystem by ILs-leaking into water body has to been evaluated in the future.
ionic liquids;goldfish;oxidative stress
28 January 2009accepted19 March 2009
1673-5897(2010)1-100-05
R994.6
A
2009-01-28录用日期:2009-03-19
国家自然科学基金(No.20573019;No.20573034);教育部留学回国人员科研启动基金(No.[2006]331)
李效宇(1965—),男,教授;*通讯作者(Corresponding author),E-mail:lixiaoyu65@263.net
李效宇(1965—),男,博士,教授,博士生导师,现为河南师范大学生命科学学院教授.主要从事蓝藻毒素和离子液体生态毒理学研究.承担国家自然科学基金、河南省杰出青年基金等项目,在国内外核心学术刊物上发表学术论文40余篇.
