盐度胁迫下盐生隐杆藻抗氧化防御系统的变化
2010-10-23周亚维焉婷婷李朋富刘志礼
周亚维, 焉婷婷, 李朋富, 刘志礼
(南京大学 生命科学学院, 江苏 南京 210093)
盐度胁迫下盐生隐杆藻抗氧化防御系统的变化
周亚维, 焉婷婷, 李朋富, 刘志礼
(南京大学 生命科学学院, 江苏 南京 210093)
盐生隐杆藻(Aphanothece halophytica)是在饱和 NaCl条件下可以生存的少数几种耐盐蓝藻之一,作者研究了盐胁迫对盐生隐杆藻细胞内丙二醛含量、2种非酶抗氧化剂含量以及4种抗氧化酶活性的影响。与对照组相比, 低盐胁迫和高盐胁迫都抑制盐生隐杆藻的生长。随着盐度胁迫程度的增加, 丙二醛含量、非酶抗氧化剂含量和抗氧化酶(除了过氧化氢酶)活性不断增强。上述结果表明: 盐胁迫下,盐生隐杆藻细胞内非酶抗氧化剂和抗氧化物酶水平的增加可以应对细胞内升高的氧化伤害, 抗氧化防御系统可能在盐生隐杆藻对盐胁迫的耐受机制中发挥了重要作用。
盐生隐杆藻(Aphanothece halophytica); 丙二醛; 抗氧化酶; 非酶抗氧化剂; 盐度胁迫
盐度胁迫以及其他环境因子如重金属、极端温度和强辐射等可诱导细胞内超氧阴离子、过氧化氢、羟基自由基等活性氧自由基(ROS)的产生[1], ROS通过对膜脂、核酸和蛋白的氧化伤害干扰正常的细胞代谢[2]。植物、藻类及其他生物, 可以通过增强酶或非酶抗氧化系统清除氧化胁迫下细胞内产生的ROS[3]。
参与抗氧化的酶系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽氧化酶、过氧化物酶[3], 以及参与抗坏血酸-谷胱甘肽循环的抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶以及谷胱甘肽还原酶(GR)[4]。非酶抗氧化剂包括类胡萝卜素、抗坏血酸(ASA)、还原型谷胱甘肽(GSH)和生育酚等[4]。研究发现, 一些高等植物对盐度胁迫的耐受性与其抗氧化系统清除 ROS的能力呈正相关, 盐度胁迫导致氧化胁迫, 对氧化胁迫耐受性的增强是其耐盐性提高的原因之一[5~7]。盐度胁迫条件下, 耐盐小麦(Triticum aestivum L.)与盐敏感型小麦相比, 细胞内的 H2O2和脂质过氧化产物含量更低, 而SOD、APX和GR酶活性则相对较高[8]。同样, 盐度胁迫条件下耐盐型豌豆(Pisum sativum L.)品种也表现出比盐敏感型品种具有更高活性的APX、GR、SOD和单脱氢抗坏血酸还原酶[9]。与有关高等植物的研究相比, 关于盐度胁迫下藻细胞中抗氧化系统变化的研究很少。高盐胁迫引起耐盐绿藻杜氏藻(Dunaliella tertiolecta)细胞内单脱氢抗坏血酸还原酶和抗坏血酸过氧化物酶活性明显升高,而低盐胁迫引起其GSH和生育酚含量增加、ASA含量下降[10]。海洋绿藻石莼(Ulva fasciata)细胞中,CAT、GR和GSH活性在低盐胁迫下增加, 而在高盐胁迫下SOD、CAT、GR和APX活性升高[11]。
盐生隐杆藻(Aphanothece halophytica)是在饱和NaCl条件下可以生存的少数几种耐盐蓝藻之一[12]。已有报道显示, 盐生隐杆藻具有特殊的调节胞内渗透势的机制以适应高盐生境: 一是细胞内积累可溶性有机溶质氨基乙酸甜菜碱[13]; 二是将 Na+输出细胞[14]。目前还不清楚盐生隐杆藻如何调节其抗氧化防御系统以适应盐度胁迫环境。作者通过分析低盐胁迫和高盐胁迫下盐生隐杆藻抗氧化防御系统的变化, 探讨抗氧化防御系统在盐生隐杆藻耐盐机制中可能发挥的作用。
1 材料和方法
1.1 藻种及其培养条件
盐生隐杆藻(A. halophytica GR02)系从山东广饶盐田分离[15], 使用 Yopp培养基[16], 培养温度为30 °C± 2 °C, 微量元素为 A5和 B6溶液[17], 光照强度为 3 000 lx± 200 lx, 光暗周期为 12 h:12 h。NaCl的最终浓度分别是0.5、0.65、0.75、1、1.5、2、2.5和3 mol/L。藻细胞先在各个盐度下培养14 d, 再转移至相应盐度的新鲜无菌培养基(100 mL)中, 初始A750nm为0.1, 每天手动摇动3次。通过测定在750 nm波长下的A值来反映藻的生长状况, 培养12 d后分别取样分析抗氧化酶和非酶抗氧化剂含量, 每个实验重复3次。
1.2 脂质过氧化作用的测定脂质过氧化作用通过测定丙二醛(MDA)的生成量来衡量。取对数生长期的藻液10 mL, 3 000 r/ min
离心5 min, 将藻细胞沉淀转移到2 mL 0.1 %的三氯乙酸溶液中, 然后冰浴超声(550 Sonic Dismembrator,Fisher Scientific, USA)处理2 min, 进一步分析前细胞匀浆保存在冰浴中。MDA含量的测定采用硫代巴比妥酸方法[18], 按照丙二醛试剂盒(南京建成生物工程研究所)的使用说明进行实验操作, 其单位是nmol/ mg蛋白。
1.3 抗氧化酶活性分析
将按照上述方法收集到的藻细胞重新悬浮于等渗甘油中, 混匀, 0.45 μm 醋酸纤维滤膜过滤, 将藻细胞从滤膜上刮下来, 再转移至2 mL的提取液中。提取液为50 mmol/ L pH 7.8的磷酸钾缓冲液, 其中含 1% (w/v)聚乙烯吡咯烷酮和 0.2 % (v/v)的 Triton X-100。在测定APX酶活性时, 提取液pH 7.0的磷酸钾缓冲液, 其中含0.5 mmol/ L L-ASA)。冰浴中超声处理2 min后, 匀浆于4 °C条件下12 000 r/ min离心 20 min, 测定前将得到的上清液置于冰浴中保存。酶活性单位为U/ mg蛋白。
SOD和GR活性的测定按照南京建成生物工程研究所的试剂盒的使用说明进行。
CAT活性通过测定H2O2在240 nm波长下吸光度值的变化来计算, 其消光度值是 39.4 L/(mmol·cm)[19]。反应液含有 1.9 mL 50 mmol/L 磷酸钾缓冲液(pH 7.0)、1 mL 0.2 % H2O2和0.1 mL 酶提取液。反应在加入酶提取液后开始。
APX活性通过测定ASA在290 nm 处的吸光度值变化值来计算, 消光系数是2. 8 L/(mmol·cm)[20]。3 mL的反应液含 50 mmol/ L 磷酸钾缓冲液(pH 7.0)、0.5 mmol/L 抗坏血酸、0.1 mmol/ L H2O2、0.1 mmol/ L EDTA和0.1 mL的酶提取液。
1.4 ASA和GSH的含量测定
藻细胞收集方法同上。将收集到的藻细胞重悬于2 mL 5 % 磺基水杨酸中, 冰浴超声处理2 min。将得到的细胞匀浆于4°C、12 000 r/ min离心20 min,取上清用南京建成生物工程研究所的试剂盒测定ASA和GSH含量, 单位是μg/ mg 蛋白。
1.5 蛋白质含量测定
蛋白质含量测定采用南京建成生物工程研究所的试剂盒, 分析方法为考马斯亮蓝法[23]。
1.6 统计分析
数据分析采用单因素方差分析法(One-Way ANOVA),P<0.05为差异显著。
2 结果
2.1 盐度胁迫对生长的影响
如图 1所示, 盐生隐杆藻的最适生长盐度为 1 mol/L NaCl, 在实验中作为对照。NaCl浓度高于1mol/ L是高盐胁迫, 低于1mol/ L为低盐胁迫。
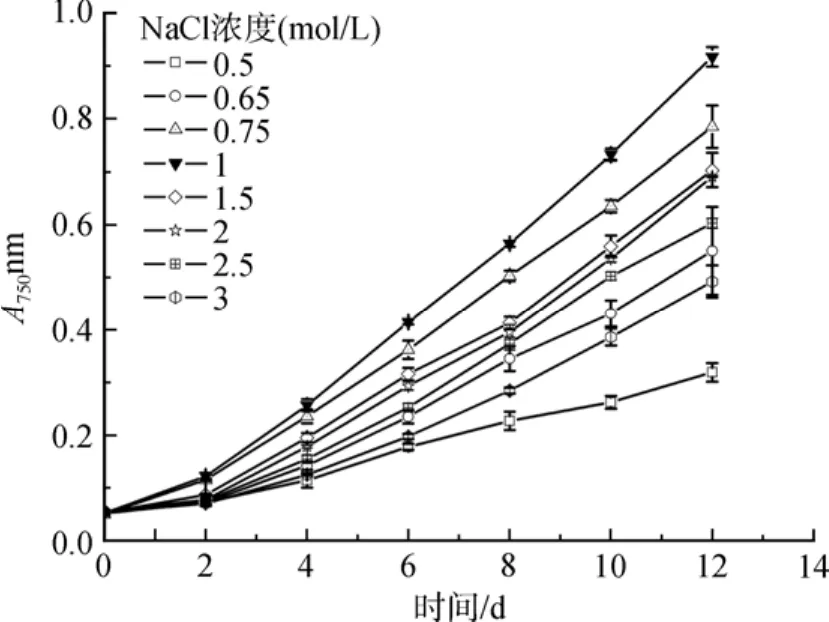
图1 不同盐浓度对盐生隐杆藻生长的影响Fig. 1 Effect of different salt concentrations on the growth of A. halophytica
2.2 盐度胁迫对脂质过氧化的影响
与对照相比, MDA含量随着盐度胁迫程度的增加而升高(图 2)。低盐胁迫下, MDA 的含量增加了10 %到95 %(P<0.05)。在2.5 mol/ L和3 mol/ L NaCl浓度的高盐胁迫下, MDA含量显著增加(分别为 45%和 69 %,P<0.05)。
2.3 盐度胁迫对抗氧化酶活性的影响
盐度胁迫下, 盐生隐杆藻细胞内SOD酶活性高于对照组(图3)。低盐胁迫下SOD活性提高了37 %到200%; 高盐胁迫下SOD活性提高了63%到395%(P<0.05)。
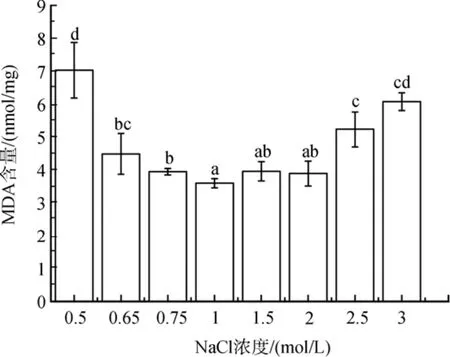
图2 不同盐浓度对盐生隐杆藻脂质过氧化的影响Fig. 2 Effect of different salt concentrations on lipid peroxidation in A. halophytica相同的字母表示差异不显著; 不同字母表示差异显著P <0.05; 下同the Same Letter mean no marked differences; Different letters mean significant differences, P < 0. 05
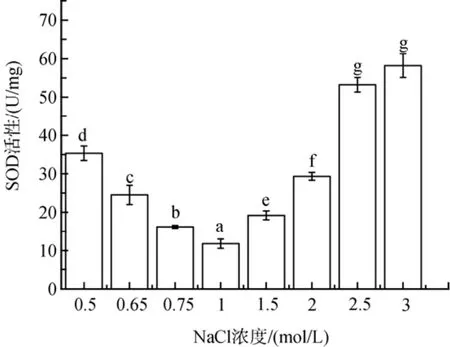
图3 不同盐浓度对盐生隐杆藻SOD活性的影响Fig. 3 Effects of different salt concentrations on SOD activity in A. halophytica
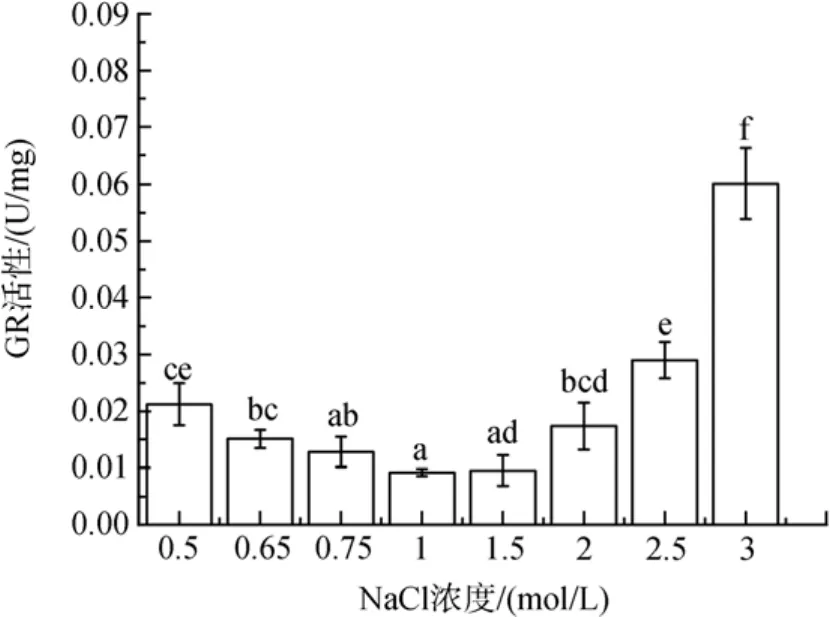
图4 不同盐浓度对盐生隐杆藻GR活性的影响Fig. 4 Effects of different salt concentrations on GR activity in A. halophytica
盐度胁迫导致细胞内GR酶活性升高(图4)。与对照相比, 0.65 和 0.5 mol/ L NaCl浓度的低盐胁迫下, GR活性分别增加了64 % 和130 %(P<0.05); 在高盐胁迫下, GR酶活性在1.5 mol/ L NaCl浓度下稍有增加(P>0.05), 在2、2.5 和 3 mol/ L NaCl浓度下分别增加了88 %、214 %和 552 %(P<0.05)。
盐度胁迫下细胞内 APX活性也增加(图 5)。低盐胁迫下, APX活性随盐度胁迫程度增加, APX活性增加了16 %到174 % (P<0.05)。高盐胁迫下, NaCl浓度为1.5和2 mol/ L时, APX活性稍有增加(P>0.05), 在2.5 和 3 mol/ L NaCl的更高盐度下, 其活性分别增加了123 % 和 184 %(P<0.05)。
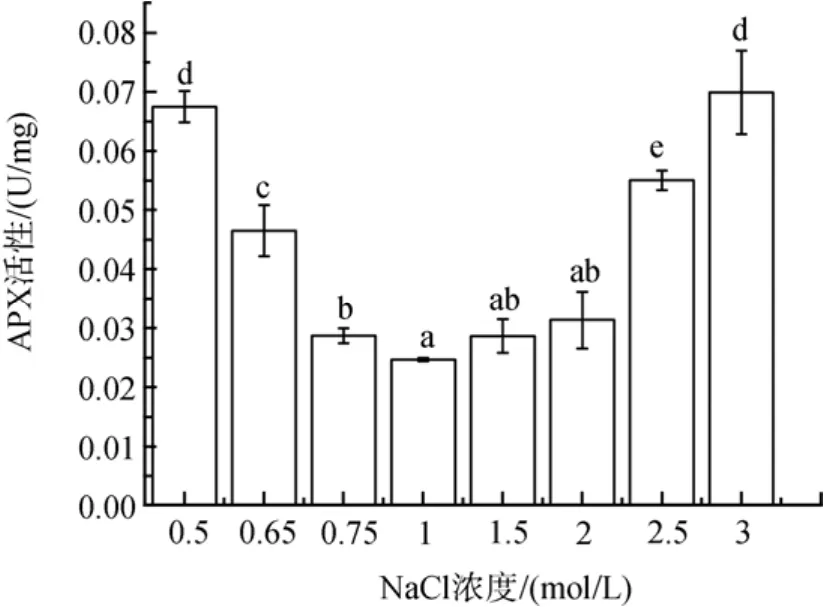
图5 不同盐浓度对盐生隐杆藻APX活性的影响Fig. 5 Effects of different salt concentrations on APX activity in A. halophytica
与前面3种酶的变化不一样, 盐胁迫下CAT活性随着盐度胁迫程度增加而降低(图6)。低盐胁迫下其活性降低了22 %到60 %(P<0.05); 高盐胁迫下,在2、2.5和3 mol/ L NaCl浓度下其活性显著降低, 分别下降了43 %、65 %和52 %(P<0.05)。
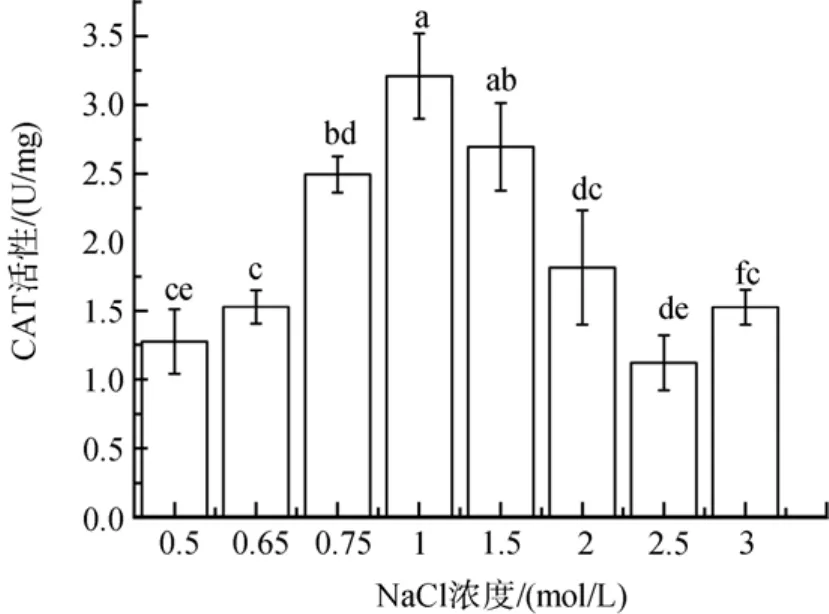
图6 不同盐浓度对盐生隐杆藻CAT活性的影响Fig. 6 Effects of different salt concentrations on CAT activity in A. halophytica
2.4 盐胁迫对ASA和GSH含量的影响
如图7所示, 随着低盐胁迫程度的增加, ASA含量增加了 44 %到 84 %(P<0.05); 高盐胁迫下,NaCl浓度为2、2.5 和 3 mol/ L时其含量显著增加,分别升高了95 %、131 % 和 256 %(P<0.05)。
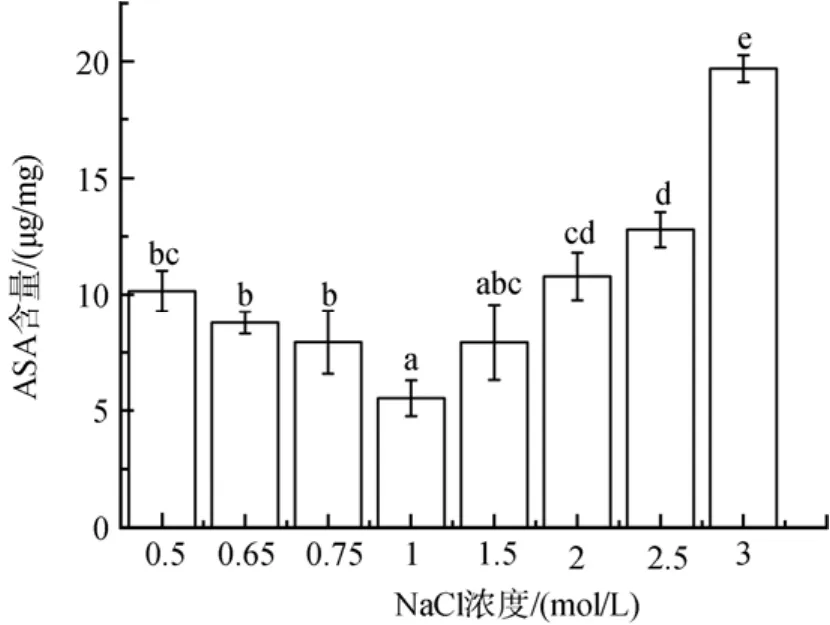
图7 不同盐浓度对盐生隐杆藻ASA含量的影响Fig. 7 Effects of different salt concentrations on ASA content in A. halophytica
低盐胁迫下, 随胁迫程度的增加, GSH含量增加了83 %到136 %(P<0.05)(图8)。高盐胁迫下, GSH含量在2、2.5和3 mol/L NaCl浓度下显著增加, 分别增加了37 %、60 % 和 134 %(P<0.05)。
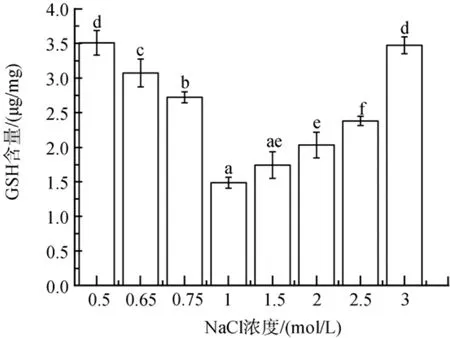
图8 不同盐浓度对盐生隐杆藻GSH含量的影响Fig. 8 Effects of different salt concentrations on GSH content in A. halophytica
3 讨论
0.5 mol/ L NaCl浓度的低盐胁迫条件下盐生隐杆藻比高盐胁迫(2、2.5和3 mol/L NaCl)下生长得更慢, 而与对照1 mol/ L NaCl相比, 低盐胁迫下的盐浓度变化幅度比高盐胁迫要小, 这说明低盐胁迫对盐生隐杆藻生长的抑制更加显著。
MDA是脂质过氧化的产物, 常作为氧化伤害的标志物[22]。有报道指出盐胁迫能引起高等植物和绿藻细胞内 MDA含量的增加[7,11]。本研究中, 盐生隐杆藻的MDA含量在高盐和低盐胁迫下增加, 说明细胞中氧化伤害加剧。如图2所示, 与1.5~2.5 mol/ L的高盐胁迫相比, 0.5 mol/ L的低盐胁迫下盐生隐杆藻的MDA含量更高, 而与对照1 mol/ L NaCl相比,1.5~2.5 mol/ L的高盐胁迫下盐度的变化幅度大于或等于0.5 mol/ L的低盐度胁迫, 这说明盐生隐杆藻对低盐胁迫更敏感。
SOD是细胞防御ROS的第一道防线, 可以催化O2·-发生歧化反应产生H2O2[1]。在高盐胁迫和低盐胁迫下, 盐生隐杆藻SOD活性都增高, 增高的SOD可以参与消除O2·-。盐胁迫条件下盐生隐杆藻SOD活性呈增高趋势, 这与前人关于藻类的研究结果不同,而与一些高等植物相似。盐度胁迫对耐盐绿藻杜氏藻的SOD没有影响[10], 海洋绿藻石莼在12%和15%NaCl的极度高盐胁迫下细胞中SOD的活性增加, 而低盐胁迫和中度高盐胁迫下SOD活性变化不大[11]。在高盐胁迫下, 小麦(Kharchia 65基因型)和棉花(Gossypium herbaceumDhumad)的SOD活性显著增加[8,23]。
GR间接参与 H2O2清除反应, 并将氧化性的GSSG转化为 GSH[24]。在高盐和低盐胁迫下盐生隐杆藻细胞内GR活性增高, 这与之前报道的有关石莼的研究结果一致[11], 但不同于杜氏藻, 盐胁迫对杜氏藻细胞中 GR活性没有明显影响[10]。一些高等植物中的研究结果与盐生隐杆藻的结果相似, 如豌豆、棉花以及小麦等在高盐胁迫下GR活性升高[8,9,23]。
APX和CAT在H2O2清除反应中发挥着重要作用。在ASA-GSH循环中, APX将ASA氧化为单脱氢抗坏血酸, 同时将H2O2还原为H2O[25]。CAT催化H2O2的歧化反应产生H2O和O2[23]。本实验显示, 盐度胁迫下, 盐生隐杆藻细胞中 APX活性增加, 而CAT活性下降, 这说明 APX在清除 H2O2方面发挥了主要作用。这不同于在另外两种藻中的研究报道:杜氏藻细胞中APX的活性只在高盐胁迫下升高, 而盐度胁迫对其CAT无影响[10]; 在低盐和高盐胁迫下石莼的CAT活性均增加, 而APX活性仅在高盐胁迫下增加[11]。与本文研究结果相似, 一些高等植物如小麦和豌豆的APX 活性在高盐胁迫下增高[8,9]。
ASA 和 GSH直接参与 O2·-和 OH·等氧化自由基的清除反应[26]。ASA 是 APX 的底物, 参与清除H2O2的反应, 还参与亲脂性抗氧化剂 α-生育酚的再生过程[3]。GSH可以参与谷胱甘肽-S-转移酶清除过氧化物的反应, 也可以参与谷胱甘肽过氧化物酶还原脂类和烷烃类过氧化物的反应[27,28]。盐度胁迫下盐生隐杆藻的ASA和GSH含量均增加, 说明这两种抗氧化剂在消除ROS过程中发挥了重要作用。盐度胁迫下盐生隐杆藻 ASA和 GSH的变化趋势不同于已报道的另外两种藻类和一些高等植物。石莼的ASA含量在1.5 % NaCl的低盐度胁迫下增高, 而在高盐胁迫下减少; GSH含量在低盐胁迫下增加, 在高盐胁迫下则没有显著变化[11]。杜氏藻的ASA含量在低盐胁迫下有小幅度的减少, 而在高盐胁迫下增加;GSH 在高盐胁迫下增加[10]。一些高等植物, 如豌豆以及番茄 (Lycopersicon esculentum Mill), 在高盐胁迫下ASA 和GSH含量减少[9,25]。
本研究结果显示, 盐胁迫导致盐生隐杆藻细胞内发生氧化伤害。在高盐和低盐胁迫下, 抗氧化物酶SOD、GR和APX的活性以及非酶抗氧化剂ASA和GSH的含量的显著增加可以抵御氧化伤害, 说明在藻细胞的耐盐机制中抗氧化防御系统可能发挥了重要作用。然而, 这些抗氧化物酶和非酶抗氧化剂含量的升高并不能完全抵消盐胁迫伤害, 同时也额外消耗了细胞中的一些能量, 因而与对照相比, 在盐胁迫条件下, 藻的生长仍然受到明显抑制。
[1] Halliwell B, Gutteridge J M C. Free Radicals in Biology and Medicine [M]. Oxford: Clarendon Press. 1989.
[2] Imlay J A. Pathways of oxidative damage [J]. Annu Rev Microbiol, 2003, 57: 395-418.
[3] Noctor G, Foyer C H. Ascorbate and glutathione:keeping active oxygen under control [J]. Ann Rev Plant Physiol Plant Mol Biol, 1998, 49: 249-279.
[4] Foyer C H, Halliwell B. Presence of glutathione and glutathione reductase in chloroplasts: a proposed role in ascorbic acid etabolism [J]. Planta, 1976, 133: 21-25.
[5] Elkahoui S, Hernándezb J A, Abdellyc C, et al. Effects of salt on lipid peroxidation and antioxidant enzyme activities of Catharanthus roseus suspension cells [J].Plant Sci, 2005, 168: 607-613.
[6] Stepien P, Klobus G. Antioxidant defense in the leaves of C3 and C4 plants under salinity stress [J]. Physiol Plant, 2005, 125: 31-40.
[7] Masood A, Shah N A, Zeeshan M, et al. Differential response of antioxidant enzymes to salinity stress in two varieties of Azolla (Azolla pinnata and Azolla filiculoides) [J]. Environ Exp Bot, 2006, 58: 216-222.
[8] Sairam R K, Srivastava G C. Changes in antioxidant activity in sub-cellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress [J]. Plant Sci, 2002, 162: 897-904.
[9] Hernández J A, Jiménez A, Mullineaux P, et al. Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defences [J].Plant Cell Environ, 2000, 23: 853-862.
[10] Jahnke L S, White A L. Long-term hyposaline and hypersaline stresses produce distinct antioxidant responses in the marine alga Dunaliella tertiolecta [J].Plant Physiol, 2003, 160: 1 193-1 202.
[11] Lu I F, Sung M S, Lee T M. Salinity stress and hydrogen peroxide regulation of antioxidant defence system in Ulva fasciata [J]. Mar Biol, 2006, 150: 1-15.
[12] Brock TD. Halophilic blue-green algae [J]. Arch Microbiol, 1976, 107: 109-111.
[13] Laloknam S, Tanaka K, Buaboocha T, et al. Halotolerant cyanobacterium Aphanothece halophytica contains a betaine transporter active at alkaline pH and high salinity [J]. Appl Environ Microbiol, 2006, 72: 6 018-6 026.
[14] Wutipraditkul N, Waditee R, Incharoensakdi A, et al.Halotolerant cyanobacterium Aphanothece halophytica contains NapA-type Na+/H+antiporters with novel ion specificity - That are involved in salt tolerance at alkaline pH [J]. Appl Environ Microbiol, 2005, 71:4 176-4 184.
[15] Li P F, Liu Z L, Xu R. Chemical characterisation of the released polysaccharide from the cyanobacterium Aphanothece halophytica GR02 [J]. J Appl Phycol,2001, 13: 71-77.
[16] Yopp JH, Tindall DR, Miller DM, et al. Isolation, purification and evidence for a halophilic nature of the blue-green alga Aphanothece halophytica Frémy(Chroococcales) [J]. Phycologia, 1978, 17: 172-178.
[17] Borowitzka M A. Algal growth media and sources of algal cultures[A]. Borowitzka M A, Borowitzka L J.Micro-algal Biotechnology[C]. Cambridge: Cambridge University Press, 1988. 456-465.
[18] Heath R L, Packer L. Photoperoxidation in isolated chloroplasts. I. Stoichiometry of fatty acid peroxidation[J]. Arch Biochem Biophys, 1968, 125: 189-198.
[19] Aebi H. Catalase in vitro [J]. Methods Enzymol, 1984,105 : 121-126.
[20] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22: 867-880.
[21] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Anal Biochem, 1976, 72: 248-254.
[22] Cakmak I, Horst J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase and peroxidase activities in root tips of soybean (Glycine max) [J].Physiol Plant, 1991, 83: 463-468.
[23] Garratt L C, Janagoudar BS, Lowe K C, et al. Salinity tolerance and antioxidant status in cotton cultures [J].Free Radical Biol Med, 2002, 33: 502-511.
[24] Bowler C, Vanmontagu M, Inze D. Superoxide dismutase and stress tolerance [J]. Ann Rev Plant Physiol Plant Mol Biol, 1992, 43: 83-116.
[25] Shalata A, Mittova V, Volokita M, et al. Response of the cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii to salt-dependent oxidative stress: The root antioxidative system [J]. Physiol Plant,2001, 112: 487-494.
[26] Vaidyanathan H, Sivakumar P, Chakrabarty R, et al.Scavenging of reactive oxygen species in NaCl-stressed rice (Oryza sativa L.) - differential response in salt-tolerant and sensitive varieties [J]. Plant Sci, 2003,165: 1 411-1 418.
[27] Eshdat Y, Holland D, Faltin Z, et al. Plant glutathione peroxidases [J]. Physiol Plant, 1997, 100: 234-240.
[28] Cummins I. A role for glutathione transferases functioning as glutathione peroxidases in resistance to multiple herbicides in black-grass [J]. Plant J, 1999, 18:285-292.
Changes in antioxidative defense systems of Aphanothece halophytica in response to salt stresses
ZHOU Ya-wei, YAN Ting-ting, LI Peng-fu, LIU Zhi-li
(School of Life Sciences, Nanjing University, Nanjing 210093, China)
Feb., 24, 2010
Aphanothece halophytica;malondialdehyde; antioxidative Enzyme; non-enzymatic antioxidant; salt stress
Aphanothece halophytica is a unique halotolerant cyanobacterium, which can grow even in saturated NaCl. In this study, we investigated the effect of salt stress on the levels of malondialdehyde, two non-enzymatic antioxidants and four antioxidant enzymes in A. halophytica. As compared to control salinity condition, an exposure to hyposaline or hypersaline conditions inhibited the growth of A. halophytica. With the increase of salt stresses,malondialdehyde content, levels of non-enzymatic antioxidants, and antioxidant enzymes increased continuously with the exception of catalase. These results suggest that the levels of non-enzymatic antioxidants and antioxidant enzymes in A. halophytica are increased to counteract the enhanced oxidative stress under salt stresses, and the antioxidant defense system may play an important role in the tolerance mechanism of salt stress.
Q945.78
A
1000-3096(2010)09-0030-06
2010-02-24;
2010-06-15
国家自然科学基金项目(30670400)
周亚维(1983-), 女, 陕西西安人, 硕士, 研究方向: 海洋微藻, 电话: 025-83686755, E-mail: yaweizhou639@gmail.com; 李朋富,通信作者, 电话: 025-83686755, E-mail: pengfuli@nju.edu.cn
(本文编辑: 梁德海)
